|
1. Степени окисления элементов, их связь с положением элементов в Периодической системе. Классы неорганических соединений, номенклатура неорганических соединений
1. Степени окисления элементов, их связь с положением элементов в Периодической системе. Классы неорганических соединений, номенклатура неорганических соединений.
Степень окисления элемента зависит от его положения в Периодической системе. Номер группы в Периодической системе соответствует максимальной степени окисления элемента расположенного в этой группе.
Классы химических соединений: оксиды, основания, кислоты, соли.
Оксиды – соединения, состоящие из 2 элементов (кислород обязательно).
Основания - вещества, которые при диссоциации в воде образуют из отрицательных ионов (анионов) ионы гидроксидов.
Кислоты – вещества, которые при диссоциации в воде из положительно заряженных ионов дают только протоны.
Соли - продукт полного или частичного замещения протонов в кислотах на катионы металлов или в основаниях – гидроксильных групп на кислотные остатки.
2. Планетарная модель атома водорода Резерфорда; постулаты Бора.
Планетарная модель строения атома (рисунок ) : ядро находится в центре атома и вокруг ядра по орбите вращается электрон.
Основная масса атома находится в ядре.
Ядро заряжено положительно электрон находится вне ядра.
Ядро состоит из протонов и нейтронов.
Ядро атома примерно в 10 тысяч раз меньше самого атома.
Аннигиляция - взаимное уничтожения ядра атома и электрона.
В основе постулатов Бора лежит идея о том, что энергия гамма-излучения изменяется по квантам.
1) электроны в атомах водорода вращаются по строго заданным орбитам.
2) находясь на квантованных орбитах, электрон не поглощает и не излучает энергию.
3) излучение и поглощение энергии происходит только при переходе электрона с орбиты на орбиту
3. Уравнение Де-Бройля, корпускулярно-волновые свойства микрообъектов (дуализм), принцип неопределенности Гейзенберга
4. Квантовые характеристики состояний электрона в атоме водорода (квантовые числа).
5. Электронное строение многоэлектронных атомов. Порядок заполнения орбиталей многоэлектронных атомов: принцип Паули, правило Хунда; s-, p-, d-элементы. Полные и неполные электронные аналоги.
Число электронов, которые могут находиться на одном энергетическом уровне, определяется формулой 2n2, где n – номер уровня. Максимальное заполнение первых четырех энергетических уровней: для первого уровня – 2 электрона, для второго – 8, для третьего – 18, для четвертого – 32 электрона. Максимально возможное заполнение электронами более высоких энергетических уровней, в атомах известных элементов не достигнуто.
Квантово-механические расчеты показывают, что в многоэлектронных энергия электронов одного уровня неодинакова; электроны заполняют атомные орбитали разных видов и имеют разную энергию. Каждый энергетический уровень, кроме первого, расщепляется на такое число энергетических подуровней, сколько видов орбиталей включает этот уровень. Второй энергетический уровень расщепляется на два подуровня (2s – и 2p-подуровни), третий энергетический уровень – на три подуровня (3s-, 3p- и 3d-подуровни).
Каждый s-подуровень содержит одну s орбиталь, каждый р-подуровень – три р-орбитали, каждый d-подуровень семь f-орбиталей.
Закономерность заполнения электронных оболочек атомов определяется принципом запрета, установленным в 1925 г швейцарским физиком Паули (принцип Паули):
В атоме не могут одновременно находиться два электрона с одинаковым набором четырех квантовых квантовых чисел (заполнение электронами орбиталей происходит следующим образом: сначала на каждой орбитали располагается по одному электрону, затем, после заполнения всех орбиталей происходит распределение вторых электронов с противоположным спином).
Заселение электронами энергетических уровней, подуровней и атомных орбиталей подчиняется следующему правилу:
В невозбужденном атоме все электроны обладают наименьшей энергией (принцип наименьшей энергии).
Это означает, что каждый из электронов, заполняющих оболочку атома, занимает такую орбиталь, чтобы атом в целом имел минимальную энергию. Последовательно квантовое возрастание энергии подуровней происходит в следующем порядке: 1s - 2s -2р - 3s – 3р - 4s –3d - 4р - 5s -….
Такой порядок увеличения энергии подуровней определяет расположение эле Ментов в Периодической системе.
Заполнение атомных орбиталей внутри одного энергетического подуровня происходит в соответствии с правилом, сформулированным немецким физиком Ф. Хундом (1927г) (правило Хунда):
При данном значении квантового числаl (т.е. в пределах одного подуровня) в основном состоянии электроны располагаются таким образом, что значение суммарного спина атома максимально. Это означает, что на подуровне должно быть максимально возможное число неспаренных электронов.
Электронные аналоги:
Сравнивая атомные структуры элементов при характерных для них валентных состояниях, можно обнаружить наличие в группах двух различных случаев аналогии.
Первый случай: элементы имеют однотипные структуры внешних электронных оболочек при любой заданной валентности, и поэтому могут считаться полными аналогами. Так, все стоящие друг под другом элементы больших периодов являются полными аналогами.
Второй случай: однотипность структуры наружных электронных оболочек распространяется лишь на некоторые валентности, и поэтому относящиеся сюда элементы могут считаться неполными аналогами. Элементы главных подгрупп являются аналогами соответствующих типических (т. е. находящихся в малых периодах) элементов при всех валентностях, кроме отвечающей номеру группы высшей положительной (характеристичной), а элементы побочных подгрупп, наоборот, не являются аналогами типических элементов при всех валентностях, кроме характеристичной.
6. Форма и пространственное расположение s-, p- и d- орбиталей в атоме.
7. Радиусы атомов, их изменение в периодах и группах Периодической системы. Зависимость кислотно-основных свойств соединения от радиуса центрального атома.
Радиус атома – некоторая сфера в которой расположено 90% электронной плотности.
По периоду радиус атома уменьшается при увеличении кулоновских сил.
По группе радиус увеличивается(если он увеличивается, то L (длина связи) увеличивается
HF
HCl
HBr
HI
Разрыв происходит там где радиус больше
8.Энергия ионизации; сродство к электрону. Изменение в периодах и группах Периодической системы.
Энергия ионизации(потенциал ионизации)- энергия которая необходима для отрыва электрона от атома на бесконечно большое расстояние.
По периоду слева направо энергия ионизации увеличивается.
Энергия сродства электронов
Энергия которая необходима для присоединения электрона в атому (Eср)
Слева направо в следствии уменьшения радиуса атома энергия сродства электр. увеличивается.
По группе уменьшается так как радиус увеличивается
Соответсвенно изменяется ЭО
9. Электроотрицательность атомов элементов. Относительная электроотрицательность. Изменение в периодах и группах Периодической системы. Полярность химической связи,полярность молекул и ионов.
Электроотрицательность (э.о.)- это способность атома смещать к себе электронные пары.
Мерой э.о. является энергия равняя арифметически ½ сумме энергии ионизации I и энергии сходства к электронц Е
Э.О. = ½ (I+E)
Относительная электроотрицательность. (ОЭО)
Фтору как самому сильному э.о элементу присваивается значение 4.00 относительно которого рассматриваются остальные элементы.
Изменения в периодах и группах Периодической системы.
Внутри периодов с увеличением заряда ядра слева направо увеличивается электроотрицательность.
Наименьшее значение наблюдается у щелочных и щелочноземельных металлов.
Наибольшее - у галогенов.
Чем выше электроотрицательность, тем сильнее у элементов выражены неметаллические свойства.
Внутри групп э.о. уменьшается.
Металлические свойства элементов возрастают.
Металлические элементы на внешнем энергетическом уровне содержат 1,2,3 электрона и характеризуются низким значением ионизационных потенциалов и э.о. потому что металлы проявляют выраженную тенденцию к отдаче электронов.
Неметаллические элементы отличаются более высоким значением энергии ионизации.
По мере заполнения наружной оболочки у неметаллов внутри периодов уменьшается радиус атомов. На внешней оболочке число электронов равно 4,5,6,7,8.
Полярность химической связи. Полярность молекул и ионов.
Полярность химической с вязи – определяется смещением связей электронной пары к одному из атомов.
Химическая связь возникает за счет перераспределения электронов валентных орбиталей, в результате чего возникает устойчивая электронная конфигурация благородного газа, за счет образования ионов или образования общих электронных пар.
Химическая связь характеризуется энергией и длиной.
Мерой прочности связи служит энергия, затрачиваемая на разрушение связи.
Например. Н – Н = 435 кДж моль-1 моль-1
10. Причина образования химической связи. Метод валентных связей. Обменный и донорно-акцепторный механизмы образования химической связи. Характеристики химической связи : энергия, длина, кратность, полярность
В результате образования химической связи общая энергия системы уменьшается.
МВС-обменный механизм образования химической связи. Согласно МВС образование химической связи происходит в результате обмена электронов между атомами участвующих в химической связи.
Обменный механизм - когда каждый из взаимодействующих атомов поставляет по одному электрону.
Донорно-акцепторный механизм - способ образования химической связи между двумя атомами или группой атомов, осуществляемая за счет неподеленной пары электронов, атома-донора и свободной орбитали атома-акцептора.
Характеристика химической связи:
Длина – средне статистическое расстояние между ядрами.
Кратность – количество электронов участвующих в образовании химической связи.
11. Ковалентная химическая связь. Особенности ковалентной связи: направленность и насыщаемость (приведите примеры).
Ковалентная связь — химическая связь, образованная перекрытием (обобществлением) пары валентных электронных облаков. Обеспечивающие связь электронные облака (электроны) называются общей электронной парой.
Направленность связи обусловлена молекулярным строением вещества и геометрической формы их молекулы. Углы между двумя связями называют валентными.
Насыщаемость — способность атомов образовывать ограниченное число ковалентных связей. Количество связей, образуемых атомом, ограничено числом его внешних атомных орбиталей.
12. Понятие о гибридизации атомных орбиталей и его применение для описания конфигурации молекул и ионов. Приведите примеры соединений.
Сущность гибридизации атомных орбиталей состоит в том, что электрон молекулы вблизи выделенногибридная орбиталь атомногибридная орбиталь ядра характеризуется не отдельной атомной орбиталью, а линейной комбинацией атомных орбиталей с различным значениями азимутальногибридная орбиталь и магнитногибридная орбиталь квантовых чисел. Такая линейная комбинация называется гибридной (гибридизированной) орбиталью. Как правило, гибридизация затрагивает лишь высшие и близкие по энергии занятые атомные орбитали свободногибридная орбиталь атома. Например, для атомов элементов второгибридная орбиталь периода периодической системы типичная форма гибридной орбитали 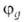 - линейная комбинация 2s-орбитали - линейная комбинация 2s-орбитали 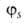 и 2р-орбиталей и 2р-орбиталей 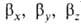 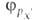 , , 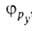 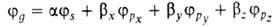 , , 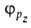 с численными коэффициентами. с численными коэффициентами.
Гибридные орбитали обладают более низкой симметрией, чем составляющие их атомные орбитали. Так, распределение электронной плотности, отвечающее указанной гибридной орбитали 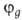 , смещено от атомного ядра в направлении вектора п с координатами , смещено от атомного ядра в направлении вектора п с координатами 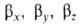 ; вектор п является осью симметрии гибридной орбитали (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип гибридной орбитали. ; вектор п является осью симметрии гибридной орбитали (рис. 1). При изменении ориентации в пространстве осей координат коэффициенты линейной комбинации могут изменяться, однако остается постоянным отношение сумм квадратов коэффициентов для данного значения азимутального квантового числа. Это отношение определяет тип гибридной орбитали.
Например, орбиталь 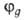 относится к типу sapb, где а и b- числа, подобранные так, чтобы относится к типу sapb, где а и b- числа, подобранные так, чтобы 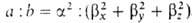 . Обычно принимают а — 1, b = 1, 2 или 3. . Обычно принимают а — 1, b = 1, 2 или 3.
Как правило, гибридные орбитали данного атома в молекуле относятся к одному типу, который называют типом гибридизации атома. Так, атом N в молекуле аммиака имеет гибридизацию атомных орбиталей типа sp3, атом С вмолекуле этилена - sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию. Это дает основание отождествлять тип гибридизации атома в молекуле с символом его некоей гипотетической электронной конфигурации.
Обычно система гибридных орбиталей строится таким образом, чтобы для разных орбиталей одногибридная орбитальатома интегралы перекрывания были равны нулю. Кроме того, каждая орбиталь в молекуле либо остается негибридизированной атомной орбиталью, либо выбирается гибридизированной по определенному типу. Этим требованиям удовлетворяют несколько наборов орбиталей. Например, атом О в молекуле Н2О можно считать как sp2-, так и 5р3-гибридизированным.
Оси симметрии всех орбиталей обычно образуют симметричную фигуру (см. рис. 2). Операции симметрии этой фигуры переводят гибридные орбитали одного атома друг в друга. Такие гибридные орбитали называют эквивалентными. Например, линейная комбинация четырех валентных атомных орбиталей атома С приводит к четырем 5р3-гибридным орбиталям, оси симметрии которых по отношению друг к другу расположены под углом 109,5°, т.е. направлены по углам тетраэдра (рис. 2, в).
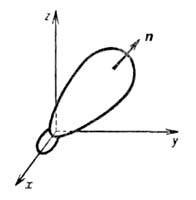 Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии. Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии.
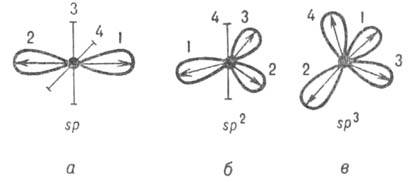 Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности. Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.
Представление о гибридизации атомных орбиталей используется для изучения закономерностей изменения электронной плотности молекулы вблизи какого-либо атомного ядра в зависимости от его окружения, то есть позволяет установить связь между электронным строением молекулы и ее структурой. При этом возможны различные подходы к анализу этой связи. Если известно геометрическое расположение атомных ядер, расчет волновой функции молекулы можно свести к изучению парных взаимодействий соседних атомов.
Отклонение конфигурации молекулы от симметричной связывают с взаимодействием химических связей (напр., с отталкиванием пар электронов, образующих связь). В такой форме представления о гибридизации атомных орбиталей используются в стереохимии.
Понятие о гибридизации атомных орбиталей введено в химию Л. Полингом в 1931.
2 Вариант:
Процесс смешивания разных (s,p,d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам
(Те же самые рисунки)
Пример: BCl3 – гибрид. sp2
13. Теория отталкивания σ-связывающих и неподелённых электронных пар и её применение для описания геометрической конфигурации молекул и ионов.
Молекула всегда будет принимать форму, при которой отталкивании внешних электронных пар минимально.
Этой теорией объясняется и предсказывается геометрия молекул.
14. Структура Периодической системы элементов: периоды, группы, подгруппы, вставные декады. Взаимосвязь между электронной структурой атомов элементов и их положением в Периодической системе.
Периодическая система имеет 7 периодов, 8 групп, каждая из которых условно подразделяется на главную и побочную подгруппу. Номер группы определяет число валентных электронов в атомах элементов.
S – элементы – 1 и 2 группы главной подгруппы
p- элементы - 3 – 8 группы главной подгруппы
d-элементы – побочные подгруппы
15. Валентные возможности атомов элементов в химических соединениях. Валентные возможности атомов – это допустимые валентности элемента, весь спектр их значений в различных соединениях.
16. Газообразное и конденсированное состояния. Валентные и невалентные (ван-дер-ваальсовы) силы сцепления. Водородная связь.
КОНДЕНСИРОВАННОЕ СОСТОЯНИЕ вещества - жидкое и твердое агрегатные состояния вещества. Переход вещества из газообразного в конденсированное состояние называется конденсацией. Ван-дер-ваальсовы силы — силы межмолекулярного взаимодействия с энергией 0,8 — 8,16 кДж/моль. Этим термином первоначально обозначались все такие силы, но сейчас он обычно применяется к силам, возникающим при поляризации молекул и образовании диполей. Водородная связь — разновидность донорно-акцепторной связи, невалентное взаимодействие между атомом водорода H,ковалентно связанным с атомом A группы A-H молекулы RA-H и электроотрицательным атомом
17. Термохимические уравнения. Тепловой эффект и изменение стандартной энтальпии химической реакции.
Термохимические уравнения включают в себя кроме химических формул тепловой эффект реакции. Числовое значение в уравнении реакции строго соответствует количествам веществ, участников реакции, т.е. коэффициентам. Благодаря этому соответствию, можно установить пропорциональные отношения между количеством вещества или массой и количеством теплоты в этой реакции.
Например: Термохимическое уравнение разложения малахита
(CuOH)2 CO3 = 2CuO + H 2 O + CO 2 - 47 кДж
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
18. Закон Гесса и следствия из него. Применение закона Гесса для расчёта изменения энтальпии химических реакций.
Закон Гесса — основной закон термохимии, который формулируется следующим образом:
Тепловой эффект химической реакции, проводимой в изобарно-изотермических или изохорно-изотермических условиях, зависит только от вида и состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Таким образом, пользуясь табличными значениями теплот образования или сгорания веществ, можно рассчитать теплоту реакции, не прибегая к эксперименту. Табличные величины теплот образования и сгорания веществ обычно относятся к т. н. стандартным условиям. Для расчёта теплоты процесса, протекающего при иных условиях, необходимо использовать и другие законы термохимии, например, закон Кирхгофа, описывающий зависимость теплового эффекта реакции от температуры.
19. Влияние температуры на величину свободной энергии Гиббса и константу равновесия.
Стандартная энергия Гиббса образования ΔGо298 некоторых веществ
Вещество
|
Состояние
|
ΔGо298, кДж/моль
|
Вещество
|
Состояние
|
ΔGо298, кДж/моль
|
BaCO3
|
к
|
-1138,8
|
FeO
|
к
|
-244,3
|
CaCO3
|
к
|
-1128,75
|
H2O
|
ж
|
-237,19
|
Fe3O4
|
к
|
-1014,2
|
H2O
|
г
|
-228,59
|
BeCO3
|
к
|
-944,75
|
PbO2
|
к
|
-219,0
|
СаО
|
к
|
-604,2
|
CO
|
г
|
-137,27
|
ВеО
|
к
|
-581,61
|
CH4
|
г
|
-50,79
|
ВаО
|
к
|
-528,4
|
NO2
|
г
|
+51,79
|
СО2
|
г
|
-394,38
|
NO
|
г
|
+86,69
|
NaCl
|
к
|
-384,03
|
C2H2
|
г
|
+209,20
|
20. Понятие о скорости химической реакции. Факторы, влияющие на скорость реакции в гомогенных и гетерогенных системах. Закон действующих масс.
Скорость химической реакции — изменение количества одного из реагирующих веществ за единицу времени в единице реакционного пространства. Является ключевым понятием химической кинетики. Скорость химической реакции — величина всегда положительная, поэтому, если она определяется по исходному веществу (концентрациякоторого убывает в процессе реакции), то полученное значение домножается на −1.
Например для реакции:
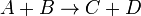
выражение для скорости будет выглядеть так:
![v = \frac{d[ c ]}{dt} = - \frac{d[ a ]}{dt}](5319_html_e87e32b.png) . .
Зако́н де́йствующих масс устанавливает соотношение между массами реагирующих веществ в химических реакциях при равновесии, а также зависимость скорости химической реакции от концентрации исходных веществ.
21. Факторы, влияющие на скорость химической реакции. Энергия активации химической реакции как потенциальный барьер реакции
Скорость химической реакции зависит от природы реагирующих веществ и условий протекания реакции: концентрации с, температуры t , присутствия катализаторов, а также от некоторых других факторов (например, от давления - для газовых реакций, от измельчения - для твердых веществ, от радиоактивного облучения).
Энергия активации в элементарных реакциях, минимальная энергия реагентов (атомов, молекул и других частиц), достаточная для того, чтобы они вступили в хим. реакцию, т. е. для преодоления барьера на поверхности потенциальной энергии, отделяющего реагенты от продуктов реакции.
Потенциальный барьер - максимум потенциальной энергии, через который должна пройти система в ходе элементарного акта химического превращения. Высота потенциального барьера для любого пути, проходящего через переходное состояние, равна потенциальной энергии в переходном состоянии.
22. Динамический характер химического равновесия. Расчет констант химического равновесия, исходные и равновесные концентрации
Химическое равновесие имеет динамический характер. Это значит, что и прямая и обратная реакции при равновесии не прекращаются.
K= [Km+ ] n [A n- ]m /[ knAm]
Расчет равновесных концентраций в р-рах слабых электролитов
Если Ск/К>>100,то [H+] =√ К* Ск
Отсюда [ОH-] = Kw/ [H+]
[H+] = [кисл. ост.] [
В противном случае
[H+] =√( к^2 +4kc) – k/ 2
Отсюда [ОH-] = Kw/ [H+]
[H+] = [кисл. ост.]
23. Смещение химического равновесия при изменении концентраций реагентов, давления, температуры. Принцип Ле-Шателье.
1) Изменение концентраций.
При увеличении концентрации исходных компонентов, скорость реакции увеличивается
2)Изменение давления.
Этот фактор действует только если исходные вещества-газы. При увеличении давления скорость возрастает
3)Изменение температуры.
При нагревании скорость реакции возрастает. Правило Вант-Гоффа: Если повышать температуру на 10 градусов, то скорость увеличивается в 2-4 раза.
Принцип Ле-Шателье: если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура ,давление, концентрация), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
24. Растворы как гомогенные системы. Гидраты, сольваты. Ненасыщенные, насыщенные и пересыщенные растворы
25. Электролитическая диссоциация веществ в растворах. Кислоты, основания, амфотерные гидроксиды, соли. Сильные и слабые электролиты.
Электролитическая диссоциация — процесс распада электролита на ионы при растворении его в полярном растворителе или при плавлении.
Сильные электролиты — химические соединения, молекулы которых в растворах практически полностью диссоциированы на ионы. Степень диссоциации таких электролитов близка к 1. К ним относят все соли, сильные неорганические кислоты, щелочи.
Слабые электролиты — химические соединения, молекулы которых даже в сильно разбавленных растворах незначительно диссоциированны на ионы, которые находятся в динамическом равновесии с недиссоциированными молекулами. Это почти все органические кислоты и вода, некоторые неорганические кислоты: HF, HClO, HNO2, H2S, H3PO4,H2CO3, H2SiO3 , а также гидроксид аммония.
26. Роль молекул растворителя в процессах электролитической диссоциации. Аквакомплексы металлов, их кислотные свойства.
Диссоциация на ионы в растворах происходит вследствие взаимодействия растворённого вещества с растворителем, благодаря возникающему электростатическому взаимодействию растворителя и катионами и анионами.
Аквакомлексы- координационные соединения, содержащие в качестве лигандов одну или несколько молекул воды, связанных с центральным атомом металла через кислород.
Кислотные свойства: Кислотные свойства аквакомплексов выражены тем сильнее, чем выше степень окисления атома-комплексообразователя.
27. Электролитическая диссоциация сильных и слабых электролитов в водных растворах. Вычисление концентраций ионов.
Для сильных электролитов в водном растворе по определению α = 1: диссоциация таких электролитов протекает необратимо (до конца), и степень превращения растворенного вещества в ионы полная.
Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1).
28. Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель.
Вода является слабым электролитом
Ионное произведение воды
![k\left[h_2o\right]=\left[h^+\right]\left[oh^-\right]](5319_html_m1fc41dc3.png)
При нормальных условиях
k= 10−14
[H+] = 10−7
Водородный показатель-мера активности (в очень разбавленных растворах она эквивалентна концентрации) ионов водорода в растворе, и количественно выражающая его кислотность, вычисляется как отрицательный (взятый с обратным знаком) десятичный логарифм активности водородных ионов, выраженной в молях на литр:
![\mbox{ph} = -\lg \left[ \mbox{h}^+ \right]\!](5319_html_73a943ab.png)
В нейтральной р-ре он равен 7, в кислом будет меньше 7, в щелочном больше.
29. Основные положения теорий кислот и оснований Аррениуса и Бренстеда-Лоури. Зависимость кислотно-основных свойств соединений от степени окисления центрального иона.
Бренстеда-Лоури
Кислота- любая частица, которая в ходе химической реакции выступает донором протонов.
Основание-любая частица, которая в ходе химической реакции выступает акцептором протона.
Сущностью кислотно-основного взаимодействия является передача протона от кислоты к основанию. При этом кислота, передав протон основанию, сама становится основанием, так как может снова присоединять протон, а основание становится кислотой
Аррениуса
Теория работает только для водных р-ров
Согласно теории электролитической диссоциации, кислоты — это вещества, образующие в водном растворе гидратированные катионы водорода Н+и анионы кислотного остатка; основания в водном растворе диссоциируют с образованием катионов металла и гидроксид-анионов ОН
С ростом степени окисления центрального иона увеличиваются кислотные свойства соединения.
30. Амфотерность гидроксидов с точки зрения теории электролитической диссоциации (приведите примеры).
Амфотерные гидроксиды- химические вещества, которые в кислой среде ведут себя как основания, а в щелочной — как кислоты.( гидроксид алюминия)
31. Равновесия в насыщенных растворах малорастворимых солей. Расчёт растворимости малорастворимой соли. Способы увеличения растворимости малорастворимых солей.
Факторы, влияющие на растворимость малорастворимых солей и смещение равновесия:
1)температура
2)одноименный ион
3)солевой эффект
4)кислотность(рН)
5)гидролиз
Для смещения равновесия можно нагреть, добавить одноименный ион, добавить хорошо р-римую соль, кислоту.
Растворимость рассчитывается исходя из его Пр( произведение активных концентраций в насыщенном р-ре малорастворимого электролита при постоянной температуре)
32. Гидролиз солей, образованных: а) сильным основанием и слабой кислотой; б) слабым основанием и сильной кислотой. Качественная оценка рН растворов гидролизующихся солей.
а) соли, образованные сильным основанием и слабой кислотой гидролизуются по аниону, рН р-ра будем больше 7,что говорит о щелочном характере среды.
б) соли, образованные слабым основанием и сильной кислотой гидролизуются по катиону, в этом случае рН должен быть меньше 7,что говорит о наличии в р-ре кислой
среды.
Равновесия в водных растворах солей, содержащих многозарядные катионы металлов. Вычисление рН (приведите примеры).
Соли тяжелых металлов в водном р-ре всегда выступают в роли кислоты(по Бренстеду).
Например AlCl3+ H2O→[Al(H2O)5(OH)] 2+ + H3O+
ka= Kw / Kb
[Н]+=√ ka * C
pH=lg [Н]+
Окислительно-восстановительные реакции. Типичные окислители и восстановители. Соединения с двойственной функцией. Приведите примеры.
Окисление - процесс отдачи вещ-вом (атомами, молекулами, ионами)
электронов, в результате которого увеличивается степень окисления элемента.
Восстановление- процесс присоединения электронов, степень окисления уменьшается.
Окисление и восстановление - взаимосвязанные процессы, протекающие одновременно
и поэтому представляют собой две стороны единого процесса окисления-восстановления. При этом число электронов, участвующих в процессах окисления и восстановления, должно быть одним и тем же.
Типичные окислители: галлологены, кислород, серная, азотная кислоты, перманганат калия, дихромат калия и др.
Типичные восстановители: металлы, водород, сернистая кислота, оксид углерода(2)
35. Стандартный ( нормальный) окислительно-восстановительный потенциал, определение напрвления о.-в. реакции
Окисл.-восст. Реакции – реакции, протекающие с изменением степеней окисления атомов, входящих в состав реагирующих веществ, путем перераспределения электронов между окислителем и восстановителем.
Типичные окисл: KClO3, H2SO4, HNO3 и т.д.
Типичные восст: H2, Zn, HCl и т.д.
36.Реакции самоокисления - самовосстановления (диспропорционирования). Внутримолекулярные окислительно – восстановительные процессы.
Стандартный окислительно-восстановительный потенциал — мера способности химического вещества присоединять электроны (восстанавливаться). Окислительно-восстановительный потенциал выражают в милливольтах (мВ).
Направления окислительно-восстановительной реакции определяется константой равновесия.
Lg k = ((E10 –E20)n) / 0.059;
Где E10 ;E20 - Стандартные окислительно-восстановительные потенциалы.
n – чисто электронов
37. Уравнение Нерста. Влияние кислотности раствора на величину окислительно - восстановительного потенциала. Выбор среды для проведения окислительно-восстановительного процесса.
Диспропорционрование - это когда одно и то же вещество является оновременно и окислительем и восстановительем. Такие реакции бывают когда элемент находиться в промежуточной степени окислени
Во внутримолекулярных реакциях окислитель и восстановитель находятся в одной и той же молекуле. Внутримолекулярные реакции протекают, как правило, при термическом разложении веществ, содержащих окислитель и восстановитель.
2KCl+5O3-2 -> 2KCl-1 + 3O20
Cl+5 - окислитель; О-2 - восстановитель
N-3H4N+5O3 –t°-> N2+1O + 2H2O
N+5 - окислитель; N-3 - восстановитель
2Pb(N+5O3-2)2 -> 2PbO + 4N+4O2 + O20
N+5 - окислитель; O-2 - восстановитель
38. Координационные соединения. Центральный атом и лиганды, внутренняя и внешняя сферы комплексных соединений, координационное число.
КООРДИНАЦИОННЫЕ СОЕДИНЕНИЯ (комплексные соед.), содержат катионный, анионный или нейтральный комплекс, состоящий из центр. атома (или иона) и связанных с ним молекул или ионов - лигандов.
Лига́нд (от лат. ligare — связывать) — атом, ион или молекула, связанные с неким центром (акцептором). Понятие применяется в химии комплексных соединений, обозначая там присоединенные к одному или нескольким центральным (комплексообразующим) атомам металла частицы. При присоединении лигандов к центральному атому химические свойства комплексообразователя и самих лигандов часто претерпевают значительные изменения.
Внутренняя сфера комплексного соединения – центральный атом со связанными с ним лигандами, то есть, собственно, комплексная частица.
Внешняя сфера комплексного соединения – остальные частицы, связанные с комплексной частицей ионной или межмолекулярными связями, включая водородные.
Координационное число (КЧ) – число - связей, образуемых центральным атомом с лигандами. Для комплексных соединений с монодентантными лигандами КЧ равно числу лигандов, а в случае полидентантных лигандов - числу таких лигандов, умноженному на дентатность.
39. Строение координационных соединений , гибридизация орбиталей центрального атома.
Строение комплексных соединений рассматривают на основе координационной теории, предложенной в 1893 г. швейцарским химиком Альфредом Вернером, лауреатом Нобелевской премии. Его научная деятельность проходила в Цюрихском университете. Ученый синтезировал много новых комплексных соединений, систематизировал ранее известные и вновь полученные комплексные соединения и разработал экспериментальные методы доказательства их строения.
В соответствии с этой теорией в комплексных соединениях различают комплексообразователь, внешнюю и внутреннюю сферы. Комплексообразователем обычно является катион или нейтральный атом. Внутреннюю сферу составляет определенное число ионов или нейтральных молекул, которые прочно связаны с комплексообразователем. Их называют лигандами. Число лигандов определяет координационное число (КЧ) комплексообразователя. Внутренняя сфера может иметь положительный, отрицательный или нулевой заряд.
Остальные ионы, не разместившиеся во внутренней сфере, находятся на более далеком расстоянии от центрального иона, составляя внешную координационную сферу.
Если заряд лигандов компенсирует заряд комплексообразователя, то такие комплексные соединения называют нейтральными или комплексами-неэлектролитами: они состоят только из комплексообразователя и лигандов внутренней сферы. Таким нейтральным комплексом является, например, [Pt(NH3)2Cl2].
Гибридизация орбиталей — гипотетический процесс смешения разных (s, p, d) орбиталей центрального атома многоатомной молекулы с возникновением того же числа орбиталей, эквивалентных по своим характеристикам.
40. Изомерия комплексных соединений.
41. Равновесия в растворах комплексных соединений.
Диссациация комплексного соединения-сильного электролита на составляющие его ионы
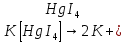 ] ]
[Pt( ] ] →[Pt( →[Pt( ]+2Cl ]+2Cl
Растворение происходит по ступеням.
Каждой ступени присуща своя константа не стойкости ( ) )
 -парциальная константа -парциальная константа
[Pt( ]→[Pt( ]→[Pt( ,К1 ,К1
[Pt(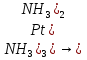 ]+ ]+ ,K2 ,K2
[Pt(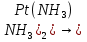 ]+ ]+ ,K3 ,K3
[Pt( ]→Pt+ ]→Pt+ ,K4 ,K4
 = = =K1*k2*k3*k4 =K1*k2*k3*k4
Чем меньше константа екустойчивости тем устойчивие соединение. |
|
|
 Скачать 87.66 Kb.
Скачать 87.66 Kb.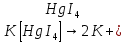 ]
] ]
] →[Pt(
→[Pt( ]+2Cl
]+2Cl )
) -парциальная константа
-парциальная константа ]→[Pt(
]→[Pt( ,К1
,К1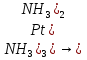 ]+
]+ ,K2
,K2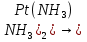 ]+
]+ ,K3
,K3 ]→Pt+
]→Pt+ ,K4
,K4 =
= =K1*k2*k3*k4
=K1*k2*k3*k4
 моль-1
моль-1 Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии.
Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей; х, у, z- координатные оси, п-ось симметрии. Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.
Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б, в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.