Отчет по лабораторной работе Измерение давления насыщенного пара
 Скачать 364.34 Kb. Скачать 364.34 Kb.
|
|
Федеральное государственное автономное образовательное учреждение высшего образования «СИБИРСКИЙ ФЕДЕРАЛЬНЫЙ УНИВЕРСИТЕТ» Институт цветных металлов и материаловедения. Кафедра аналитической и органической химии. ОТЧЕТ ПО ЛАБОРАТОРНОЙ РАБОТЕ «Измерение давления насыщенного пара» Преподаватель________ Л.Г. Чумилина Студент ЦМ16-01Б(а) 061621300________Д.И. Макарова ЦМ16-01Б(а) 061521332 ________И.О.Демиденко Красноярск 2018 г Цель работы:ознакомиться с методом измерения давления насыщенного пара веществ, а также измерить давление насыщенного пара жидкости при различных температурах и рассчитать изменение энтальпии и энтропии жидкости. Теория П 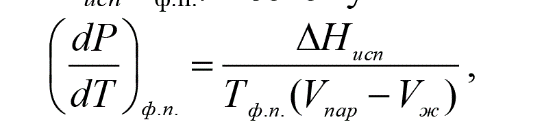 ар, находящийся в равновесии с конденсированной фазой (жидкой или твердой), называется насыщенным. Давление насыщенного пара вещества (Р0) зависит от его природы и температуры и не зависит от количества этого вещества и от объема пара. Равновесие между конденсированной фазой и паром является динамическим. Эти фазы непрерывно обмениваются микрочастицами (атомами, молекулами). При этом в единицу времени число частиц, покинувших данную фазу и перешедших в нее, одинаково. ар, находящийся в равновесии с конденсированной фазой (жидкой или твердой), называется насыщенным. Давление насыщенного пара вещества (Р0) зависит от его природы и температуры и не зависит от количества этого вещества и от объема пара. Равновесие между конденсированной фазой и паром является динамическим. Эти фазы непрерывно обмениваются микрочастицами (атомами, молекулами). При этом в единицу времени число частиц, покинувших данную фазу и перешедших в нее, одинаково.где Hисп – теплота образования 1 моль пара при испарении или мольная теплота испарения. Уравнение Клаузиуса-Клапейрона – является строгим; оно показывает, что производная dP/dT всегда положительна, т.е. с ростом температуры давление насыщенного пара возрастает. Рассмотрим следующие допущения. 1. Используя уравнение Ван-дер-Ваальса можно показать, что отклонение давления насыщенного пара от идеального при Р < 1 атм не превышает 1% и не зависит ни от сложности молекул, ни от Ткип. Иными словами, насыщенный пар при Р < 1 атм подчиняется законам идеальных газов. Тогда Vпар = RT/P. 2. Vж/Vпар = MP/(dRT), здесь d – плотность жидкости; M – молекулярная масса. Из этого выражения следует, что ошибка, связанная с пренебрежением объемом жидкой фазы, будет наибольшей для легколетучих веществ с большим молекулярным весом. В подавляющем большинстве случаев Vж< 0,05Vпар. Например, для аргона Vж = 0,04Vпар. Следовательно, Vж можно пренебречь. С  (1) (1) 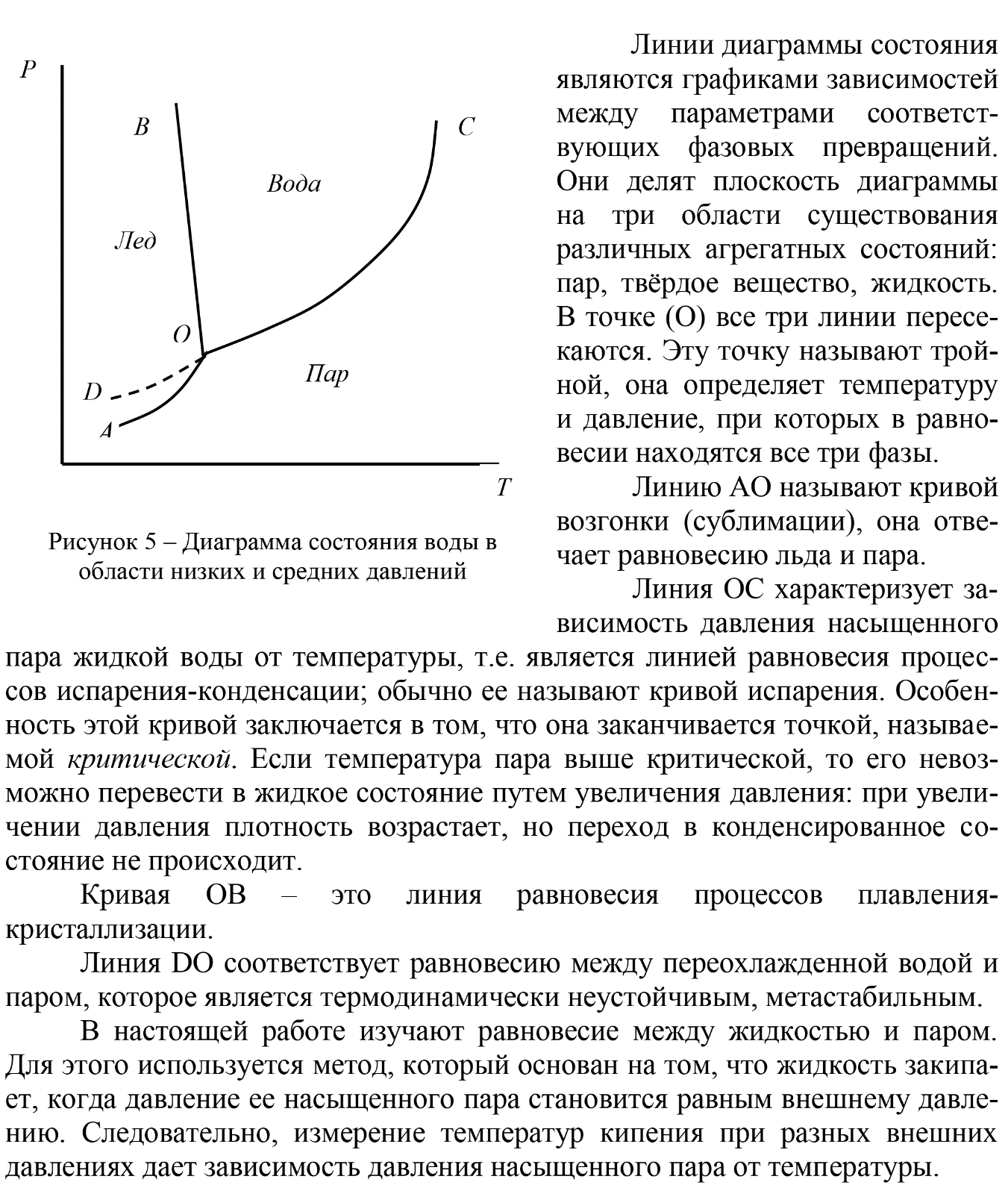 1- - Оборудование и реактивы:термостат, реакционная колба, вакуумный насос, холодильник, термометр, ацетон. Ход работы: Колбу 2 наполняем ацетоном (примерно на 1/2 ее объема), помещаем на дно колбы три «кипелки». Далее колбу помещаем в колбонагреватель 1 и подаём холодную воду в рубашку обратного холодильника 4. При атмосферном давлении откачиваем воздух до начала кипения. Записываем показания манометра и термометра. Приоткрываем кран 6. Увеличиваем температуру на 5 градусов, закрываем кран 6. Схема установки представлена на рисунке 1. Снова откачиваем воздух до начала кипения и заносим в журнал показания манометра и термометра. Опять увеличиваем подсос воздуха и температуру. Измеряем давление при шести температурах.  Рисунок 2 - Схема установки для изучения зависимости давления пара от температуры: 1 – термостат (в работе колбонагреватель); 2 – колба с исследуемой жидкостью; 3 – термометр; 4 – обратный холодильник; 5 – вакуумметр; 6 – кран. Измерения повторяем 3 раза. Для ускорения работы первые измерения проводим при постепенном нагревании, вторые – при постепенном охлаждении и третьи – вновь при постепенном нагревании. Данные заносим в таблицу 1. Таблица 1 - Результаты измерения давления насыщенного пара
На основании полученных данных: Строим графикиP = f (T) иlnP = f (1/T)и графическим методом вычисляем коэффициенты уравнения (1) (рисунки 2 и 3). 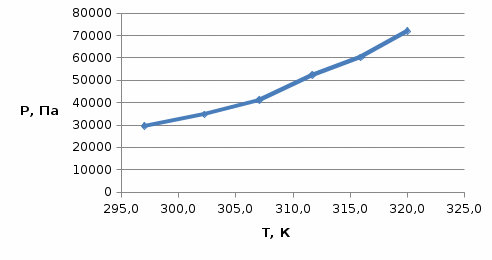 Рисунок 1 - График зависимости давления насыщенного пара от температуры закипания ацетона 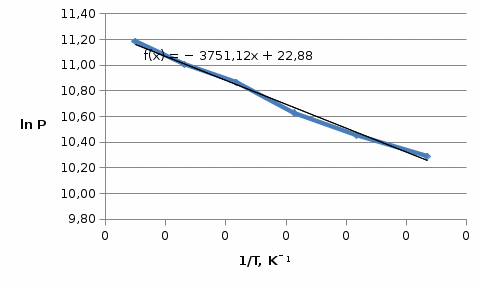 Рисунок 2 - График зависимости натурального логарифма давления насыщенного пара от 1/Т Из рисунка 3видно, что коэффициенты А и В уравнения соответственно равны 22,88 и -3751. Отсюда рассчитываем изменение энтропии и теплоту испарения ацетона на 1 моль: ΔSисп.= А·R = 22,88 · 8,3 = 189,904 Дж/моль·К = 0,19 кДж/моль·К, ΔНисп.= -(В·R) = -(-3751· 8,3) = 31133,3Дж/моль·К = 31,13 кДж/моль·К. Используя справочные данные, находим относительную ошибку в определении ΔНисп. и ΔSисп.. Табличные значения: ΔSисп.= 0,2 кДж/моль·К, ΔНисп.= 40,59кДж/моль·К. Ошибка: δ(ΔSисп.) = (0,2 – 0,19)/0,2 · 100% = 5,05 % δ(ΔНисп.) = (40,59 – 31,13)/40,59 · 100% = 23,30 % Вывод: В ходе лабораторной работы экспериментально измерили давления насыщенного пара ацетона. На основе экспериментальных данных вывели линейные зависимости P = f(T) и lnP = f(1/T). На основании коэффициентов линейной регрессии зависимости lnP = f(1/T) рассчитали теплоту испарения и изменение энтропии на 1 моль. Ошибка определения составила, соответственно, 23,3% и 5,05% и может быть вызвана загрязнением ацетона и неточностью в контроле температуры. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
