Лаб № 9 Определение pH растворов. Отчет по лабораторной работе Определение pH растворов
 Скачать 23.83 Kb. Скачать 23.83 Kb.
|
|
Министерство образования и науки Российской Федерации Владимирский государственный университет Кафедра химии Отчет по лабораторной работе «Определение pH растворов» Работу выполнил: Студент группы С-211 Антропов А.С. Работу принял: Федоров Н.В. Владимир 2011г. Краткая теория к работе: Как известно, вода является слабым электролитом, диссоциирующим по уравнению: H2O 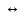 H++OH- H++OH-Для воды, а также для водных растворов любых электролитов произведение активных равновесных концентраций водородных и гидроксильных ионов - величина постоянная при данной температуре. Она называется ионным произведением воды и при 22°С составляет Kw=1,0  10-14. Следовательно, для чистой воды можно записать: 10-14. Следовательно, для чистой воды можно записать:[H+]=[OH-]=1,0  10-7 моль/л. 10-7 моль/л.Прибавление к воде кислоты или щелочи смещает ионное равновесие воды. Концентрации ионов Н+ или OH- изменяются. Однако произведение концентраций [Н+][ОH-] остается постоянным и равным ионному произведению воды. Это дает возможность, зная концентрацию одного иона, вычислить концентрацию другого: 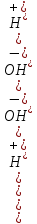 Более удобно характеризовать кислотность и щелочность среды величинами, являющимися десятичными логарифмами концентраций ионов Н+ и ОН-, взятыми с обратными знаками. Эти величины называются водородным (рН) и гидроксильным (рОН) показателями. pH=-lg[H+]; pOH=-lg[OH-] В нейтральной среде: [Н+] = 1  10-7 моль/л; рН = 7. 10-7 моль/л; рН = 7.В кислой среде: [Н+] > 1  10-7 моль/л; рН < 7. 10-7 моль/л; рН < 7.В щелочной среде: [Н+] < 1  10-7 моль/л; рН>7. 10-7 моль/л; рН>7.Для определения кислотности или щёлочности среды используют индикаторы - вещества, которые меняют свою окраску в зависимости от рН среды. Это изменение происходит в определенном интервале рН, например, у метилового оранжевого (или кратко - метилоранжа) окраска от желтой до красной изменяется в интервале рН 4,4 - 3,1. При помощи индикаторов возможно определение рН раствора. Например, если в испытуемом растворе индикатор метилоранж желтеет, а лакмус краснеет, то рН раствора лежит между 4,4 - 5,0. Для характеристики поведения слабых электролитов в растворах используют понятие константы диссоциации слабого электролита, которая, по своему смыслу, является константой равновесия процесса распада молекул этого электролита на ионы. Для слабых кислот она носит название константы кислотности (Кa а для слабых оснований - константы основности (Кb). Например, для процесса диссоциации уксусной кислоты СН3СООН 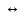 CH3COO‑ + H+ выражение константы кислотности примет вид: CH3COO‑ + H+ выражение константы кислотности примет вид: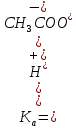 Поскольку все слабые электролиты диссоциируют частично и обратимо, существует ещё одна характеристика глубины протекания этого процесса, она носит название степени диссоциации ( 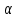 ) и показывает отношение числа молекул, подвергшихся распаду на ионы Ni, к общему количеству молекул Nобщ, введённых в раствор: ) и показывает отношение числа молекул, подвергшихся распаду на ионы Ni, к общему количеству молекул Nобщ, введённых в раствор: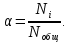 Степень диссоциации и константа диссоциации слабого электролита связаны между собой уравнением разведения Оствальда: 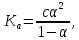 где с - молярная концентрация слабого электролита. При малых значениях концентрации вещества и очень низкой степени диссоциации (т. е. с  0 и α 0 и α 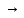 0) уравнение разведения Оствальда можно упростить до вида 0) уравнение разведения Оствальда можно упростить до вида 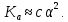 Экспериментальная часть: Приборы и реактивы: иономер (рН-метр); компаратор; колбы мерные на 50 мл - 2 шт.; стаканчики химические по 50 мл - 2 шт.; пипетки мерные на 5 мл; пробирки. Растворы: уксусная кислота 1 М; гидроксид натрия 0,05 М. Лакмус; метилоранж; фенолфталеин; универсальный индикатор. Выполнение работы: Опыт 1: Окраска индикаторов в различных средах
Опыт 2: Определение pH раствора уксусной кислоты Вычисляю активную концентрацию ионов OH- в растворе по формуле: 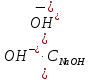 [OH-] = 0,9  0.005 = 0.0045 моль/л. 0.005 = 0.0045 моль/л.
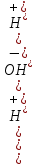 pH = -lg[H+]; pH = -lg|2.2  10-12| = 11,65 10-12| = 11,65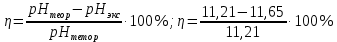 = 0,04 = 0,04Опыт 3: Определение pH раствора 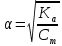 ; ;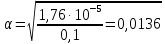 ; ;[H+] = α  Cm Cm  b b[H+] = 0.0136  0.1 0.1  1 = 0.00136 моль/л. 1 = 0.00136 моль/л.pH = -lg|0.00136| = 2.82 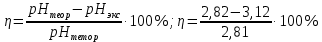 = 0,106 = 0,106Экспериментальное значение pH: pHэкс = 3.12. Экспериментально значение pH оказалось больше, чем теоретическое. Это может быть обусловлено факторами погрешности визуальной неточностью и погрешностью приборов, использовавшихся в ходе выполнения работы. | ||||||||||||||||||||
