Лабораторная работа: Определение КД слабого электролита. Определение Кд слабого электролита. Отчет по лабораторной работе определение константы диссоциации слабого электролита студент группы 0492 Помогаева А. Е
 Скачать 0.65 Mb. Скачать 0.65 Mb.
|
 Отделение химической инженерии Отчет по лабораторной работе ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОГО ЭЛЕКТРОЛИТА Выполнил: студент группы 0492 Помогаева А.Е. Проверил: доцент ОХИ ИШПР Липских О.И. Томск, 2021г Цель работы: 1. Определить постоянную кондуктометрической ячейки. 2. Исследовать электрические свойства раствора слабого электролита и определить его константу диссоциации. 3. Определить произведение растворимости малорастворимой соли методом кондуктометрии. Теоретическая часть Согласно теории Аррениуса, электролиты при растворении диссоциируют на ионы. Степень диссоциации α - это отношение числа молекул электролита, распавшихся в растворе на ионы, к первоначальному числу молекул. Примеры сильных электролитов: неорганические кислоты и основания (NaOH, HCl), большинство неорганических и органических солей, соли карбоновых кислот (СН3СООNa) и другие. Примеры слабых электролитов: все органические кислоты и основания, в частности карбоновые кислоты (НСООН, СН3СООН), некоторые неорганические соединения (NH4OH) и другие. Для диссоциации уксусной кислоты константа диссоциации запишется: 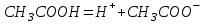  Закон разбавления Оствальда для одно-одновалентного электролита:  Электрическая проводимость – это способность растворов электролитов проводить электрический ток. Электрическую проводимость можно рассчитать:  Удельная электрическая проводимость – это электрическая проводимость объема раствора электролита, заключенного между двумя параллельными электродами, имеющими площадь по 1м2 и расположенными на расстоянии 1м друг от друга. Удельную электрическую проводимость можно рассчитать:   1 – сильные электролиты 2 – слабые электролиты  Зависимость удельной электрической проводимости сильных и слабых электролитов от концентрации раствора. Молярная электрическая проводимость – это электрическая проводимость объема раствора электролита, содержащего 1 моль или 1 моль-экв растворенного вещества и находящегося между двумя параллельными электродами, расположенными на расстоянии 1 м друг от друга. Молярная и удельная электрические проводимости связаны между собой: 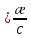 Где с – молярная концентрация раствора, моль.м-3 ӕ – удельная электрическая проницаемость, См.м-1 – молярная электрическая проводимость раствора, См.м2.моль-1. Закон независимого движения ионов Кольрауша: молярная электрическая проводимость при предельном разведении равна сумме подвижностей ионов при предельном разведении.  Где  – подвижности ионов при предельном разведении. – подвижности ионов при предельном разведении.Экспериментальная часть 1. Определение постоянной прибора Для определение постоянной прибора используют раствор KCI L (0,01 М KCI) = 3,782 мCм = 3,782.10–3 См 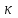 (0,01 М KCl) = 0,001278 См/см (при 298 К) (0,01 М KCl) = 0,001278 См/см (при 298 К) 2. Определение константы диссоциации слабого электролита Экспериментальные данные и результаты их обработки
Для исследуемого слабого электролита CH3COOH:  349,8 См·см2/моль 349,8 См·см2/моль 40,9 См·см2/моль 40,9 См·см2/моль = 249,8 + 40,9 = 290,7 См·см2/моль = 249,8 + 40,9 = 290,7 См·см2/мольОпределение константы диссоциации слабого электролита графическим способом.
     Рис.1. Зависимость удельной электрической проводимости от концентрации электролита  Рис.2. Зависимость молярной электрической проводимости от концентрации электролита.  Рис.3. Зависимость степени диссоциации от концентрации электролита. 
Вывод: Рассчитали константу диссоциации слабого электролита (CH3COOH) аналитическим и графическим способами. В нашем случаем более точный будет является графический способ, так как он ближе всего к табличному значению. 3. Определение растворимости и произведения растворимости малорастворимого соединения Исследуемое малорастворимое соединение CaSO4 Экспериментальные данные
Для исследуемого малорастворимого соединения реакция диссоциации: CaSO4  Ca2+ + SO42– Ca2+ + SO42– 59,5 См·см2/моль 59,5 См·см2/моль 138,6 См·см2/моль 138,6 См·см2/мольРасчет растворимости малорастворимого соединения  Расчет произведения растворимости малорастворимого соединения  Табличное значение произведения растворимости составляет    Вывод: Исследовали электрические свойства раствора слабого электролита Применили метод кондуктометрии для определения константы диссоциации слабого электролита. Определили постоянную кондуктометрической ячейки 0,3379 см–1. Рассчитали константу диссоциации слабого электролита (CH3COOH) аналитическим (4,60.10-5) и графическим способами (1,75.10-5). Определение растворимость 0,00387 моль/л и произведение растворимости малорастворимого соединения 1,498.10-5 моль/л. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


