химия 5. Лабораторная работа 8 Реакции в растворах электролитов Цель работы изучить понятия электролиты
 Скачать 22.81 Kb. Скачать 22.81 Kb.
|
|
Лабораторная работа 8 Реакции в растворах электролитов Цель работы: изучить понятия «электролиты», «электролитическая диссоциация», рассмотреть кислоты, основания, амфотерные электролиты, соли с точки зрения теории электролитической диссоциации, отличать сильные и слабые электролиты, научиться составлять ионно-молекулярные уравнения. Задание: провести реакции обмена в растворах электролитов, выполнить требования к результатам опытов и оформить отчет, решить задачу. Теоретическое введение Электролитами называют вещества (кислоты, основания, соли), которые в растворах диссоциируют на ионы и проводят электрический ток. Электролитическая диссоциация – распад молекул растворенного вещества на ионы под действием полярных молекул растворителя. Кислоты – электролиты, диссоциирующие в растворах с образованием ионов водорода: HNО2 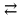 H+ + NО2 ‾ H+ + NО2 ‾ Основания – электролиты, диссоциирующие в растворах с образованием гидроксид-ионов: NH4OH 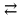 NH4+ + OH‾ . NH4+ + OH‾ .Существуют электролиты, которые могут диссоциировать как кислоты и как основания. Такие электролиты называются амфотерными. К ним относятся Be(OH)2, Zn(OH)2, Pb(OH)2, Sn(OH)2, Al(OH)3, Ga(OH)3, Cr(OH)3. Диссоциацию растворимой части амфотерного электролита можно представить следующей схемой: 2H+ + BeO22− 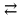 Be(OH)2 Be(OH)2 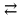 Be2+ + 2OH‾ . Be2+ + 2OH‾ .Соли – электролиты, которые при растворении в воде диссоциируют, отщепляя положительные ионы, отличные от ионов водорода, и отрицательные ионы, отличные от гидроксид-ионов: Al2(SO4)3 → 2Al3+ + 3SO4 2‾ средняя соль NaHCO3 → Na+ + HCO3 ‾ кислая соль CuOHCl 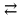 CuOH+ + Cl‾ основная соль CuOH+ + Cl‾ основная сольВсе электролиты делят на сильные и слабые. Сильные электролиты – это вещества, которые в водных растворах практически полностью диссоциируют на ионы. Сильными электролитами являются: все хорошо растворимые соли, кислоты (H2SO4, HNO3, HCl, HBr, HI, HClO4), щелочи (LiOH, NaOH, KOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2,Ba(OH)2). Слабые электролиты – это вещества, которые в водных растворах не полностью диссоциируют на ионы. К слабым электролитам относятся: H2O, NH4OH; некоторые соли; кислоты CH3COOH, HF, HNO2, HCN, HClO, H2SO3, H2CO3, H2S, H3PO4; все нерастворимые в воде основания, например Mg(OH)2, Fe(OH)3, Cu(OH)2. Реакции в растворах электролитов протекают между ионами. Обычно такие реакции изображаются при помощи ионно-молекулярных уравнений, порядок составления которых следующий: а) записывают молекулярное уравнение реакции и в обеих частях уравнения подчеркивают вещества, которые не будут полностью диссоциировать на ионы (нерастворимые вещества, слабые электролиты, газы): AgNO3 + KCl = AgCl↓ + KNO3; б) составляют полное ионное уравнение реакции. Осадки, газы и слабые электролиты полностью на ионы не диссоциируют, поэтому в ионных уравнениях записываются в молекулярном виде: Ag+ + NO3 ‾ + K+ + Cl‾ = AgCl↓ + K+ + NO3 ‾ ; в) составляют краткое ионное уравнение, сокращая одинаковые ионы с обеих сторон: Ag+ + Clˉ = AgCl↓. Реакции обмена в растворах сильных электролитов протекают до конца или практически необратимо, когда ионы, соединяясь друг с другом, образуют вещества: • нерастворимые (↓): 3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl 3Ca2+ + 6Cl‾ + 6Na+ + 2PO4 3‾ = Ca3(PO4)2↓ + 6Na+ + 6Cl‾ 3Ca2+ + 2PO4 3- = Ca3(PO4)2↓; • газообразные (↑): 2HCl + Na2S = H2S↑ + 2NaCl 2H+ + 2Cl‾ + 2Na+ + S2- = H2S↑ + 2Na+ +2Cl‾ 2H+ + S2‾ = H2S↑; • малодиссоциирующие (слабые электролиты): H2SO4 + 2KNO2 = 2HNO2 + K2SO4 2H+ + SO4 2− + 2К + + 2NO2 ‾ = 2HNO2 + 2K+ + SO4 2− H+ + NO2 ‾ = HNO2. В тех случаях, когда нет ионов, которые могут связываться между собой с образованием осадка, газа, слабого электролита, реакции обмена не протекают. Нередко встречаются процессы, в уравнениях которых с одной стороны равенства имеется малорастворимое соединение, а с другой – слабый электролит. Такие реакции протекают обратимо, причем равновесие смещается в сторону наименее диссоциировааных веществ. Так, равновесие в системе Mg(OH)2↓ + 2HCl 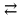 MgCl2 + 2H2O MgCl2 + 2H2OMg(OH)2↓ + 2H+ + 2Cl‾ 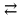 Mg2+ + 2Cl‾ + 2H2O Mg2+ + 2Cl‾ + 2H2OMg(OH)2↓ + 2H+ 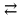 Mg2+ + 2H2O Mg2+ + 2H2Oсмещено вправо, в сторону малодиссоциированных молекул воды. Выполнение работы Опыт 1. Сравнение химической активности кислот В одну пробирку налили 1-2 мл раствора уксусной кислоты (CH3COOH), в другую – столько же раствора соляной кислоты (HCl). Взяли два приблизительно равных по величине кусочка мрамора и бросили по одному в каждую пробирку. Наблюдали выделение газа и отметили, в какой пробирке процесс идет более энергично. 2CH3COOH+CaCO3=(CH3COO)2Ca+CO2↑+H2O 2CH3COO‾+2H+ +Ca2+ +CO3= 2CH3COO‾ +Ca2++H2O+CO2↑ CaCO3 + 2H+ = Ca2+ +CO2↑ + H2O CaCO3+2HCl=CaCl2+H2O+CO2↑ Ca2++CO32‾+2H++2Cl‾=Ca2++2Cl‾+H2O+CO2↑ Ca2++CO32‾+2H+=Ca2‾+H2O+CO2↑ Скорость реакции зависит от ионов H+. Данных ионов больше всего в растворе соляной кислоты. Учитывая, что для опыта взяты растворы одинаковой концентрации, соляная кислота является более сильной чем уксусная. Опыт 2. Реакции, идущие с образованием осадка Налили в три пробирки по 1-2 мл сульфата магния, хлорида железа(III), сульфата меди (II) и прибавили в каждую по такому же количеству щелочи. Наблюдали образование осадков, Mgso4 белый, FeCl3 желтый, CuSO4 коричневый. MgSO4+NaOH=Mg(OH)2+Na2SO4 Mg2++SO42+Na++OH=Mg(OH)2+ Na++SO42 Mg2++OH-=Mg(OH)2 осадок белого цвета FeCl3+NaOH=Fe(OH)3+NaCl Fe3++Cl3+Na++OH =Fe(OH)3+Na++Cl Fe3++OH =Fe(OH)3 Осадок светло коричневого цвета CuSO4+NaOH=Cu(OH)2+Na2SO4 Cu2++SO42+Na++OH‾ =Cu(OH)2+Na++SO42 Cu2++OH‾ =Cu(OH)2 Осадок голубого цвета Опыт 3: Реакции, идущие с образованием слабого электролита К полученным в предыдущем опыте осадка гидроксидов магния, железа, и меди прилили раствор соляной кислоты до полного их растворения. Mg(OH)2↓ + 2HCl 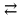 MgCl2 + 2H2O MgCl2 + 2H2OMg(OH)2↓ + 2H+ + 2Cl‾ 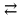 Mg2++ 2Cl‾ + 2H2O Mg2++ 2Cl‾ + 2H2OMg(OH)2↓ + 2H+ 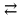 Mg2++ 2H2O Mg2++ 2H2OFe(OH)3+3HCl 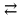 FeCl3+H2O FeCl3+H2OFe(OH)3+3H++3Cl 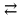 Fe3++3Cl+H2O Fe3++3Cl+H2OFe(OH)3+3H+ 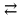 Fe3++H2O Fe3++H2OCu(OH)2+2HCl 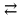 CuCl2+2H2O CuCl2+2H2OCu(OH)2+2H++2Cl- 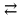 Cu2++2Cl+2H2O Cu2++2Cl+2H2OCu(OH)2+2H+  Cu2++2H2O Cu2++2H2OНаблюдается растворение осадков, объяснимое тем, что равновесие химической реакции смещено в сторону мало-диссоциированных молекул воды. |
