Отчет по лабораторной работе Определение среднего коэффициента активности электролита методом эдс
 Скачать 130.5 Kb. Скачать 130.5 Kb.
|
|
МИНИСТЕРСТВО НАУКИ И ВЫСШЕГО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ федеральное государственное автономное образовательное учреждение высшего образования «НАЦИОНАЛЬНЫЙ ИССЛЕДОВАТЕЛЬСКИЙ ТОМСКИЙ ПОЛИТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ» ОХИ ИШПР Отчет по лабораторной работе Определение среднего коэффициента активности электролита методом ЭДС Выполнила: студентка группы 4Д91 Вдовина А.М. Проверила: доцент ОХИ ИШПР Мамаева Е.А. Томск, 2021 г Цель работы: определить методом потенциометрии (методом ЭДС) средний коэффициент активности сильного электролита при различной концентрации раствора. Теоретическая часть Активность – это величина, которую нужно подставить в выражение для химического потенциала компонента в идеальном растворе, чтобы получить действительное значение химического потенциала данного компонента в неидеальном растворе. Активность, коэффициент активности, концентрация и среднее число ионов электролита связаны между собой уравнениями: 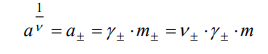 Для определения среднего коэффициента активности раствора электролита HCl методом ЭДС необходимо составить гальванический элемент с одним электролитом, состоящий из хлорсеребряного и стеклянных электродов. Схема составленного гальванического элемента запишется в виде: (-) Ag, AgCl| исследуемый раствор HCl (aq)|стеклянный электрод(+) Уравнение Нернста для электрода, обратимого относительно катиона исследуемого электролита запишется в виде: Уравнение Нернста для электрода, обратимого относительно аниона исследуемого электролита запишется в виде: Выражение для ЭДС составленного гальванического элемента запишется в виде: Логарифм среднего значения коэффициента активности электролита HCl связан с ЭДС составленного гальванического элемента уравнением: Экспериментальная часть Приборы и реактивы: Раствор соляной кислоты с концентрацией 0,1М, рН-метр со стеклянным электродом, серебряный электрод, стеклянный стаканчик(50мл), дистиллированная вода, раствор AgNO3 с концентрацией примерно 0,01М, две пипетки на 10мл Исследуемый электролит HCl, toC=20,6oC Таблица 1 Экспериментальные данные и результата их обработки
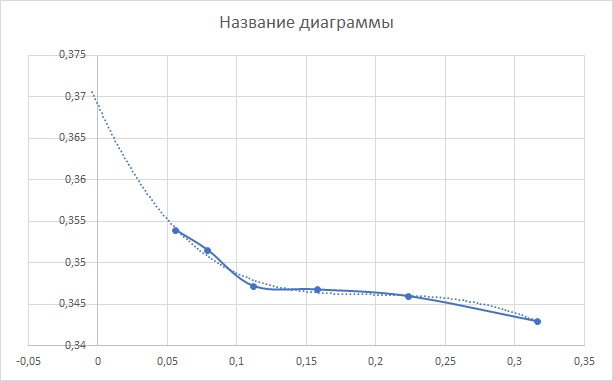 Рис. 1. Зависимость исследуемого электролита E0 = 0,369 В 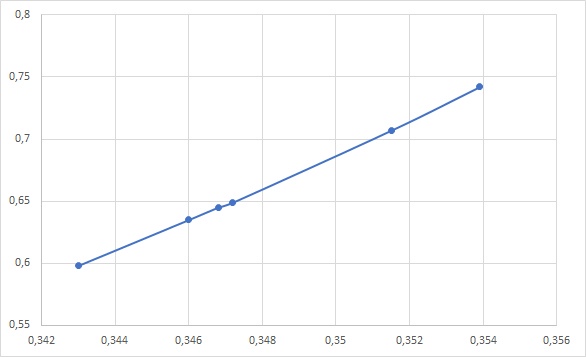 Рис. 2. Зависимость Вывод: Потенциометрическим методом определен средний коэффициент активности электролита HCl и сравнен с табличным значением f+-HCl=0.904. Подтверждено, что данный метод точен при концентрациях ниже 0, 01М( приближение значений к табличным. Отклонение измерений от истинных можно объяснить человеческим фактором, температурными условиями, недолжным соприкосновением электродов со стенками сосуда, не мгновенным образованием покрытия серебряного электрода хлоридом серебра. |
