электрохимия. Решение 216
 Скачать 61.03 Kb. Скачать 61.03 Kb.
|
|
8.1. Даны два электрода. 1. Запишите уравнение Нернста для расчета электродного потенциала и вычислите его значение для каждого электрода в растворе при заданных условиях и Т=298 К. 2. Запишите электрическую систему (гальванический элемент), уравнения электродных реакций (на катоде и аноде), суммарной (токообразующей) реакции, определяющих работу этого элемента. 3. Рассчитайте равновесное напряжение (ЭДС) составленного гальванического элемента, изменение свободной энергии Гиббса ΔG0.
Решение 216: 1. Запишите уравнение Нернста для расчета электродного потенциала и вычислите его значение для каждого электрода в растворе при заданных условиях и Т=298 К. Уравнение Нернста для расчета электродного потенциала: 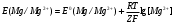 При 298 К потенциал равен:  Рассчитаем потенциал каждого электрода, если стандартный потенциал магния  равен -2,372 В: равен -2,372 В: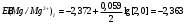 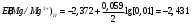 2. Запишите электрическую систему (гальванический элемент), уравнения электродных реакций (на катоде и аноде), суммарной (токообразующей) реакции, определяющих работу этого элемента. При образовании гальванического элемента катодом выступает электрод, имеющий наивысшее значение потенциала, то есть электрод I, анодом, соответственно, выступает электрод II. Запишем схему гальванического элемента: 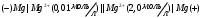 Уравнения электродных процессов: Анодный процесс:  Катодный процесс: 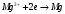 Токообразующая реакция:  3. Рассчитайте равновесное напряжение (ЭДС) составленного гальванического элемента, изменение свободной энергии Гиббса ΔG0. ЭДС равна разнице потенциалов катода и анода: 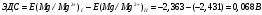 Изменение энергии Гиббса реакции рассчитывается по уравнению: 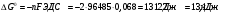 Решение 217: 1. Запишите уравнение Нернста для расчета электродного потенциала и вычислите его значение для каждого электрода в растворе при заданных условиях и Т=298 К. Уравнение Нернста для расчета электродного потенциала: 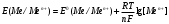 При 298 К потенциал равен:  Рассчитаем потенциал каждого электрода, если стандартный потенциал меди 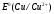 равен 0,337 В, а стандартный потенциал золота равен 0,337 В, а стандартный потенциал золота 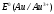 равен 1,498 В: равен 1,498 В: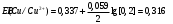 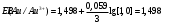 2. Запишите электрическую систему (гальванический элемент), уравнения электродных реакций (на катоде и аноде), суммарной (токообразующей) реакции, определяющих работу этого элемента. При образовании гальванического элемента катодом выступает электрод, имеющий наивысшее значение потенциала, то есть электрод  , анодом, соответственно, выступает электрод , анодом, соответственно, выступает электрод 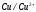 . Запишем схему гальванического элемента: . Запишем схему гальванического элемента: Уравнения электродных процессов: Анодный процесс: 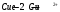 Катодный процесс: 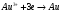 Токообразующая реакция: 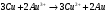 3. Рассчитайте равновесное напряжение (ЭДС) составленного гальванического элемента, изменение свободной энергии Гиббса ΔG0. ЭДС равна разнице потенциалов катода и анода: 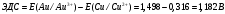 Изменение энергии Гиббса реакции рассчитывается по уравнению: 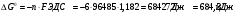 | |||||||||||||||||||
