Открываемый
ион
|
Связующий
ион
|
реактив
|
признаки
|
Уравнения реакций (пример)
|
Н+
|
|
а)синий лакмус
метилоранж
универсальный
|
краснеют
|
|
б)металлы стоящие до (Н2)
|
Выделение Н2, при поднесении зажжёной спички –«хлопок»
|
Кроме HNO3 и H2SO4(конц.)

Zn + 2HCl = ZnCl2 + H2
|
Na+
|
|
пламя
|
Пламя окрашивается в жёлтый цвет.
|
|
К+
|
|
пламя
|
Пламя окрашивается в бледно-фиолетовый цвет
(через синее стекло)
|
|
Ca2+
|
CO32-
|
а) пламя
|
Пламя окрашивается в красный цвет
|
|
б) растворимые карбонаты
Na2CO3
|
Наблюдать выпадение белого осадка,который разрушается сильными кислотами с шипением и выделением СО2, а при пропускании СО2 и наличии Н2О осадок растворяется, превращаясь в кислую соль.
|
C aCl2 + Na2CO3 = 2NaCl + CaCO3 aCl2 + Na2CO3 = 2NaCl + CaCO3

CaCO3 +2HCl = CaCl2 + H2O + CO2
CaCO3 + CO2 + H2O = Ca(HCO3)2
|
Sr2+
|
|
пламя
|
Пламя окрашивается в карминово-красный цвет.
|
|
Ва2+
|
|
а)пламя
|
Пламя окрашивается в зелёный цвет.
|
|
SO42-
|
б)Н2SO4 и её растворимые соли
|
Наблюдать выпадение белого осадка не растворимого в кислотах и щелочах.
|
B aCl2 + H2SO4 = 2HCl + BaSO4 aCl2 + H2SO4 = 2HCl + BaSO4
B a(NO3)2 +CuSO4 = Cu(NO3)2 + BaSO4 a(NO3)2 +CuSO4 = Cu(NO3)2 + BaSO4
|
Ag+
|
Cl-
|
Растворимые соли и HCl
|
Наблюдать выпадение белого творожестого осадка не растворимого в кислотах и щелочах
|
A gNO3 + NaCl = NaNO3 + AgCl gNO3 + NaCl = NaNO3 + AgCl
|
Pb2+
|
S2-
|
Растворимые сульфиды
|
Наблюдать выпадение чёрного осадка.
|
P b(NO3)2 + Na2S = 2NaNO3 + PbS b(NO3)2 + Na2S = 2NaNO3 + PbS
|
Hg2+
|
S2-
|
Растворимые сульфиды
|
Наблюдать выпадение чёрного осадка.
|
H gS gS
|
I-
|
Иодиды раств.
|
Наблюдать красный осадок
|
H gI2 gI2
|
Cu2+
|
|
а) пламя
|
Пламя окрашивается в синий цвет
|
|
ОН-
|
б) любая щёлочь
|
Синий студенистый осадок
|
C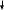 uSO4 + 2NaOH = Na2SO4 + Cu(OH)2 uSO4 + 2NaOH = Na2SO4 + Cu(OH)2
|
S2-
|
в) растворимые сульфиды
|
Чёрный осадок
|
C uSO4 + Na2S = Na2SO4 + CuS uSO4 + Na2S = Na2SO4 + CuS
|
Мg2+
|
OH-
|
Любая щёлочь
|
Наблюдать белый студенистый осадок не растворимый в щелочах
|
М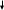 g(NO3)2 + 2NaOH = 2 NaNO3 + Mg(OH)2 g(NO3)2 + 2NaOH = 2 NaNO3 + Mg(OH)2
|
Al3+
|
OH-
|
Любая щёлочь
|
Наблюдать белый студенистый осадок растворимый в щелочах
|
A l(NO3)3 + 3NaOH = 3 NaNO3 + Al(OH)3 l(NO3)3 + 3NaOH = 3 NaNO3 + Al(OH)3
Al(OH)3 + NaOH = Na[Al(OH)4]
|
Fe2+
|
OH-
|
а) любая щёлочь
|
Белый осадок – Зелёный осадок, который на воздухе становится красно-коричневым
|
F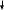 eSO4 + 2NaOH = Na2SO4 + Fe(OH)2 eSO4 + 2NaOH = Na2SO4 + Fe(OH)2
4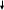 Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3 Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
|
Красная кровяная соль
|
б) K3[Fe(CN)6]
|
Наблюдать «Турбулеву синь»
|
FeSO4 + K3[Fe(CN)6] = K2SO4 + K+Fe+2[Fe+3(CN)6-]-3
|
Fe3+
|
OH-
|
а)любая щёлочь
|
Красно-коричневый осадок
|
F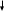 e2(SO4)3 + 6NaOH = 3Na2SO4 + 2Fe(OH)3 e2(SO4)3 + 6NaOH = 3Na2SO4 + 2Fe(OH)3
|
Жёлтая кровяная соль
|
б) K4[Fe(CN)6]
|
Наблюдать «Берлинскую лазурь»
|
FeCl3 + K4[Fe(CN)6] = 3KCl + K+Fe+3[Fe+2(CN)6-]-4
|
SCN-
роданиты
|
в) KSCN
NH4SCN
|
Наблюдать «Кровь»
|
FeCl3 + 3KSCN = 3KCl + Fe(SCN)3
|
NH4+
|
OH-
|
а)любая щёлочь
при t0
|
Выделение газа аммиака NH3
|
N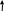 H4NO3 + NaOH = NaNO3 + H2O + NH3 H4NO3 + NaOH = NaNO3 + H2O + NH3
|
Mn2+
|
OH-
|
а)любая щёлочь
при t0
|
Наблюдать жёлтый осадок
|
M nSO4 + 2NaOH = Mn(OH)2 + Na2SO4 nSO4 + 2NaOH = Mn(OH)2 + Na2SO4
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Открываемый
ион
|
Связующий
ион
|
реактив
|
признаки
|
Уравнения реакций (пример)
|
Сl-
Br-
I-
PO43-
|
Ag+
|
AgNO3
|
Белый творожестый осадок
|
N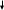 aCl + AgNO3 = NaNO3 + AgCl aCl + AgNO3 = NaNO3 + AgCl
|
Бледно-жёлтый осадок
|
N aBr + AgNO3 = NaNO3 + AgBr aBr + AgNO3 = NaNO3 + AgBr
|
Желтоватый осадок
|
N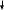 aI + AgNO3 = NaNO3 + AgI aI + AgNO3 = NaNO3 + AgI
|
Жёлтый осадок
|
N a3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4 a3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4
|
SO42-
|
Ba2+
|
BaCl2
Ba(NO3)2
|
Н аблюдать образование белого осадка аблюдать образование белого осадка
|
N  a2SO4 + BaCl2 = 2NaCl + BaSO4 a2SO4 + BaCl2 = 2NaCl + BaSO4
|
NO3-
|
|
Cu+H2SO4(конц.)
при t0
|
Наблюдать выделение NO2 бурого газа с характерным запахом «лисий хвост»
|
4NaNO3 + Cu + 2H2SO4(конц.) = 2Na2SO4+Cu(NO3)2+2H2O+2NO2
|
CO32-
|
H+
|
Сильные кислоты
|
В  ыделение с шипением СО2 ыделение с шипением СО2
|
C aCO3 + 2HCl = CaCl2 + H2O + CO2 aCO3 + 2HCl = CaCl2 + H2O + CO2
|
SiO32-
|
H+
|
Сильные кислоты
|
В ыделение SiO2 ыделение SiO2
(кварц, песок)
|
N a2SiO3 + 2HCl = 2NaCl + H2O + SiO2 a2SiO3 + 2HCl = 2NaCl + H2O + SiO2
|
SO32-
|
H+
|
Сильные кислоты
|
В ыделение SО2 ыделение SО2
|
N  a2SO3 + 2HCl = 2NaCl + H2O + SO2 a2SO3 + 2HCl = 2NaCl + H2O + SO2
|
S2-
|
H+
|
Сильные кислоты
|
В ыделение H2S ыделение H2S
Газа, с запахом гниющего мяса
|
Na2S + 2HCl = 2NaCl + H2S
|
См. Hg2+
и Pb2+
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
 Скачать 34.39 Kb.
Скачать 34.39 Kb.

 aCl2 + Na2CO3 = 2NaCl + CaCO3
aCl2 + Na2CO3 = 2NaCl + CaCO3 
 aCl2 + H2SO4 = 2HCl + BaSO4
aCl2 + H2SO4 = 2HCl + BaSO4  a(NO3)2 +CuSO4 = Cu(NO3)2 + BaSO4
a(NO3)2 +CuSO4 = Cu(NO3)2 + BaSO4  gNO3 + NaCl = NaNO3 + AgCl
gNO3 + NaCl = NaNO3 + AgCl  gS
gS  uSO4 + 2NaOH = Na2SO4 + Cu(OH)2
uSO4 + 2NaOH = Na2SO4 + Cu(OH)2  g(NO3)2 + 2NaOH = 2 NaNO3 + Mg(OH)2
g(NO3)2 + 2NaOH = 2 NaNO3 + Mg(OH)2  l(NO3)3 + 3NaOH = 3 NaNO3 + Al(OH)3
l(NO3)3 + 3NaOH = 3 NaNO3 + Al(OH)3  Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3
Fe(OH)2 + 2H2O + O2 = 4Fe(OH)3  e2(SO4)3 + 6NaOH = 3Na2SO4 + 2Fe(OH)3
e2(SO4)3 + 6NaOH = 3Na2SO4 + 2Fe(OH)3  H4NO3 + NaOH = NaNO3 + H2O + NH3
H4NO3 + NaOH = NaNO3 + H2O + NH3  aBr + AgNO3 = NaNO3 + AgBr
aBr + AgNO3 = NaNO3 + AgBr  a3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4
a3PO4 + 3AgNO3 = 3NaNO3 + Ag3PO4 аблюдать образование белого осадка
аблюдать образование белого осадка a2SO4 + BaCl2 = 2NaCl + BaSO4
a2SO4 + BaCl2 = 2NaCl + BaSO4 
 ыделение с шипением СО2
ыделение с шипением СО2  aCO3 + 2HCl = CaCl2 + H2O + CO2
aCO3 + 2HCl = CaCl2 + H2O + CO2 ыделение SiO2
ыделение SiO2 Cu2+ + 2OH- = Cu(OH)2
Cu2+ + 2OH- = Cu(OH)2  Ni2+ + 2OH- = Ni(OH)2
Ni2+ + 2OH- = Ni(OH)2  Ag+ + Cl- = AgCl
Ag+ + Cl- = AgCl  Ag+ + I- = AgI
Ag+ + I- = AgI 
 3Ca2+ + 2PO43- = Ca3(PO4)2
3Ca2+ + 2PO43- = Ca3(PO4)2 
 H+ + S2- = H2S
H+ + S2- = H2S  2H+ + CO32- = H2O + CO2
2H+ + CO32- = H2O + CO2