патология почек. Патология почек
 Скачать 0.98 Mb. Скачать 0.98 Mb.
|
Патология почекПочки выполняют многообразные функции, главными из которых являются: выделение (экскреция) из организма конечных продуктов обмена и чужеродных веществ, а также поддержание водно-электролитного баланса и кислотно-основного состояния крови, участвуют в регуляции системного артериального давления и кроветворения. Структурно-функциональной единицей почек является нефрон. Регенерация нефронов в течение жизни человека не происходит, наоборот их число у лиц старше 40 лет каждые 10 лет сокращается на 10%. Вместе с тем функции почек с возрастом не нарушаются, поскольку оставшиеся нефроны обладают большим функциональным резервом. Болезнями почек страдает около 2 % населения. Совокупность заболеваний, характеризующихся повреждением клубочкового аппарата и паренхимы почек, называются нефропатиями. Нефропатии развиваются в любом возрасте, но наиболее часто они встречаются в 20-40 лет и у мужчин, а также у детей от 3 до 7 лет. Болезни почек часто поздно диагностируются, имеют затяжной характер течения и многие их них трудно поддаются лечению. Прогрессирование заболеваний почек приводит к развитию хронической почечной недостаточности и инвалидизации людей в трудоспособном возрасте. 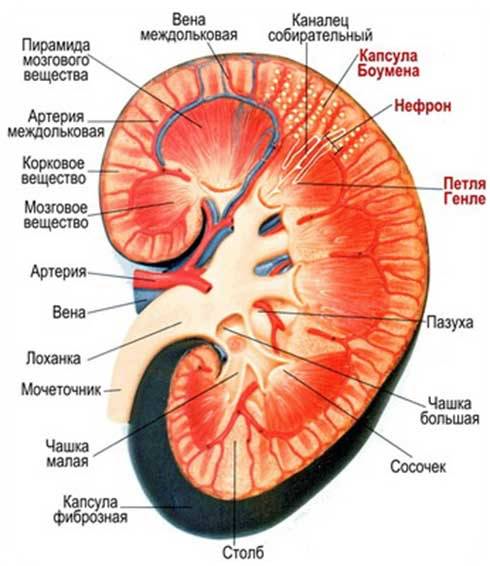 Рисунок 1. Строение почки.  Рисунок 2. Строение почечной пирамиды.  Рисунок 3. А. Строение нефрона. Б. Строение клубочка. 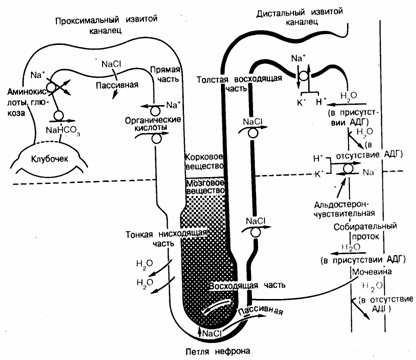 Рисунок 4. Транспортные процессы в нефроне. Нефропатии Этиология
Преренальные расстройства опосредованы нарушениями функций других органов и систем, они возникают после тяжелой кровопотери, а также при заболеваниях сердца и сосудов, нарушениях гемостаза и эндокринопатиях. Присистемной артериальной гипотензии (70 мм рт. ст. и менее) нарушаются механизмы фильтрации клубочковой фильтрации, что приводит к уменьшению образования мочи в почках. При тяжелой артериальной гипотензии наблюдается спазм почечных сосудов, который вызывает ишемию и очаги некроза в корковом слое почек. Распространенной причиной преренальных нарушений почечных функции является уменьшение кровоснабжения органа вследствие выраженного атеросклероза почечных артерий или тромбоза капилляров почек при диссеминированном внутрисосудистом свертывании крови (ДВС-синдром), остром гемолизе эритроцитов, а также в результате жировой эмболии. Экстраренальные нарушения функций почек вызывают некоторые эндокринные заболевания, например, избыточный диурез при несахарном диабете, обусловленный уменьшением секреции нейронами ядер гипоталамуса антидиуретического гормона (АДГ) или уменьшение фильтрации мочи в почках вследствие психоэмоционального стресса, выраженного болевого синдрома. Постренальные формы патологии почек возникают при наличии механического препятствия оттоку мочи (образовании мочевых камней - уролитиаз, сужении просвета мочеточников - стриктура, опухоли мочевого пузыря и предстательной железы). При нарушении эвакуации мочи из мочевого пузыря возникает обратный ток мочи в чашечно-лоханочный комплекс, повышается гидростатическое давление внутри лоханок (гидронефроз), что приводит к снижению фильтрации в почечных клубочках. Воспалительные заболевания, приводящие к облитерации (закрытию) просвета мочеточников, также затрудняют пассаж мочи и уменьшают интенсивность процессов фильтрации в почках.
Повышение эффективного фильтрационного давления в почечных клубочках возникает в результате сосудистых эффектов оксида азота эндотелиального происхождения, а также простагландинов (PGE2 и PGI2) и кининов (брадикинин). Они расширяют артериолы, усиливая капиллярный кровоток и клубочковую фильтрацию в почках. Реакции почечных сосудов, вызванные этими веществами, при патологии могут иметь приспособительное значение, а торможение синтеза простагландинов, например, высокими дозами нестероидных анальгетиков, приводить к уменьшению образования первичной мочи. Повышение фильтрационного давления в капиллярах клубочков на фоне спазма отводящей артерии возникает в начальной стадии гипертонической болезни, а также при выраженном психоэмоциональном стрессе. Уменьшение онкотического давления плазмы при сохранении уровня гидростатического давления в сосудах почек приводит к увеличению эффективного фильтрационного давления. Около 80% общего коллоидно-осмотического давления плазмы создается альбуминами, почти 20% - глобулинами и ничтожно малая часть – фибриногеном. Поэтому при уменьшении содержания альбуминов и глобулинов в плазме (гипо - и диспротеинемии), связанном с недостаточным поступлением протеинов, нарушениями процессов их синтеза в печени и избыточным расходом или потерей белков, происходит увеличение скорости клубочковой фильтрации в почках. Усиленная фильтрация возникает в связи с белковым голоданием (алиментарная дистрофия, жесткая безбелковая диета и др.); нарушением гидролиза белков в желудке (атрофический гипоацидный гастрит), а также вследствие недостаточного всасывания продуктов переваривания протеинов в тонкой кишке (синдром мальабсорбции). Клубочковая фильтрация усиливается при печеночной недостаточности и угнетении синтеза альбуминов и глобулинов в гепатоцитах (цирроз печени, хронический гепатит и другие). Кроме того, коллоидно-осмотическое давление плазмы резко уменьшается вследствие потери белка с обширных раневых поверхностей тканей (ожоги, механические повреждения), а также при нефротическом синдроме. При нефропатиях усиленная клубочковая фильтрация связана преимущественно с нарушением свойств и повышением проницаемости почечных мембран. Благодаря особенностям строения мембран (моногослойность, наличие пор), а также существованию на клетках почечного барьера высокого отрицательного заряда в норме белок и форменные элементы крови не могут проникнуть через мембрану в первичную мочу. Поэтому концентрация других компонентов первичной мочи неорганических и органических веществ, практически не отличается от их содержания в плазме. При уменьшении или исчезновении заряда на мембране в первичной моче появляются альбумин, трансферрин, а также патологический иммуноглобулин (белок Бенс-Джонса). Кроме того, дефекты структуры базальной мембраны, увеличение размера ее пор остаются главной причиной появления в моче крупномолекулярных белков (иммуноглобулинов класса G). При действии химических веществ, обладающих нефротоксическим эффектом, повреждения базальной мембраны клубочков часто носят характер тотальной деструкции и сопровождаются появлением в моче форменных элементов крови (эритроцитов, лейкоцитов, тромбоцитов). При усиленной фильтрации диурез может не изменяться, поскольку объем конечной мочи зависит и от интенсивности реабсорбции воды в почках. Нарушение баланса этих процессов существенно влияет на выделение мочи из организма. Например, уменьшение реабсорбции на 10% при неизменной фильтрации приводит к увеличению диуреза в 13 раз. Потери глюкозы, аминокислот, лактата, белков плазмы, фосфатов и других веществ организмом при повышении диуреза не происходит, до тех пор, пока скорость их фильтрации через почечную мембрану не превысит максимально возможную канальцевую реабсорбцию соединений из первичной мочи в кровь. Нарушение реабсорбции и секреции При прохождении первичной мочи по канальцам и собирательным трубочкам нефрона одни вещества всасываются обратно, другие же поступают из крови в просвет канальцев. Интенсивность выделения большинства веществ из организма с мочой определяется, прежде всего, избирательной реабсорбцией, а не секрецией. Такие вещества как глюкоза и аминокислоты полностью реабсорбируются в проксимальных канальцах. Для ионов натрия, хлора, калия и бикарбоната интенсивность реабсорбции тоже высока, однако их интенсивность выделения с мочой зависит от потребностей организма. Мочевина, креатинин и сульфаты выводятся в большом количестве, поскольку они хуже или практически не реабсорбируются. Вода и анионы всасываются обратно в кровь в проксимальных канальцах пассивно, с помощью осмоса. Для перемещения глюкозы и аминокислот там же, а ионов натрия против градиента в дистальном канальце, требуются затраты энергии, сопряженные с работой К+/Na+-АТФ-азы. Важную роль в переносе глюкозы, аминокислот и натрия во многих частях канальцевой системы нефрона принадлежит специальным белкам-переносчикам, осуществляющих облегченную диффузию. Высокомолекулярные соединения, в частности белок, активно реабсорбируются в проксимальном отделе нефрона посредством пиноцитоза. Нарушения реабсорбции воды и веществ в почках вызываются патологией транспортных систем канальцев нефронов (ренальные), но они могут быть опосредованы и внепочечными расстройствами гомеостаза (экстраренальные). Почечные нарушения реабсорбции. Повышенное содержание в первичной моче веществ, превышающее возможности их реабсорбции ферментными системами канальцев, например, глюкозы у больных сахарным диабетом, приводит к выведению этих компонентов первичной мочи из организма. Момент появления сахара в моче называют почечным порогом для глюкозы. Блокада ферментных систем, ответственных за транспорт глюкозы, например, флоридзином, приводит к гликозурии при нормальном уровне глюкозы в крови. Аналогичным образом функционирует механизм реабсорбции аминокислот. Повышение концентрации аминокислот в плазме крови (гипераминоацидемия) приводит к появлению этих органических соединений в моче (аминоацидурии). Нарушения реабсорбции аминокислот и моносахаридов проксимальными канальцами нефрона может быть обусловлены генетически. Они встречаются при аутосомно-рецессивных заболеваниях, вызванных мутацией генов транспортеров аминокислот в эпителии проксимальных канальцев. Например, данная мутация распространена среди населения Финляндии. К+/Na+-АТФ-азой опосредованные нарушения пиноцитоза и, соответственно, реабсорбции белков возникают при тяжелой гипоксии, выраженных расстройствах почечного кровотока, а также вследствие дистрофии канальцевого эпителия. Они обнаруживают себя появлением в моче белка (неселективная протеинурия) и развитием нефротического синдрома. Избирательное подавление активности фермента реабсорбции натрия (К+/Na+-АТФ-азы) приводит к полиурии. Этот эффект используется в фармакотерапии для коррекции водно-электролитного баланса организма при различных видах патологии.
Внепочечные нарушения реабсорбции связаны с расстройствами нейроэндокринной регуляции реабсорбции воды и натрия в канальцах. Интегративным показателем нарушения реабсорбции является утрата почками способности эффективно концентрировать мочу. В норме концентрирование мочи обеспечивается поворотно-противоточной системой почки. Основная масса воды (до 85%) всасывается из первичной мочи в проксимальных канальцах путем осмоса, а остальная жидкость (15%) возвращается в организм при участии альдостерона и антидиуретического гормона (АДГ) в дистальном канальце. При заболеваниях, вызванных недостатком выработки вазопрессина (АДГ) и альдостерона реабсорбция воды в дистальных отделах канальцев и собирательных трубочках уменьшается. Диурез у таких больных может возрастать до 10-12 л в сутки, а удельный вес мочи снижаться до 1004-1014 (гипостенурия) и стабилизироваться на этом уровне (изостенурия). При избыточной продукции вазопрессина (синдром Пархона) диурез уменьшается, что приводит к задержке воды в организме. Нарушения секреции и экскреции. Клетки эпителия в просвет канальцев секретирует органические соединения, К+, аммоний (NH4+), аммиак, лекарственные средства (пенициллин, сульфаниламиды), протоны водорода. В почечном эпителии происходит метаболизм глутамина, играющего важную роль в выведении из организма продуктов азотистого обмен и водорода. Нарушение секреции протонов водорода при разнообразных заболеваниях почек приводит к расстройствам кислотно-основного состояния крови. Одновременно с секрецией происходит выведение из капилляров почек (экскреция) в канальцевую систему нефронов конечных продуктов обмена и чужеродных вещества (ксенобиотиков). В почках путем экскреции из крови выводится мочевина, мочевая кислота, креатинин, индол, фенолы и красители. Избирательные нарушения процессов секреции и экскреции встречаются редко, и, как правило, они являются следствием наследственных заболеваний. Нарушение секреции мочевой кислоты наблюдается при расстройствах азотистого обмена, проявляющихся подагрой. У детей встречаются патологические состояния, связанные с избыточным выведением бикарбонатов (бикарбонатный диабет) и нарушением кислотно-основного состояния крови (ацидоз). Парциальная или тотальная недостаточность выделительной функции почек (фильтрации, реабсорбции, секреции и экскреции) приводит к накоплению в организме чужеродных веществ и продуктов метаболизма, расстройствам водно-электролитного обмена и кислотно-основного состояния крови. В различных сочетаниях эти нарушения становятся существенными факторами патогенеза жизнеугрожающих состояний при почечной недостаточности. Кроме того, они составляют основу многих синдромов, возникающих при заболеваниях почек – нефропатиях. Почечная недостаточность Почечная недостаточность — это патологическое состояние, при котором почки не способны выделять азотистые метаболиты, обеспечивать водно-электролитный баланс и кислотно-основное равновесие организма. Почечная недостаточность развивается в результате нарушения клубочковой фильтрации, а вслед за ней и канальцевой реабсорбции и секреции. По скорости развития патологического состояния выделяют острую и хроническую почечную недостаточность. Острая почечная недостаточность Острая почечная недостаточнось (ОПН) возникает вследствие воздействия на органы преренальных, ренальных и постренальных факторов. Этиология и патогенез ОПН. Преренальные факторы опосредованы нарушениями системного и органного кровообращения, которые приводят к циркуляторной гипоксии в почках. Преренальная ОПН возникает вследствие выраженного уменьшения количества внутрисосудистой жидкости в организме (гиповолемии). Гиповолемия возникает после тяжелой травмы и кровопотери, при неукротимой рвоте (отравление, лучевая болезнь) и диарее (холера, болезнь Крона), профузном (проливном) поте при перегревании или лихорадке. ОПН может развиться и на фоне нормоволемии у больных тяжелым миокардитом, инфарктом миокарда, а также при кардиогенном шоке и расстройствах кровообращения, вызванных анафилактическими реакциями и сепсисом. ОПН возникает при нарушениях органного кровотока, связанных с окклюзией почечных артерий при атеросклерозе и остром тромбозе, тяжелых расстройствах микроциркуляции в почках (ДВС-синдром, васкулиты, гемостазопатии). Злокачественные опухоли и аутоиммунные заболевания соединительной ткани (склеродермия, системная красная волчанка) также могут служить причиной повреждения интимы почечных артерий и развития острой почечной недостаточности. К ренальным причинам ОПН относятся острые заболевания почек, при которых преимущественно повреждаются клубочки (гломерулопатии) или канальцы (тубулопатии) нефрона. Распространенным видом патологии, который приводит к ОПН, является острый гломерулонефрит. Гломерулонефриты – это группа нефропатий, характеризующихся диффузным поражением почечной ткани воспалительного и/или иммунопатологического генеза с вовлечением в патологический процесс преимущественно клубочковых отделов нефронов. Острые гломерулопатии (нефриты) часто связаны с активацией скрытой инфекции, например, распространенное заболевание острый постстрептококковый гломерулонефрит, вызывается β-гемолитическим стрептококком группы А. Причиной тяжелого нарушения функции клубочков может быть появление в плазме крови в больших количествах свободного гемоглобина и миоглобина. Это наблюдается при переливании несовместимой крови и тяжелых механических повреждениях скелетной мускулатуры, после имплантации сосудистых протезов, при малярии, и других заболевания, сопровождающихся массивным гемолизом эритроцитов. Помимо нарушения кровотока и фильтрации плазмы молекулы миоглобина оказывают прямое повреждающее действие на мембрану клубочков. Острые тубулопатии (нефрозы) проявляются в виде некроза канальцев нефрона. Главными повреждающими факторами эпителия канальцев при нефрозах являются лекарственные и диагностические препараты: аминогликозиды, гиперосмоляльные рентгенконтрастные вещества, анестетики, цитостатики и наркотические анальгетики. Наряду с ними, токсическое действие на почечные канальцы оказывают тяжелые металлы, ртуть, органические растворители, анилиновые красители и яды насекомых. Факторами, провоцирующими острые тубулопатии, могут быть внутриканальцевые отложения, возникающие при нарушениях азотистого обмена (подагре) и избыточном содержании в моче кальция (гиперкальциурия), мочевой кислоты (гиперурикемия), и, особенно, солей щавелевой кислоты (гипероксалатурия). Постренальная ОПН развивается при мочекаменной болезни (уролитиаз) и урологических заболеваниях (врожденные аномалии и приобретенная патология), в том числе и опухолевой природы (гиперплазия предстательной железы и другие). Другими причинами развития данного вида почечной недостаточности могут быть обширные кровоизлияния (гематомы) в области мочевыводящих путей, образующиеся при травмах костей таза. Периоды острой почечной недостаточности В течении ОПН выделяют начальный период, а также периоды олигурии (анурии), полиурии и исхода (выздоровления). Клиническая картина начального периода определяются интенсивностью действия повреждающего фактора, например, временем уменьшенного кровотока по почечной артерии или дозой лекарственного препарата. Период олигурии (анурии) длится от 2-х суток до 2-х недель и характеризуется резким или постепенным уменьшением фильтрации и диуреза менее 500 мл (олигурия) или менее 50 мл (анурия). Нарушения водно-электролитного баланса в этот период характеризуются, главным образом, избыточным содержанием в плазме ионов калия (гиперкалиемия) при уменьшении концентрации в крови ионов натрия (гипонатриемия). Понижение осмолярности плазмы (гипоосмолярность) приводит к уменьшению выведения воды почками и гипергидратации организма. Одновременно в крови происходит накопление ионов магния и фосфатов, что, в свою очередь, вызывает снижение в плазме уровня кальция. К расстройствам водно-электролитного баланса присоединяются нарушения кислотно-основного состояния крови – метаболический ацидоз, обусловленный задержкой выведения и накоплением продуктов азотистого обмена. Третий период ОПН - период полиурии. Восстановление и увеличение диуреза в этот период носит компенсаторный характер. Количество мочи, выводимое из организма в сутки, достигает нескольких литров. Усиленное выделение мочи направлено на снижение азотемии - уменьшение содержания креатинина, мочевины, а также токсических молекул средней массы в плазме крови. Восстановление водно-электролитного баланса происходит в течение 20 дней. Течение ОПН может заканчиваться выздоровлением без значимых нарушений функций почек. Однако, в ряде случаев, исход ОПН бывает неблагоприятным. Хроническая почечная недостаточность Хроническая почечная недостаточность (ХПН) - это синдром, который характеризуется прогрессирующим и необратимым ухудшением функций почек с неблагоприятным исходом. Длительность течения ХПН варьирует от 2-х до 10 лет. Хроническая почечная недостаточность, как правило, развивается на фоне хронических нефропатий. В последнее время широко используется понятие «хроническая болезнь почек». Оно включает различные виды патологии, при которых структурные нарушения почечной ткани и резкое уменьшение скорости клубочковой фильтрации наблюдается течение 3 и более месяцев. Хроническая почечная недостаточность часто развивается как одно из основных осложнений сахарного диабета первого и второго типа (диабетическая), а также ХПН вызывается нефропатиями, вызванными аутоиммунными процессами, инфекционными агентами, токсическим действием лекарств, нарушениями кровоснабжения и врожденными аномалиями почек (недиабетическая). Среди недиабетических видов патологии лидирующее положение в генезе ХПН занимает хронический гломерулонефрит. ХПН характеризуется поражением большинства или всех нефронов, чаще всего замещающихся соединительной тканью. Ведущим звеном патогенеза заболевания является неуклонное уменьшение числа функционирующих нефронов вследствие склерозирования клубочков (гломерулосклероз) и сокращение объема функционирующей паренхимы органа. Экскреторная недостаточность почек длительно компенсируется интенсификацией функций неактивных (резидуальных) нефронов. В результате усиленного образования почками простагландинов в капиллярах клубочков повышается гидростатическое давление и усиливается фильтрация. Однако, если из процесса фильтрации выключается более чем 75% всех клубочков хроническая почечная недостаточность становится необратимой. Стадии и синдромы при хронической почечной недостаточности В течение ХПН выделяют 3 стадии: латентную, гиперазотемическую и уремическую. Латентная стадия может длиться несколько лет. Компенсаторное повышение гидростатического давления в капиллярах клубочков стимулирует эндотелий и усиливает продукцию эндотелиоцитами факторов роста (PDGF и TGF-β). В результате происходит гипертрофия клубочков и увеличивается площадь фильтрационной поверхности нефронов. Однако проницаемость фильтрационного барьера при этом нарушается, что приводит к появлению в составе ультрафильтрата и конечной мочи белков (протеинурия). Многие протеины, выводимые с мочой (факторы роста, цитокины, железосодержащие белки, компоненты комплемента) способны активировать в нефронах местные механизмы экспрессии хемокинов (MCP-1, ICAM-1) и приводить к клеточной инфильтрации почечной паренхимы моноцитами и Т-лимфоцитами и иммунному воспалению. При прогрессировании хронической болезни почек возникают полиурия и нарушение электролитного баланса (гипокалиемия), а также активируются факторы (тромбоспондин и другие), тормозящие процессы образования в почках новых сосудов (ангиогенез). Дисфункция эндотелия микрососудов почек инициирует активацию тромбоцитов. В системе микроциркуляции начинают преобладать местные процессы гиперкоагуляции крови, способствующие возникновению в почечной паренхиме ишемии и развитию гломерулосклероза. В результате сочетанного развития этих патологических процессов в почках происходит утрата капилляров, прилегающих к канальцам (перитубуллярной сети), и начинается тотальное повреждение канальцевой системы нефрона вплоть до формирования интерстициального фиброза. Дисфункция эндотелия клубочков приводит к выработке ренина и ангиотензина, что обусловливает развитие ангиотензин II опосредованной почечной артериальной гипертензии. При протеинурии и потере более, чем 5 г белка в сутки развивается нефротический синдром. Он характеризуется не только наличием белка в моче, но и уменьшением концентрации альбумина плазмы крови (гипоальбуминемия), повышением содержания холестерина (гиперхолестеринемия) и триглицеридов в крови, а также типичными для болезней почек отеками. Гиперазотемическая стадия. При усугублении экскреторной недостаточности почек в крови увеличивается содержание мочевины, креатинина, сульфатов, фосфатов, наблюдаются метаболический ацидоз и гематурия (эритроциты в моче). В гиперазотемической стадии ХПН появляются признаки эндогенной интоксикации: астенический синдром (апатия, вялость, депрессия), диспепсический синдромом (потеря аппетита, тошнота), анемический синдром (нарушения синтеза эритропоэтина и кроветворения), серозно-суставной и костный синдромам (боли в суставах, выпот в серозные полости). В генезе вторичной артериальной гипертензии, помимо ренина и ангиотензина II (реноваскулярный вариант почечной гипертензии), важную роль начинает играть недостаточность продукции антигипертензивных простагландинов (ренопривный вариант почечной гипертензии). При уменьшении клубочковой фильтрации ниже 10 мл/мин развивается терминальная (уремическая) стадия ХПН. В терминальной стадии нарастает азотемия, гиперкалиемия и гипонатриемия, ацидоз, развивается олигурия и гипергидратация организма. Терминальная стадия длится около 2-3 недель и завершается уремической комой. Уремия Уремия - это синдром аутоинтоксикации, развивающийся при декомпенсации (острой или хронической) почечной недостаточности и характеризующийся задержкой в организме азотистых метаболитов (мочевина, мочевая кислота, креатинин, индол, фенол, ацетон) или токсических веществ, выраженными расстройствами водно-электролитного обмена и кислотно-основного состояния. Накопление мочевины увеличивает осмолярность крови, ингибирует потребление кислорода и метаболизм глюкозы в ткани головного мозга. При увеличении содержания креатина образуются производные гуанидина, обладающие токсическим действием на нейроны – возникают симптомы энцефалопатии. В результате нарушения обмена мочевой кислоты (гиперурикемия), ее соли откладываются в перикарде (уремический перикардит), в слизистой оболочке стенки желудка (уремический гастрит). В крови повышается содержание полиаминов (кадаверин, путресцин), которые угнетают транспорт глюкозы и приводят к нарушениям окислительно-восстановительных процессов в клетках. Уремия характеризуется вторичными эндокринопатиями, увеличением содержания в плазме соматотропного гормон, инсулина, глюкагона, метаболитов кортикостероидов, и прогрессированием дистрофических нарушений в органах и тканях. В результате необратимой гибели клеток ренальной паренхимы развивается дефицит активной формы витамина Д, задерживаются фосфаты и нарушается кальциевый обмен. При уремии развиваются многоступенчатые нарушения гемостаза и тромбоцитарно-сосудистого взаимодействия, вызывающие геморрагический синдром. Энцефалопатия и уремическая кома. В общем виде энцефалопатия представляет собой комплекс симптомов нарушений функций ЦНС, выраженность которых зависит от стадии и тяжести уремии. На ранних этапах выявляются головная боль, дрожательная гиперкинезия (тремор), нарушения зрения, повышение тонуса скелетной мускулатуры и судороги. Эндогенные метаболиты нарушают баланс процессов возбуждения и торможения, опосредованных в ЦНС нейромедиаторами. Они вызывают очаги демиелинизации в центральном и периферическом отделах нервной системы, а также вызывают дефицит образования АТФ и нарушение работы K+/Na+-АТФ-азы в нейронах. Под действием эндогенных метаболитов развивается эндотелиальная дисфункция сосудов головного мозга, проявляющаяся подавлением синтез оксида азота и нарушением тонуса церебральных сосудов. При тяжелом метаболическом ацидозе в клетках ЦНС наблюдается усиление синтеза аминокислот, полиолов и триметиламинов, приводящее к гипоосмолярности мозговой ткани и внутриклеточному отеку головного мозга. Параллельно с угнетением сознания у больного нарушается периодичность и глубина дыхания (дыхание Куссмауля). Вследствие резкого увеличения концентрации калия (гиперкалиемия) урежается частота сердечных сокращений (брадикардия). Наблюдается бледность, сухость кожных покровов и слизистых, развиваются выраженные отеки (анасарка). Нефропатии Токсические нефропатии. Лекарственное поражение почек. Длительный прием лекарственных препаратов приводит к изолированным или сочетанным с другими органами повреждениям почек. По механизму действия на почечную ткань выделяют лекарственный нефрит, токсическую почку (нефротоксический нефрит) и лекарственную нефропатию. Патогенез лекарственного нефрита связан с реакциями немедленного типа I (ГНТ-I) и иммунным поражением почечной ткани. Его развитие может быть связано с приемом любого лекарственного средства, а также с введением вакцин и сывороток. В основе токсической и лекарственной нефропатий лежат морфофункциональные нарушения почек, вызванные прямым действием химических соединений, а также лекарственных препаратов или их метаболитов на почечную ткань. Высокая интенсивность почечного кровотока, многократность оборота всей крови, а вместе с ней и лекарств, через почки создают наиболее “благоприятные” условия для повреждения фильтрационного барьера клубочков, клеток интерстиция мозгового слоя и эпителия канальцевой системы нефрона. Прямое и выраженное нефротоксическое действие оказывают антибиотики аминогликозидной группы, особенно неомицин, мономицин, канамицин, стрептомицин; умеренное повреждение вызывают амфотерицин В, полимиксин и гентамицин. Нефротоксическое действие тетрациклина проявляется, если он кумулируется в организме вследствие снижения экскреторной функции почек. Повреждения в почках возникают при длительном применении нестероидных противовоспалительных средств (ацетилсалициловая кислота, бутадион), способствующих нарушению окислительного фосфорилирования в эпителии канальцевого аппарата нефрона. Тяжелые последствия в виде спазма микрососудов, тромбоза почечных капилляров и развития ОПН возникают при ангиографических исследованиях с введением рентгеноконтрастных веществ. При длительном применении мочегонных, слабительных препаратов возможно нарушение концентрационной способности почек за счет дистрофии эпителия канальцев. К основным признакам лекарственных нефропатий относят - гематурию (эритроцитурию), протеинурию, нефротический синдром. Возможно развитие олигурии на фоне острой почечной недостаточности. Некоторые нефропатии (фенацетиновые) могут протекать длительное время бессимптомно. При манифестации заболевания появляются симптомы хронической почечной недостаточности (полиурия, изогипостенурия, снижение скорости клубочковой фильтрации, повышением уровня креатинина, анемия и артериальная гипертензия). Лекарственные нефропатии наблюдаются при лечении бензилпенициллином, сульфаниламидами, противотуберкулезными средствами (тубазид), препаратами золота и нитрофуранового ряда, солями ртути, соединениями железа с декстранами, новокаином. Развитие токсических нефропатий возможно при экзогенных интоксикациях тяжелыми металлами (Cd, Pb), непосредственно вызывающими некроз почечной паренхимы. Выделяют кадмиевую и свинцовую нефропатии. Развернутая клиническая картина при токсических нефропатиях, вызванных тяжелыми металлами, сопряжена со снижением скорости клубочковой фильтрации, развитием олигурии или анурии, протеинурии, артериальной гипертензии, аминоацидурии и гликозурии. Диабетическая нефропатия (ДН) - это общее понятие, объединяющее различные варианты поражения почек при сахарном диабете, в том числе гломерулосклероз, инфекцию мочевых путей и папиллярный некроз. Диабетический гломерулосклероз (диабетическая нефропатия) – это заболевание, характеризующееся появлением специфических дегенеративных изменений в сосудах клубочков, приводящих к развитию протеинурии, отеков и артериальной гипертензии. Диабетическая нефропатия является наиболее частой причиной смерти в большинстве развитых странах. Около 25% больных с диабетом 1-го типа страдают от ДН через 7-10 лет с момента постановка диагноза основного заболевания. Главными факторами риска диабетической нефропатии являются неконтролируемый уровень гипергликемии и артериальная гипертензия, а наследственная предрасположенность. Установлено, что ДН развивается при мутации генов ферментов, связанных с избыточным содержанием в крови гомоцистеина. При ДН наблюдается утолщение фильтрационного барьера, гиалиноз приносящих и выносящих артериол, склероз почечных клубочков с последующим распространением атрофических процессов на канальцы нефронов. Появление клубочковой гиперфильтрации свидетельствует о развитии почечной недостаточности. Прогностически неблагоприятным признаком течения нефропатии у больных сахарным диабетом является нефротический синдром. Врожденный нефротический синдром (врожденный нефроз, семейный нефроз) – это аутосомно-рецессивное заболевание, которое проявляется в первые три месяца жизни и приводит к летальному исходу. Врожденный нефроз встречается в различных этнических группах населения, наиболее часто у финнов. Ведущим механизмом патогенеза семейного нефроза является утрата в результате генных мутаций трансмембранного белка – нефрина и неселективная утечка белка через мембрану клубочков. Массивная протеинурия развивается уже к 35-38 неделям гестации. Массивная потеря белка приводит к задержке внутриутробного развития плода. У новорожденных развиваются отеки, вплоть до асцита, а также резко повышается чувствительность к респираторной бактериальной инфекции. При тяжелом врожденном нефрозе с дефицитом белка происходит нарушение баланса факторов гемостаза и развивается тромбофилия, а также замедляется синтез тиреоидных гормонов (гипотиреоз). В почках происходит склероз клубочков, развивается интерстициальный фиброз, атрофия канальцев и утрата морфологических отличий коркового и мозгового слоев почечной ткани. В возрасте от 3 до 8 лет в крови детей постепенно нарастает уровень креатинина и мочевины с развитием конечных стадий ХПН. Нефропатии при беременности. По мере развития плода в организме беременной женщины постоянно повышается функциональная нагрузка на сердечнососудистую и эндокринную системы, а также на водно-электролитный обмен. Изменения гомеостаза на организменном уровне приводят к закономерной морфофункциональной перестройке органов и тканей. В почках возрастает кровоток, усиливается функциональная нагрузка на нефроны, что приводит к гипертрофии почечных клубочков, повышению интенсивности клубочковой фильтрации и другим изменениям. Отражением особого функционального состояния почек в период беременности является физиологическая протеинурия. Экскреция белка с мочой за сутки при беременности увеличивается почти в 2 раза. При осложненном течении беременности, во второй ее половине (гестоз), в почках возникает отек и дистрофические изменения эндотелия капилляров клубочков, а также резко уменьшается просвет сосудов. Эти патологические изменения в почках беременных женщин известны как «гломерулярный эндотелиоз». При гломерулярном эндотелиозе потеря белка из организма с мочой может достигать 10 г в сутки. Развивается нефротический синдром (отеки и другие симптомы), а также появляется артериальная гипертензия. В редких случаях наблюдается тяжелые поражения коркового слоя почек или тубулярный некроз с развитием острой почечной недостаточности беременных. Врожденные аномалии почек. Современные технологии лучевой диагностики позволяют выявить аномалии развития почек у плода уже на 20-й неделе его гестации. Врожденные аномалии остаются главной причиной развития терминальных стадий заболеваний почек у детей. Признаком неправильного формирования мочевыводящей системы служит гидронефроз. Гидронефроз – стойкое расширение полостей почечной лоханки и чашечек с патологическими изменениями интерстициальной ткани и атрофией почечной паренхимы, вызванное нарушением оттока мочи. Он подразделяется на двусторонний и односторонний. Среди причин двустороннего гидронефроза могут быть усиленный заброс мочи из мочевого пузыря в мочеточники (рефлюкс), атоничный мочевой пузырь и мочеточник огромных размеров, а также аномальное сужение мочеточников (атрезия). Односторонний гидронефроз бывает при сужении места соединения лоханки и мочеточника, а также при удвоении почки или подковообразной почке. Эта аномалия известна у младенцев как наиболее часто встречаемая среди аномалий почек и сочетается с гидронефрозом. Мочекаменная болезнь и воспалительные заболевания почек и мочевыводящих путей Нефролитиаз или мочекаменная болезнь - это образование в почках плотных конкрементов (камней) из неорганических и органических компонентов мочи. Формирование конкрементов в лоханках, чашечках и мочеточниках обозначается как уролитиаз. МКБ страдает 5-10% населения планеты, из них до 40% больных имеют заболевания мочевой системы. Болезнь проявляется в возрасте от 20 до 40 лет и у мужчин оно встречается в 4 раза чаще, чем у женщин. К регионам, в которых население чаще других страдает уролитиазом, относятся Центральная Азия, Северный Кавказ, Греция, восточные районы США. К факторам риска развития нефролитиаза относится семейный анамнез заболевания, профессиональное занятие спортом, длительный прием плохо растворимых лекарственных препаратов, а также высокое содержание кальция и оксалата в моче. Риск образования камней возрастает при аномалиях развития мочевыделительной системы, которые приводят к застою мочи (подковообразная почка и изгибы мочеточника). Среди осложнений нефро- (уро-) литиаза наиболее частыми являются почечная колика (острые боли в поясничной области). Она развивается в результате острой закупорки просвета мочеточника, нарушения оттока из почки мочи и повышения внутрилоханочного давления. В большинстве случаев появление камней связано с увеличением содержания в крови и выделением почками оксалатов (до 60% камней), фосфатов (до 20% камней) и кальция. Уровень оксалата мочи повышает употребление в пищу зелени, орехов, шоколада, клубники и высоких доз витамина С. Причиной повышения свободного кальция в плазме крови и развития гиперкальцийурии может стать прием витамина Д и кортикостероидов в больших дозах. Механизм камнеобразования связан с усиленным всасыванием кальция в кишечнике, интенсивным вымыванием из костей и уменьшением его реабсорбции в проксимальных канальцах нефрона. Камнеобразованию способствует, так называемая «западная» диета, а также дефицит калия в рационе питания. Наиболее распространенным приобретенным фактором риска образования, в частности, фосфатных камней является инфекция мочевыводящих путей. Воспаление почечной лоханки (пиелонефрит) встречается от 6 до 30% населения и составляет в структуре нефрологических заболеваний - до половины всех случаев Пиелонефритом женщины болеют в 2-5 раз чаще мужчин в любом возрасте, девочки в возрасте от 2 до 15 лет – в 6 раз чаще, чем мальчики. В пожилом возрасте вследствие доброкачественной гиперплазии простаты распространенность этого заболевания у мужчин повышается. Пиелонефрит является частым осложнением мочекаменной болезни на фоне восходящей бактериальной инфекции (Escherichia coli). Возможен гематогенный путь распространения инфекции и развития пиелонефрита, например, при стафилококковом сепсисе или милиарном туберкулезе. Острый пиелонефрит у взрослых сопровождается болями в пояснице, умеренной лихорадкой, а также появлением бактерий (бактериурия) и лейкоцитов (пиурия) в моче. Обструкция мочевыводящих путей при пиелонефрите вызывает нарушение оттока мочи из собирательных трубочек, а также создает условия для размножения бактерий и гнойного расплавления почечной паренхимы с формированием пионефроза. Пионефроз является конечной стадией прогрессирования специфического (туберкулезного) или неспецифического (вульгарного) пиелонефрита. Он проявляется гнойно-деструктивным поражением почек с образованием полостей в паренхиме органа. Воспаление слизистой мочевого пузыря (цистит). Хроническое воспаление слизистой мочевого пузыря (интерстициальный цистит) является одним из наиболее частых заболеваний среди женщин. Цистит у женщин встречается в 10 раз чаще, чем у мужчин. Цистит вызывают инфекционные и токсические факторы, а также он может развиться с участием тучных клеток и аутоиммунного воспаления. Важным условием перехода острого процесса в хроническую форму воспаления являются нарушение регуляции функции мочевыдения, а также повышенная проницаемость эпителия слизистой мочевого пузыря. Повышенную проницаемость связывают с включением в патологический процесс иммунного компонента (эозинофилов, тучных клеток и Т-лимфоцитов). В генезе цистита важную роль отводят нарушениям микроциркуляции в стенке мочевого пузыря, а также угнетению пролиферативной активности эпителии, связанного с торможением процессов обновления эпителия слизистой. Обнаружен антипролиферативный фактор (APF), подавляющий регенерацию эпителия и экспрессию некоторых мембранных белков. Повреждение нервных окончаний, расположенных в подслизистом слое стенки, приводит к активации афферентации, повышенной сократительной способности мышечного слоя, на основе которых формируется хронический болевой синдром. Опухоли почек и мочевыводящих путей. Рак простаты Опухоли почек – группа относительно редких онкологических заболеваний. Они встречают в 2-3% от всех выявляемых у человека новообразований. В структуре онкологических болезней почек преобладают злокачественные опухоли, а в 80-90% устанавливается диагноз рак почки (аденокарцинома). Опухоли почек чаще встречаются у мужчин. Клиническая симптоматика часто длительно отсутствует. Проявления болезни начинаются с болевого синдрома и появления эритроцитов в моче (гематурии). В большинстве случаев при проведении комплексного лечения (хирургическое лечение с последующей химиотерапией) прогноз у пациентов благоприятный. При наличии отдаленных метастазов прогноз значительно ухудшается. Опухоли почечных лоханок и мочеточников являются карциномами и располагаются в любом месте на протяжении от чашечно-лоханочного комплекса до мочеточниково-пузырного соединения. Возрастная группа больных – это лица старше 40 лет, причем мужчины болеют в 2 раза чаще, чем женщины. Поражения мочеточников являются, как правило, множественными и они возникают уже при наличии карциномы мочевого пузыря. Рак мочевого пузыря представляет собой часто встречающуюся опухоль среди злокачественных новообразований у мужчин. В механизме повреждения слизистой мочевого пузыря играют роль механические, химические и биологические факторы. К механическим факторам, препятствующим эвакуации мочи из мочевого пузыря, относят стриктуру уретры, которая может быть вызвана инфекцией мочевыводящих путей (цистит или уретрит). Определенную роль в возникновении рака мочевого пузыря отводят заболеваниям, вызванным специфической инфекцией, передающейся половым путем (Neisseria gonorrhoeae и Chlamidia trachomatis). Предрасполагающими химическими факторами развития рака являются курение, профессиональный контакт с анилиновыми красителями, лечение циклофосфамидом и фенацетином. Особое место занимает специфическое воспаление слизистой мочевого пузыря, вызванное Schistosomiasis haemаtobium. Морфологически рак мочевого пузыря может присутствовать в папиллярной форме, in situ на большой площади слизистой, а также в инфильтративной форме с прорастанием стенки мочевого пузыря и близлежащих тканей. Клиническим симптомом рака мочевого пузыря служит гематурия. Рак уретры – редкая опухоль, часто встречающаяся у женщин с уретральным дивертикулом, и у мужчин со стриктурой непростатической области уретры или в области простаты. Рак простаты занимает 4-е место по частоте среди всех случаев онкологических заболеваний у мужчин. Чаще всего заболевание проявляется в пожилом и старческом возрасте. Одним из специфических маркеров рака предстательной железы являются PSA (prostate-specific antigen), PDF (prostate derived factor), p53 и bcl-2. Данные молекулы используются для определения стадии процесса и прогноза выживаемости. Принципы лечения болезней почекЛечение заболеваний почек и органов мочевыделения направлено на полное выздоровление или устранение основных синдромов, снижающих качество жизни пациентов. Для этого оказание помощи нефрологическим больным при наиболее распространённых и тяжело протекающих острых и хронических болезнях (гломерулонефритов, пиелонефритов, нефрозов) почек проводится в условиях специализированного стационара. Заболевания, которые не относятся к таковым (цистит, уретрит и другие), лечатся амбулаторно, в поликлинике с участием специалистов. Больным с онкологическими заболеваниями и специфическими процессами в почках медицинская помощь оказывается специалистами онкологами и фтизиатрами. Коррекция основных расстройств функций почек основана на этиотропном, патогенетическом и симптоматическом принципах. Этиотропная терапия направлена на устранение или ослабление действия причинного фактора и неблагоприятных внешних и внутренних условий. При инфекционной природе патологического процесса в почках проводится комплексная антибактериальная терапия. Кроме того, лечатся другие заболевания, вызвавшие и усугубляющие патологические изменения в почках (хроническая инфекция, гнойные процессы) или существенно влияющих на неё развитие (сахарный диабет, атеросклероз и др.). Патогенетическая терапия призвана разорвать цепь механизмов (основного звена, ведущих и второстепенных звеньев) развития почечного заболевания. Для этого используются мероприятия и средства заместительного, стимулирующего, тормозящего, корригирующего лечения. Широко применяются иммунодепрессанты, иммуномодуляторы, антиаллергические и гормональные препараты. Для уменьшения функциональной нагрузки на почки, а также замещения утраченных функций широко используются методы эфферентной терапии (перитонеальный диализ, плазмоферез, гемосорбцию), а также аппарат «искусственная почка». Радикальным способом решения проблемы хронической почечной недостаточности является пересадка донорской почки. Саногенетическая терапияпризвана активизировать восстановление нарушенных структур, функций, метаболических процессов, а также процессы репаративной регенерации повреждённых клеточно-тканевых структур, почек и мочевыводящих путей и других органов и систем организма. Симптоматическая терапиянаправлена на ликвидацию или ослабление разнообразных объективных и субъективных расстройств, вызванных как основным, так и сопутствующими заболеваниями. В частности, с этой целью используют средства для борьбы с отёками, анемией, артериальной гипертензией, тромбогеморрагическими расстройствами, рвотой, диареей, головными болями. Также назначают средства для лечения стоматитов, гастритов, энтеритов, колитов, дерматитов и других синдромов и заболеваний. |
