цветные металлы. Введение. Получение порошков цветных металлов и их сплавов
 Скачать 281.02 Kb. Скачать 281.02 Kb.
|
|
Липецкий государственный технический университет Кафедра металлургических технологий Реферат по дисциплине «Порошковая металлургия» на тему «Получение порошков цветных металлов и их сплавов» Выполнил __________________ Абрамова Т.В. студент группы ОЗ-ЧМ-18-1 Принял __________________ Кравченко Т.В. Ст.преподаватель Липецк 2021 г. СодержаниеВведение 3 1 Общие сведения о способах получения порошков цветных металлов 4 2 Процесс получения порошков автоклавным способом 7 3 Получение порошковых металлов и материалов методом цементации 14 Заключение 18 Список использованной литературы 19  ВведениеПорошковая металлургия основана на сочетании металлургического получения порошка с машиностроительной технологией производства изделий. Неразрывность металлургического и машиностроительного переделов определяет исключительно высокую эффективность порошковой металлургии. Она остается наиболее ресурсо- и энергосберегающим производством, позволяющим получать материалы с уникальными, недостижимыми другими методами, свойствами. Основным потребителем изделий порошковой металлургии является автомобильная промышленность (удельное потребление порошковых изделий составляет 60-80 %). Мировое производство порошков, в частности цветных металлов, характеризуется высокими темпами роста. Металлургия порошков цветных металлов весьма специфична: это мелкотоннажное производство, а конечная продукция гораздо дороже компактного металла; существует значительное количество приемов производства порошков весьма разнообразной номенклатуры; для получения порошков могут быть использованы полупродукты и отходы производства, что повышает комплексность использования рудного сырья и способствует созданию безотходных технологий. В отечественной практике в промышленном масштабе производят порошки меди, никеля, кобальта, свинца, олова, цинка, серебра, вольфрама, молибдена, благородных, редких металлов. Освоены разнообразные способы регулирования дисперсности и формы частиц порошка в процессе его получения («порошки с заданными свойствами»). 1 Общие сведения о способах получения порошков цветных металловТемпы увеличения производства металлических порошков во многом определяются использованием дешевых и простых методов их получения. Существуют различные способы получения порошков цветных металлов (таблица 1). Таблица 1 – Способы получения порошков цветных металлов
Наиболее широко внедрены в промышленность методы распыления и электролиза, поскольку именно эти методы используют для крупнотоннажного производства порошков меди и ее сплавов, алюминия, цинка, свинца и олова. По масштабам использования в мировом производстве второе место (после железа) занимают порошки меди и ее сплавов, из которых изготовляют детали электротехнического, антифрикционного, конструкционного назначения, изделия для других специальных целей. Часть этих порошков производят электролизом растворов и распылением расплавов, часть – гидрометаллургическими методами и восстановлением оксидов газами. Традиционный метод – электролиз – обеспечивает получение дендритных порошков высокой чистоты с низкой насыпной массой. Широкий спектр свойств порошков меди позволяет применять ее в различных отраслях техники. 2 Процесс получения порошков автоклавным способомАвтоклавная технология получила широкое распространение для производства порошков никеля, меди и кобальта: соответствующий металл, вытесняемый в растворе из его соединения водородом под давлением, осаждается в виде твердых частиц (порошинок). Исходное сырье (рудные концентраты, например никель-кобальтовый, медно-цинковый, медно-свинцово-цинковый и другие, медно-цинковый скрап или отходы металлообработки) подвергают обработке серной кислотой или окислительному аммиачно-карбонатному выщелачиванию, которое часто проводят при повышенном давлении в автоклавах. Полученный раствор сульфата или комплексной аммиачной соли металла очищают от примесей и подают в автоклав на восстановление водородом. Реакция восстановления катиона металла  возможна, если потенциал водорода φH2 меньше (электро-отрицательнее), чем электродный потенциал металла φМе, то есть φH2 < φМе. В момент равновесия рН становится равным рМе и накапливание массы образующегося в автоклаве осадка металла прекращается. Водород переходит в раствор, содержащий катионы MeZ+, по реакции ионизации  константа равновесия которой рассчитывается по формуле  где  –— активность (концентрация) водородных ионов, г-ион/л; –— активность (концентрация) водородных ионов, г-ион/л;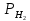 –— парциальное давление водорода. –— парциальное давление водорода.Отсюда потенциал водорода в растворе рассчитывается по формуле 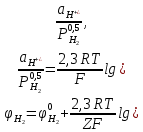 где  – валентность (для водорода Z=1); – валентность (для водорода Z=1); – стандартный потенциал водорода (принят равным нулю); – стандартный потенциал водорода (принят равным нулю); –— число Фарадея, равное 96 485 Кл/моль. –— число Фарадея, равное 96 485 Кл/моль.Таким образом, сдвигать потенциал водорода в отрицательную сторону можно повышая pH и (или) увеличивая давление водорода в автоклаве; более эффективно изменять pH, повышение которого на единицу эквивалентно изменению давления водорода в 100 раз. Для металлического электрода 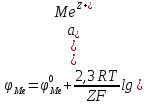 При равенстве потенциалов  Откуда:  что позволяет рассчитать минимальную (равновесную) концентрацию катионов металла в конце процесса восстановления в зависимости от pH раствора при данном давлении водорода (рисунок 1).  Рисунок 1 – Зависимость сред растворов от рН показателя Известно, что в сильнокислых средах полностью осадить из растворов можно достаточно электроположительные металлы (например, серебро, медь). Для полного выделения металлов со значениями потенциала лишь ненамного более положительными в сравнении с водородом, необходимо поддерживать определенную величину pH, нейтрализуя образующуюся при восстановлении кислоту, например, по реакции  С увеличением давления водорода несколько снижаются значения pH, при которых возможно сравнительно полное выделение металла из раствора его соли. Хотя некоторые тяжелые металлы (свинец, олово, никель, кобальт, кадмий) можно полностью осадить из растворов в интервале pH 4-10, практически в слабокислых или щелочных средах это неосуществимо из-за выделения их гидроксидов. Для снижения потенциала водорода до нужных отрицательных значений и предотвращения выпадения гидроксидов металлов восстановление целесообразно проводить в аммиачных растворах. Несмотря на то, что концентрация свободных ионов металла в растворе при этом низкая (NH3 – сильный комплексующий лиганд) и сдвигается в электроотрицательную сторону, восстановление водородом возможно, если потенциал металла остается более положительным, чем потенциал водорода в аммиачной среде. При восстановлении водородом из аммиачных растворов необходимо выдерживать оптимальное соотношение концентраций NH3 и Me, pH раствора и давление водорода. Термодинамические расчеты показывают, что многие металлы, в том числе медь, никель и кобальт могут быть осаждены восстановлением водородом из растворов при температуре 25°С и давлении водорода 0,1 МПа. Однако практическое получение порошка в этих условиях невозможно из-за низкой скорости осаждения металла. В общем случае первой стадией рассматриваемого процесса восстановления является образование зародыша твердой фазы, которое может быть как гомогенным (то есть самопроизвольным без наличия в растворе посторонних твердых включений), так и гетерогенным (то есть на зародышах, уже имеющихся в растворе, которыми могут быть не только специально вводимые частицы, но и твердые примеси или даже ионы). Большей частью гомогенное образование зародышей не реализуется вследствие энергетических затруднений, связанных с большой величиной энергии диссоциации молекулы водорода, равной 425 кДж/моль. Энергия активации рассматриваемых реакций восстановления водородом существенно снижается в присутствии твердых катализаторов, например металлов никеля, кобальта, железа, коллоидного графита, некоторых оксидов, и происходит гетерогенное зародышеобразование. Иногда вначале происходит медленное, гомогенное зародышеобразование, а затем скорость выделения металла из раствора быстро возрастает вследствие его кристаллизации на возникших зародышах твердой фазы; в этом случае процесс зародышеобразования носит автокаталитический характер. Медь может быть выделена восстановлением водородом как из кислых, так и щелочных растворов. Практически в качестве исходного вещества используют раствор сульфата меди или медно-аммиачной комплексной соли; соответствующие реакции восстановления имеют вид   Медь выделяется в результате диспропорционирования ионов Си+, которое протекает быстро; скорость процесса определяется двумя стадиями, предшествующими диспропорционированию Си+. Добавка сульфата натрия Na2SО4 сдвигает равновесие реакции в сторону восстановления, по-видимому, из-за связывания ионов водорода в слабо диссоциированные ионы HSO. В аммиачных растворах скорость выделения из раствора меди пропорциональна ее общей поверхности и давлению водорода в степени 0,5. Восстановление проводят при суммарном давлении газа в автоклаве 2,4–3,5 или 3,5–4,5 МПа (в том числе РН2 до 1,5–2,5 МПа) и температур около 140–170°С или 180–200°С соответственно; более высокая температура проведения реакции связана с большей термодинамической прочностью комплексной соли меди. Извлечение меди в осадок составляет около 99% (в растворе CuSО4 с концентрацией 80–90 г/л меди после восстановления ее остается около 1 г/л). Скорость процесса восстановления возрастает с увеличением количества суспендированной меди, тогда как наблюдается и непрерывное образование новых зародышей, то есть имеет место и гетерогенный, и гомогенный механизм зародышеобразования. Для восстановления применяют горизонтальные автоклавы с паровой рубашкой емкостью около 25 м3, с несколькими вертикальными мешалками; производительность одного автоклава около 3 тыс. тонн порошка в год. Получаемые порошки меди имеют насыпную плотность от 0,5 до 3,8 г/см3, причем размер их частиц можно регулировать в пределах от 2–3 до 15–20 мкм, вводя в раствор в автоклаве либо некоторое количество мелкого порошка меди, либо частицы полиакриламида (0,1–0,5 г на 1 л раствора). После завершения процесса восстановления пульпу из автоклава перекачивают через дроссель, сбрасывающий давление, в реактор, где раствор «вскипает», выделяя растворенный газ; затем пульпу перекачивают через фильтр и промывной аппарат в реактор для обработки мыльным раствором, откуда она поступает в камеру сушки. Химическая чистота автоклавных порошков высока (99,7–99,9% меди, менее 0,1% кислорода, менее 0,01% железа), а себестоимость примерно вдвое меньше себестоимости электролитических порошков меди; форма частиц самая разнообразная — дендритная, округлая, губчатая и другие. Получение порошков никеля и кобальта. Полное выделение никеля и кобальта возможно лишь при pH больше 4, в связи с чем водородное восстановление ведут из растворов, содержащих аммиачные комплексы  для предотвращения гидролиза аммиакатов. Гомогенное зародышеобразование протекает весьма медленно, поэтому прибегают к гетерогенному, вводя в раствор затравку, например, соответственно порошок никеля или кобальта. Последовательные стадии восстановления никеля и кобальта следующие: 1) растворение водорода в водном растворе (быстрая стадия); 2) транспорт водорода к поверхности твердой частички затравки (зависит от интенсивности перемешивания); 3) активированная адсорбция водорода на поверхности частички металла-затравки (быстрая стадия); 4) реакция восстановления сорбированных комплексных ионов металла водородом на поверхности твердой частички затравки (медленная стадия); 5) отвод растворимых продуктов реакции в объем раствора (быстрая стадия). Реакцию восстановления катионов указанных металлов водородом проводят при 180-200°С и давлении водорода 2,5–3,5 МПа в автоклавах аналогично указанному выше для получения порошков меди. При pH 2,5 возможно селективное осаждение никеля до его содержания примерно 0,2 г/л в присутствии менее 10 г/л кобальта. Так, из раствора, содержащего никеля около 50 г/л и кобальта около 10 г/л, осаждается около 99,5% никеля без заметного осаждения кобальта; в фильтрате отношение кобальта к никелю возрастает до 50 (вместо 0,2 в начальном растворе) и при pH 4,5 из него выделяют кобальт. Автоклавные порошки никеля содержат 99,7–99,9% никеля, 0,1–0,2% кобальта, менее 0,03% железа и менее 0,01% серы, а порошки кобальта— 99,5–99,8% кобальта, 0,1–0,5% никеля, менее 0,2% железа и не более 0,03% серы. 3 Получение порошковых металлов и материалов методом цементацииЦементация – это электрохимический процесс, который часто называют контактным восстановлением, или внутренним электролизом (металл с более отрицательным потенциалом вытесняет из раствора металл с более положительным потенциалом, переходя при этом в раствор). Электрохимическую реакцию между металлом цементатором и ионами вытесняемого металла в общем виде можно записать следующим образом: Z2Me1Z1+ + Z2M10 → Z2Me10 + Z1Me2Z2+, где Z1, Z2 – заряды ионов или валентности вытесняемого металла и металлацементатора. Для прохождения подобной реакции слева направо вытесняющий металл должен иметь более отрицательный электродный потенциал (таблица 1). По мере выделения Ме1 его концентрация в растворе уменьшается и, следовательно значение потенциала становится более отрицательным, а для цементирующего металла Ме2 – наоборот. Процесс вытеснения Ме1 из раствора будет протекать до установления равновесия, когда ϕМе1 = ϕМе2. Из приведенных в таблице 1 данных видно, что некоторые металлы можно практически полностью выделить из раствора. Однако при этом необходимо учитывать, что в результате связывания металлических ионов в комплексы понижается их концентрация в свободном виде и электродный потенциал осаждающегося металла сдвигается в отрицательную сторону. Таблица 2 – Стандартные электродные потенциалы и равновесные соотношения активностей катионов для некоторых пар двухвалентных металлов  Растворение и осаждение металла из раствора регулируется двумя противоположно действующими факторами: электролитической упругостью растворения и осмотическим давлением ионов раствора. Разность этих двух величин определяет значение и величину стандартного электродного потенциала. При погружении в раствор с ионами вытесняемого металла одни из участков металла-цементатора становятся катодами и на них идет выделение осаждаемого металла, а другие – анодами, где протекает процесс ионизации. Это связано с различием в уровнях энергии атомов, находящихся на поверхности металла-цементатора. Катодные участки возникают на местах поверхности с наиболее высоким электродным потенциалом. Так как катодные и анодные участки соединены, то электроны от анодных участков перетекают к катодным (рис. 1), а внешней цепью такого короткозамкнутого элемента служит электролит (раствор соли Ме1, в котором находится металлцементатор Ме2). После возникновения катодных участков на них продолжается преимущественное осаждение Ме1, так как это энергетически выгодней, поскольку не требует затрат энергии на образование зародышей новой фазы.  Рисунок 2 – Схема процесса цементации (а) и зависимость скорости цементации от времени (б). Процесс цементации металла из его раствора определяется двумя последовательными процессами: доставкой ионов вытесняемого металла к катодной поверхности металла-цементатора через двойной и диффузионный слой; электрохимическим превращением на границе электрод-раствор, протекающим через несколько промежуточных стадий (дегидратация иона, его сорбция, разряд иона на металле-цементаторе с образованием атома металла и пр.). Скорость реакции замещения зависит от разницы электродных потенциалов. Чем она больше, тем выше скорость цементации. Однако существует ряд других факторов, оказывающих влияние на результат реакции. Цементирующий материал должен образовывать растворимое соединение с анионом, который связан с замещаемым металлом. Металл-цементатор должен находиться в избытке. Это связано с тем, что реакция замещения проходит на поверхности и чем больше эта поверхность, тем скорее и полнее протекает реакция. В процессе реакции поверхность металла-цементатора может покрываться выделяемым из раствора металлом, вследствие чего она становится инертной. Поэтому раствор должен циркулировать. В некоторых случаях раствор подвергают действию ультразвука. Повышение температуры не только улучшает условия диффузии, но и снижает энергию активации реакции и процесс идет интенсивнее, переходя в диффузионную область. Кроме основных реакций, в процессе цементации при определенных условиях наблюдается выделение водорода (разряд его ионов) и восстановление растворенного кислорода на катодных участках Ме2. Эти побочные процессы ведут к дополнительным затратам цементирующего металла и растворению выделенного металла. Цементирующий металл часто используют в форме порошка (цинковая пыль, порошки железа или никеля), качество которого весьма сильно влияет на процесс. Присутствие в порошке более электроотрицательных примесей, хорошо растворимых в очищенном растворе, способствует реакции цементации. Примеси более электроположительных элементов затрудняют реакцию. ЗаключениеТехнологическая схема получения изделий методами порошковой металлургии включает ряд операций, которые предваряют или дополняют операции формования и спекания порошковых материалов и порошковых изделий: подготовка порошков к формованию (подбор фракционного состава порошков, смешивание, введение смазки, засыпка порошка в оболочку, обезгаживание, грануляция и прочее); послеформовочная доработка изделий (зачистка поверхности, удаление неликвидной части и прочее; обработка спеченного материала (механическая, химическая, химико-термическая и прочее); контроль свойств полученного материала. При автоклавном способе получения порошков восстановление проводят при суммарном давлении газа 2,4-3,5 или 3,5-4,5 МПа и температуре 140-170 или 180-200ºС. Восстановитель: водород, монооксид углерода, осуществляется в кипящем слое или плазме Сырьё: сернокислотные, амиачные растворы солей соответствующих металлов. Продукт: порошки медь, никель, кобальт, серебро, золото. Форма: дендритная, круглая и другие. Достоинства: является одним из самых экономичных способов. Высокая чистота получаемых порошков. Широкое внедрение в промышленность электронагрева различных материалов внесло значительное изменение в технологию производства. Промышленное использование высоких потенциалов выдвигает необходимость в разработке контактных устройств из тугоплавких материалов, которые должны обладать высокой теплопроводностью и электропроводностью, иметь высокую степень прочности в условиях ударных нагрузок при высоких температурах, незначительную склонность к свариванию и прилипанию. Изготовление контактных материалов, обладающих таким сочетанием свойств, возможно только методами порошковой металлургии. Список использованной литературыМасленицкий, И.Н. Автоклавные процессы в цветной металлургии / И.Н. Масленицкий, В.В. Доливо-Добровольский, Г.Н. Доброхотов, С.И. Соболь. - Москва: Металлургия, 1969. – 359 с. Смирнов, И.И. Автоклавная технология переработки пирротинового концентрата / И.И Смирнов, Г.Н. Шиврин, А.Л. Сиркис. – Красноярск: Высшая школа, 1986. – 253 с. Циклис, Д.С. Техника физико-химических исследований при высоких и сверхвысоких давлениях. – Москва: Химия, 1976. – 432 с. Комаров, О.С. Технология конструкционных материалов: учебник/ О.С. Комаров, В.Н. Ковалевский, А.С. Чаус и др.; под общей редакцией О.С. Комарова. – Минск.: Новое знание, 2005. – 560 с. Кнорозов, Б.В., Технология металлов. / Б.В. Кнорозов, Л.Ф.Усова, А.В.Третьяков, И.А. Арутюнова, С.П. Шабашов, В.К. Ефремов, «Металлургия», 1974. – 648 с. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
