ashuiko_ximiya-kompleksnyx-soedinenii-4-19 (копия). Принадлежит Л. А. Чугаеву
 Скачать 111.67 Kb. Скачать 111.67 Kb.
|
1 2 Ëåêöèÿ 1 ÊÎÌÏËÅÊGÍÛÅ GÎÅÄÈÍÅÍÈß. ÊÎÌÏËÅÊGÎÎÁÐÀÇÎÂÀÒÅËÜ. ËÈÃÀÍÄÛ, ÈÕ ÊËÀGGÈÔÈÊÀÖÈß, ÄÅÍÒÀÒÍÎGÒÜ. ÊÎÎÐÄÈÍÀÖÈÎÍÍÎÅ ×ÈGËÎ ÀÒÎÌÀ-ÊÎÌÏËÅÊGÎÎÁÐÀÇÎÂÀÒÅËß (ÈÎÍÀ-ÊÎÌÏËÅÊGÎÎÁÐÀÇÎÂÀÒÅËß) Считается, что первым полученным комплексным соединением была соль [Co(NH3)6]Cl3, синтезированная Тассером в 1798 г. Эту дату считают точкой отсчета, от которой ведет свою историю координаци- онная химия. В те далекие годы комплексные соли записывали в виде CoCl3 6NH3, 4KCN Fe(CN)2. Выделение химии комплексных (координационных) соединений в самостоятельную область химической науки в значительной мере принадлежит Л. А. Чугаеву. Благодаря его работам химия комплекс- ных соединений стала интенсивно развиваться. В 1893 г. А. Вернер ввел в практику и определил такие понятия, как центральный атом (позже возникло понятие «центральный ион- комплексообразователь»), атом (ион), который образует связи с коор- динированными вокруг него группами атомов или ионов (лигандами), внутренняя и внешняя координационная сфера, координационное число. Вернер определил также понятие «координационный много- гранник», характеризующее пространственное расположение лиган- дов вокруг центрального атома в комплексах с координационными числами 4 и 6. Вернер также ввел запись формул с обозначением внутренней сферы квадратными скобками. Например, комплексное соединение K[AuCl4] включает в себя: K+ – ион внешней сферы; [AuCl4]– – внутренняя сфера; Au3+ – атом-комплексообразователь (ион-комплексообразователь); Cl– – лиганд; 4 – координационное число. Комплексами называют соединения, которые образовались при координировании одним атомом, называемым центральным, одного и более ионов или молекул-лигандов. Комплексы могут быть следующих типов: 1) катионные [Ag(NH3)2]+, [Cr(H2O)6]3+; 2) анионные [Ni(CN)4]2–, [Co(NO2)6]3–; катионно-анионные [Pt(NH3)4][PtCl4]; нейтральные [W(CO)6], [Pt(NH3)2Cl2]. Возражения против использования термина «комплексные соединения» основаны на том, что «комплексные» означает слож- ные, а сложными являются и некоторые соединения, которые не содержат металл (например, хингидрон – C6H4O2 C6H4(OH)2). По- этому считается, что комплексные соединения лучше называть ко- ординационными. Координационные соединения – соединения, которые существу- ют как в кристаллическом состоянии, так и в растворе. В большинстве случаев координационные соединения могут рассматриваться как со- стоящие из более простых, способных к самостоятельному существо- ванию молекул или ионов. Комплексные соединения, содержащие несколько атомов- комплексообразователей (ионов-комплексообразователей), называют полиядернымикомплексами. Например: K4[(C2O4)2Cr(OH)2Cr(C2O4)2] K4 (С2О4)2Сr Cr(C2O4)2 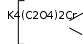 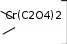 OH OH HO В химии довольно часто используют термин «аддукт». Редко его употребляют по отношению к комплексным соединениям. На- пример, аддукт пикриновой кислоты с нафтиламином HOC6H2(NO2)2 C10H7NH2. Комплексамииногда называют клатратные (включенные) со- единения, в которых молекулы одного компонента («гостя») вклю- чены в полости устойчивой структуры другого компонента («хозяи- на»). В таких соединениях взаимодействия определяют силы Ван- дер-Ваальса. Классические донорно-акцепторные связи возникают между цен- тральным атомом (ионом) – акцептором электронов и атомами лиган- дов – донорами электронных пар. Лиганды и комплексы с такими ко- ординационными связями характеризуются следующими понятиями: донорные атомы, дентатность, амбидентатность, топичность, коорди- национное число, координационный полиэдр. Многоатомные лиганды образуют связи с центральным атомом (ионом) с помощью атомов, которые донируют электронную пару и называются донорными. Дентатность– число донорных атомов лиганда. Количество донорных атомов, с помощью которых один лиганд связывается с центральным атомом, определяет его дентатность. На- пример: [Ni(NH3)6]2+ NH3 – монодентатный лиганд; [Ni(NH2CH2CH2NH2)3]2+ NH2CH2CH2NH2 – дидентатный (би- дентатный) лиганд. В некоторых молекулах лиганда бывает трудно определить их дентатность. Например, соль Цейзе – K[Pt(C2H4)Cl3]. Если считать, что платина образует связи с атомами углерода, то дентатность моле- кулы этилена равна двум, а если рассматривать комплекс как продукт замещения иона хлора (Cl–) на молекулу этилена, то ее дентатность равна единице. Амбидентатностьопределяет способность лигандов, содер- жащих два и более донорных атома, присоединяться к центрально- му атому (иону) разными способами (конкурентная координация). Например:      N C S N C S M N C S N C S MM    N C S N C SM M    C S C SM    M N C S M M N C S M M M   M N C S M N C SM M     N C S M M N C S M M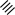 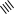 M M M M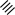   N C S N C SM M M 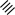    N C S M N C S MM      M M N C S M M M N C S MM Амбидентатность характерна для многих хелатообразующих ли- гандов. Топичность – количество донорных атомов (групп атомов), ко- торые не могут координироваться одним центром, но способны коор- динироваться разными центрами. Например:  Br BrH3C    N O N O Cu Cu  N O N OH3C CH3   N NM N CH3 Br М = Со, Ni, Cu, Zn В аминоазометиновом макроциклическом лиганде шесть донор- ных атомов не могут координироваться одним центром вследствие жесткой пространственной фиксации. Поэтому такой лиганд является дитопными образует биядерные координационные соединения. Координационное число (КЧ) – количество донорных атомов, с помощью которых лиганды непосредственно связаны с центральным атомом (координационные числа для разных комплексов обычно варьируются от 2 до 12). От координационного числа во многом зависит форма координа- ционного полиэдра. Координационный полиэдр – это геометрическая фигура (многогранник), определяющая пространственное расположе- ние донорных атомов лигандов вокруг центрального атома. Количест- во вершин полиэдра равно координационному числу комплекса. В некоторых случаях используют понятие координационная ем-кость(дентатность) лигандов. 3 Если лиганд полиатомный, то он может занять во внутренней сфере комплекса более одного координационного места. Например, в ком- плексном соединении [Cо(NH3)4CO3]Cl карбонат-ион CO 2– проявляет координационную емкость, равную двум, т. е. является бидентатным: NH 3  O O  O C Сo O O C Сo ONH 3 NH 3  Cl Cl NH 3 Аналогичная ситуация наблюдается в оксалатном комплексе:  O C O O C O O C O O C ONH3   Сo NH3 Сo NH3NH3 Cl NH3 В некоторых случаях бидентатный лиганд может входить в состав комплекса как монодентатный. В октаэдрических комплексах с разнородными лигандами часто различают два типа координационных мест. Например, в комплексе K2[VOF5] координационные места, занимаемые четырьмя лигандами Fэ, называют экваториальными, а координационное место, занимаемое лигандом Fа, – аксиальным. Эти термины чаще применяют по отно- шению к тригональным бипирамидам: О  Fэ Fэ Fэ FэFэ Fэ Fа Полидентатный лиганд может содержать электродонорные функциональные группы различного типа – кислотные и основные (таблица). Комплексы, образованные такими лигандами, называют комплексонами.Например, координационное соединение меди (II) с гликоколом:  O O C  H2C O H2C O    2 Cu NH2 CH  2 H2C NH O CH2 C  O Полидентатные органические лиганды играют важную роль в хи- мии. Одним из широко известных полидентатных лигандов является этилендиаминтетрауксусная кислота:  HOOC CH2 HOOC CH2HOOC CH2 NCH2CH2N CH2 COOH  CH2 COOH CH2 COOH 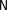     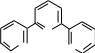 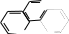 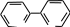     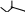 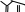 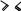       Некоторые O-, N- и S-лиганды Некоторые O-, N- и S-лиганды
1 2 | |||||||||||||||||||||||||||||||||||||||||||

