ashuiko_ximiya-kompleksnyx-soedinenii-4-19 (копия). Принадлежит Л. А. Чугаеву
 Скачать 111.67 Kb. Скачать 111.67 Kb.
|
1 2 NH2 NR2 NH2 CH3    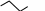  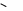   Окончание таблицы Окончание таблицы
NR2 NH2 H2N NR2 10 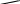    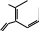  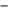 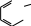  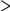  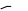     Приведенные в таблице лиганды наиболее часто встречаются в комплексных соединениях. Координационное число в комплексах с такими лигандами определяют донорные атомы, участвующие в обра- зовании связи. Приведенные в таблице лиганды наиболее часто встречаются в комплексных соединениях. Координационное число в комплексах с такими лигандами определяют донорные атомы, участвующие в обра- зовании связи. Ëåêöèÿ 2 ÍÎÌÅÍÊËÀÒÓÐÀ ÊÎÌÏËÅÊGÍÛÕ GÎÅÄÈÍÅÍÈÉ Номенклатуру комплексных соединений разрабатывает Между- народный союз теоретической и прикладной химии (IUPAC). Соглас- но разработанной номенклатуре, формулу комплекса записывают в квадратных скобках и первым ставят символ комплексообразователя. Затем пишут формулы анионных лигандов в алфавитном порядке, а за ними, также в алфавитном порядке, формулы катионных и нейтраль- ных лигандов. В конце указывают мостиковые лиганды (если они есть) в порядке возрастания мостиковой емкости (количества соеди- ненных через лиганд центральных атомов). Мостиковые лиганды обозначают греческой буквой µn, где n = 3, 4, … показывает количество соединенных центральных атомов, если их больше чем два. При составлении названия координационного соединения в запи- санной формуле сначала выделяют внутреннюю и внешнюю коорди- национные сферы. Комплекс заключают в квадратные скобки, его на- звание определяет центральный атом и лиганды, названия которых приводятся в алфавитном порядке перед названием центрального ато- ма. В начале перечисляют анионные лиганды, затем нейтральные (мо- лекулярные) (табл. 2.1). Названия нейтральных и катионных лигандов, как правило, не отличаются от названий соответствующих молекул и катионов. В названии комплексов лиганды пишутся в скобках, за ис- ключением лигандов: аква, амин, карбонил, нитрозил (NO+), которые приводятся в названии без скобок. Таблица 2.1 Рекомендованные названия анионных и нейтральных лигандов
Окончание табл. 2.1
Количество тех или иных лигандов в координационной сфере комплекса указывают префиксами ди-, три-, тетра- и т. д. В случае сложных лигандов или тех, что уже содержат в названии префиксы, применяют префиксы бис-, трис-, тетракис-, пентакис- и т. д. Назва- ния нейтральных комплексов пишут в одно слово. Например: [Pt(NH3)2Cl2] – дихлородиаминплатина(II); [Ni(CO)4] – тетракарбонилникель; [Co(NH3)5(SO4)]Cl – сульфатопентааминкобальт(III) хлорид; [Pt{P(CH3)3}2Cl2] – дихлоробис(триметилфосфин)платина(II). Степень окисления комплексообразователя указывают римскими цифрами в скобках. Традиционно в названиях катионных и нейтральных комплексов используют русские названия центральных атомов: железо, медь, пла- тина. Однако IUPAC рекомендует применять латинские названия цен- тральных атомов. Например: [Fe(H2O)6]2+ – гексаакваферрум(II)-ион, или гексаакважелезо(II)-ион; [Au{SC(NH2)2}2]+ – дитиокарбамидаурум(I)-ион, или дитиокарба- мидзолото(I)-ион. В названиях анионных комплексов вводят суффикс -ат, который добавляется к корню названия центрального атома. Например: [CuCl4]2– – тетрахлорокупрат(II)-ион; [Cu{OC(NH2)2}Cl3]– – трихлороди(карбомид)купрат(II)-ион; Na[Pd(NH3)BrCl(NO2)] – натрий бромонитрохлороаминпаладат(II); Li[Ti(bpy)3] – литий трис(бипиридин)титанат; (NH4)2[MoOS3] – аммоний тритиомолибдат(VI). Названия комплексных электролитов в соответствии с номенклату- рой IUPAC лучше давать в порядке записи формулы, т. е. первым на- звать катион, а затем анион, но можно и наоборот, т. е. первоначально указать анион, затем катион. Например: [Ir(py)4(NO2)2][Ag(NO2)2] – ди- нитротетрапиридиниридий(III) динитроаргентат(I). Комплексными могут быть кислоты и основания. В этом случае в названия кислот вводится слово кислота, а в название оснований – слово гидроксид. Например: H3[Fe(CN)6] – гексацианоферратная кислота, или гексацианоже- лезная кислота; H3[P(Mo3O10)4] – тетракис(тримолибдато)фосфатная кислота, или тетракис(тримолибдато)фосфорная кислота; [Zn(py)4](OH)2 – тетрапиридинцинк гидроксид; [Pt(en)2(CN)(NO2)](OH)2 – нитроцианобис(этилендиамин)пла- тина(IV) гидроксид. В названиях полиядерных комплексов первыми перечисляются мостиковые лиганды в порядке уменьшения мостиковой емкости (по- сле названия мостикового лиганда указывается мостиковый атом). Например: [{Pt(P(C3H7)3)2}2(SCN)2(µ-SCN)2] – ди-µ-тиоцианато-S-бис(тиоциа- нато(трипропилфосфин))платина(II):  N C N C  NCS NCS(C3H7)3P S     Pt Pt Pt Pt S C N S C NP(C3H7)3 SCN K4[{Co(C2O4)2}2(µ-OH)2] – калий ди-µ-гидроксотетраоксалато- хромат(III): K4 (С2О4)2Cr OH 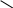  OH Cr(C2O4)2 OH Cr(C2O4)2[{Co(NH3)4}2(µ-NH2)(µ-OH)](NO3)4 – µ-амидо-µ-гидроксоокта- аминкобальта нитрат: (NH3)4Co NH2 OH Co(NH3)4 (NO3)4 Координационные соединения с лигандами, являющимися арома- тическими или ненасыщенными органическими молекулами, содержат в названиях греческую букву η с надстрочным числовым индексом, определяющим топологическую характеристику связей центрального атома с лигандом. Например: [Fe(η5-C5H5)2] – бис(η5-циклопентадиенил)железо; [Cr(η6-C6H6)2] – бис(η6-бензол)хром; [Mo(CO)3(η7-C7H7)]Cl – трикарбонил(η7-циклогептатриенилиум) молибден(I) хлорид. Сокращенные обозначения и названия некоторых лигандов при- ведены в табл. 2.2. Таблица 2.2 Сокращенные обозначения и названия распространенных лигандов
В специализированных справочниках приведены сокращенные обозначения и названия многих других лигандов. Сокращенные обо- значения позволяют записывать формулы координационных соедине- ний в сокращенной форме. Ëåêöèÿ 3 ÒÈÏÛ ÊÎÎÐÄÈÍÀÖÈÎÍÍÛÕ GÎÅÄÈÍÅÍÈÉ. ÊËÀGGÈÔÈÊÀÖÈß В классической химии координационных соединений выделяют три типа: координационные ацидосоединения, во внутренней сфере кото- рых содержатся только анионы; молекулярные координационные соединения, во внутренней сфере которых содержатся только лиганды в молекулярной форме; смешанные ацидо-молекулярные координационные соединения. Однако среди координационных соединений встречаются весьма специфические их типы. В основу классификации координационных соединений по соста- ву, строению координационной сферы (молекулярный уровень орга- низации) следует положить природу центрального атома и лигандов, характер связи между ними. Эти факторы в первую очередь опреде- ляют свойства соединений. Одноядерные соединения с положительной степенью окисле- ния центрального атома (как правило, характерной для него в солях этого атома). Ацидокомплексы – это комплексы, в которых лигандами являют- ся кислотные остатки. Их подразделяют: на комплексы, в которых лиганды, связанные с центральным атомом, являются идентичными, их называют гомолептичными. На- пример: K3[AlF6], Na3[Cr(NO2)6]; комплексы, в которых лиганды, связанные с центральным ато- мом, являются разными анионами, их называют гетеролептичными. Например: K3[Cr(NO2)3(CN)3], Na2[Be(NO2)F3]. Гидроксокомплексы – комплексы, в которых лигандами являются гидроксид-ионы. Например: K3[Al(OH)6], Na2[Zn(OH)4]. Соединения с нейтральными лигандами – комплексы, в которых лигандами являются молекулы аммиака, воды, диметилформамида, фосфинов, алифатические и ароматические амины и др. Например: [Cr(CO)6], [Al(H2O)6]Cl3. Полиядерные соединения – соединения, которые содер- жат два и более центральных атома, связанных между собой мостиковыми лигандами. Например: [{Co(NH3)4}2(µ-NH2)2](NO3)4, K4[{Co(C2O4)2}2(µ-OH)2]. Циклические соединения – соединения, в которых централь- ный атом и лиганд образуют цикл, называемый металлоциклом. Хелаты – соединения, в которых металл соединен с донорными атомами лиганда, образуя положительно заряженное циклическое со- единение. Например: [Pd(bpy)2]2+.  Внутрикомплексные соединения – нейтральные комплексы, обра- зованные полидентатными лигандами. Например, [Cu(NH2CH2COO)2] – комплекс меди (II) с глицином: Внутрикомплексные соединения – нейтральные комплексы, обра- зованные полидентатными лигандами. Например, [Cu(NH2CH2COO)2] – комплекс меди (II) с глицином:CH2 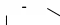 CH2 CH2  O C O CNH2 NH2 Cu O O C O CH2 NH2  [Cr(CH3COCHC(O)CH3)3] – комплекс хрома (III) с ацетилацетонатом: [Cr(CH3COCHC(O)CH3)3] – комплекс хрома (III) с ацетилацетонатом:  Н3С СН3 Н3С СН3H3C H3C О О  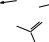 О Сr3+ О О О О Сr3+ О О ОCH3 CH3 Н ОН ОН НО Н R R R R R R 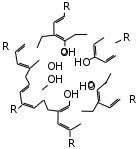 Макроциклическиесоединения– соединения, в которых лигандом является макроцикл. Например, макроциклические лиганды – поданды: Например, комплексы ионов металлов с фталоцианинами: 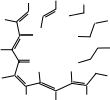 М Н М М Н ММ М   N N N N  Н Cu Н Н Cu НN N М М М Н М Полимакроциклическиесоединения– соединения, в которых ли- гандом является полимакроциклический лиганд. Кластеры – соединения со связями металл – металл в коорди- национной сфере. Например, ([Pt(NH3)4]2+[PtCl4]2–)nи др.: NH3 NH3 NH3 Cl Pt Pt NH3 Cl Cl NH3 Pt Cl NH3 NH3 Cl  Cl ClPt NH3 Cl Cl π-Комплексы – соединения, в которых лигандами являются мо- лекулы алкенов или алкинов (ацетиленовые комплексы распростране- ны реже, чем ацетиленовые или ароматические соединения):       + +OC  H3C As H3C AsMo    .......   CO CH CO CH CH2 H3C К числу π-комплексов, в которых лиганд донирует два электрона, относятся этиленовые и ацетиленовые комплексы Pt2+, Pd2+, Ag+ и др. Металлы образуют соединения с низшими олефинами в том случае, когда имеются лиганды π-донорного типа. Например, молекулы CO или C5H5. Металлы в таких соединениях, как правило, находятся в низшей степени окисления (+1, +2). В эту группу попадают π-комплексы с пятиэлектродонорными и шестиэлектродонорными ли- гандами: ферроцен – Fe(C5H5)2 и хромдибензол – Cr(C6H6)2. Соединения с нулевой или отрицательной степенью окис- ления центрального атома. Карбонилы – наиболее многочисленная группа (около двухсот соединений) таких комплексов: Fe(CO)5, Cr(CO)6. Большая часть карбонилов существует в виде кластеров, на- пример Mn2(CO)10. В эту же группу попадают смешанные комплексы: [Cr(C6H6)(CO)3], комплексы типа Na[Co(CO)4] и др. Соединения, в которых лигандами являются молекулы H2, N2 и O2. Малочисленная группа комплексных соединений. Координационные соединения с анионом в роли центра координации. Например, [Ag3I](NO3)2. Координационные соединения, сконструированные и синтезиро- ванные для создания современных материалов, лекарственных ве- ществ и т. д., очень разнообразны. Они являются предметом изучения супрамолекулярной координационной химии. В нанотехнологиях структурными элементами считаются наноча- стицы. Координационные соединения могут сами иметь размер нано- частицы или образовывать лишь функциональный слой на наночасти- це из какого-либо носителя. Материалами с нано- и макроскопиче- ским контролем структуры могут быть кристаллические координационные соединения и полимеры. Супрамолекулярные координационные соединения, в которых за основу взяты как способ координирования, так и их разномасштабная пространственная структура, можно разделить на следующие группы: координационные олигомеры; геликаты; топологически связанные координационные соединения; дендримеры; координационные полимеры; жидкие кристаллы; моно- и полимолекулярные пленки; координационные соединения на поверхности твердых тел. В координационной химии выделена целая группа хелатных со- единений – комплексонаты. Лиганды в них называются комплексо- нами и представляют собой сложные органические молекулы, содер- жащие несколько функциональных групп с донорными атомами. Классический пример комплексона – ЭДТА (натриевая соль этилен- диаминтетрауксусной кислоты). Пример комплексоната с пятью хе- латными циклами: Н2С СН2 Н2С Н2С |