параметры ковалентной связи. органика СРО1. Природа ковалентных связей. Атомные орбитали. Правило октетов. Формула Льюиса
 Скачать 258.39 Kb. Скачать 258.39 Kb.
|
|
МИНИСТЕРСТВО ОБРАЗОВАНИЯ И НАУКИ РЕСПУБЛИКИ КАЗАХСТАН ЕВРАЗИЙСКИЙ НАЦИОНАЛЬНЫЙ УНИВЕРСИТЕТ ИМЕНИ Л. Н. ГУМИЛЕВА Кафедра "Химия" Реферат Тема: «Природа ковалентных связей. Атомные орбитали. Правило октетов.Формула Льюиса». Исполняет: Қәнет Ә.А. Проверил: Арыстанова Ш.Е.  Оглавление1.Ковалентная связь 3 1.1.АТОМНЫЕ ОРБИТАЛИ 5 1.1.1.Орбитали атома водорода. 5 1.1.2. Размеры атомных орбиталей 8 2.Правило октета 8 3.Формулы Льюиса 9 3.1 Параметры ковалентной связи 10 3.1.1Длина химической связи 11 3.1.2Валентные углы 11 Энергия ковалентной связи 12 3.1.3Полярность ковалентной связи 13 1.Ковалентная связьКовалентная связь — это химическая связь, образованная общими (связывающими) электронными парами. Её называют локализованной, так как общая пара электронов размещается (локализуется) между двумя ядрами. Это заставляет положительно заряженные ядра притягиваться к паре электронов, расположенной между ядрами. Такая связь возникает между атомами с одинаковыми или близкими значениями электроотрицательности. Как правило, это атомы неметаллов. Появление пары электронов, связывающей соседние атомы, можно представить двумя способами, то есть существует два механизма образования ковалентной связи — обменный и донорно-акцепторный. Обменный механизм объясняет образование общей электронной пары из неспаренных валентных электронов, принадлежащих разным атомам. При этом электроны, образующие общую пару, должны иметь противоположные (антипараллельные) спины. Перекрывание двух электронных облаков приводит к увеличению электронной плотности между ядрами: 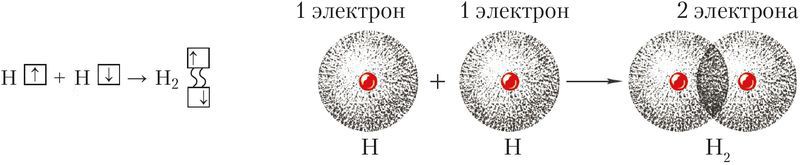 В образовании ковалентной связи могут участвовать s-, p- и d-электронные облака. Например, в связывании атомов хлора и водорода в молекуле H—Сl участвуют 1s-электрон атома водорода и неспаренный 3p-электрон атома хлора (рис. 2) 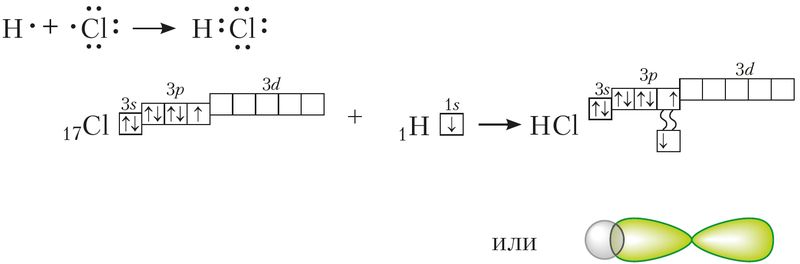 Каждый из связанных в общую электронную пару атомов приобретает электронную конфигурацию благородного газа: водород — гелия 1s2, а хлор — аргона 1s22s22р63s23р6. В результате оба атома достигают наиболее устойчивой электронной конфигурации. Ещё один пример — образование связей в молекуле аммиака NH3. У атома азота согласно электронно-графической схеме есть три неспаренных электрона: 7N у атома водорода— один Отметим, что одновременно с этим у азота на 2s-орбитали остаётся неподелённая электронная пара — пара электронов, не принимающая участия в образовании химических связей. Обменным механизмом объясняют образование ковалентной связи в подавляющем большинстве молекул органических и неорганических веществ, в атомных кристаллах алмаза C, красного фосфора P, карборунда SiC, кварца SiO2 и др. Донорно-акцепторный механизм образования ковалентной связи предполагает образование общей пары электронов за счёт передачи неподелённой электронной пары от одного атома (донора) на вакантную атомную орбиталь другого (акцептора). В качестве примера рассмотрим образование химической связи в катионе аммония или в ионном виде: Это взаимодействие можно представить электронными формулами: 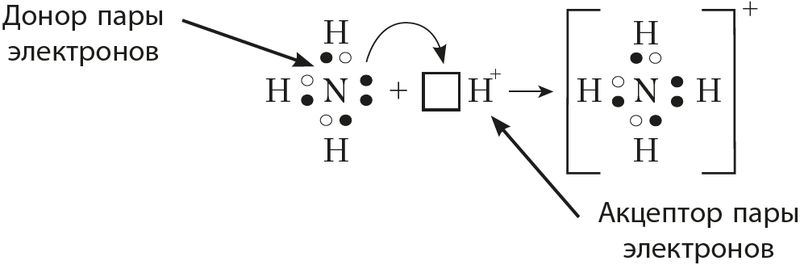 При взаимодействии молекулы 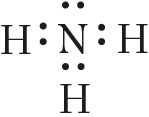 с катионом водорода с катионом водорода 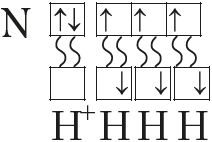 Так как молекула аммиака электронейтральна, а присоединённый к ней ион имеет заряд «+», то образовавшийся катион аммония также имеет положительный заряд. Этот заряд принадлежит целому иону, а не отдельному атому, поэтому в структурной формуле знак заряда иона ставят за квадратной скобкой: 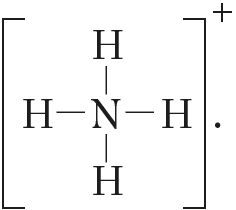 Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору: Если мы хотим подчеркнуть механизм образования связи, то можно стрелкой указать направление смещения электронной пары от донора к акцептору: 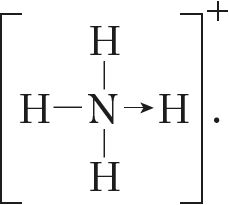 Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными. Но делать это необязательно, так как все связи в молекуле, независимо от механизма их образования, являются равноценными.Аналогичным образом можно представить образование химической связи в катионе гидроксония H3O+: в результате гидратации иона водорода в водных растворах неподелённая электронная пара атома кислорода в молекуле воды размещается на свободной 1s-орбитали иона водорода. 1.1.АТОМНЫЕ ОРБИТАЛИ1.1.1.Орбитали атома водорода.Когда рассматриваются волновые функции для электронов в отдельных атомах, эти функции называют атомными орбиталями (сокращенно АО). Экспериментальные доказательства существования атомных орбиталей можно получить из атомных спектров. Например, при электрическом разряде в газообразном водороде молекулы Н2 диссоциируют на атомы, а атомы испускают свет строго определенных частот, которые группируются сериями: в видимой области (так называемая серия Бальмера), ультрафиолетовой (серия Лаймана), инфракрасной (серия Пашена). Еще в доквантовый период было замечено, что все серии удовлетворяют одному простому уравнению 1/λ=R(1/n12-1/n22), в котором λ - длина волны испускаемого света, R - постоянная Ридберга, n1 и n2 - целые положительные числа. Для серии Лаймана n1=1, для серии Бальмера n1=2, для серии Пашена n1=3 (n1 относится к первой линии). Для других линий в каждой серии n2=n1+1 (для второй), n2=n1+2 (для третьей), n2=n1+3 (для четвертой) и т.д. Таким образом, налицо явный признак квантования частоты испускаемого света. Атом водорода трехмерен, поэтому уравнение Шредингера должно включать кинетическую энергию во всех трех измерениях и будет иметь несколько более сложный вид, чем представленное в разделе 1.1 этой главы уравнение для одномерного движения. При его решении с наложением граничных условий, которые вытекают из вероятностной интерпретации волновой функции, были получены следующие выводы. 1. Необходимо принять, что существуют три безразмерных квантовых числа, которые обозначают символами n, l и m. Появление квантового числа n вызвано тем, что электрон может менять свое расстояние от ядра. Квантовые числа l и m связаны с угловым моментом количества движения электрона, который может вращаться вокруг ядра в трех измерениях. Число l характеризует величину углового момента, а число m - ориентацию углового момента в пространстве, так как угловой момент - векторная величина. Допустимыми значениями квантовых чисел, которые вытекают из граничных l= 0, 1, 2 ... (n-1); m= l, (l-1), (l-2), ..., -l. 2.Энергия электрона, вообще говоря, должна зависеть от всех трех квантовых чисел, или, по крайней мере, от двух, однако уникальной особенностью атома водорода (но не других атомов) является то, что энергия электрона зависит только от n. По этой причине n называется главным квантовым числом. (Так, для n = 3 l может принимать значения 0, 1 и 2, но энергия электрона остается постоянной.) Разрешенными энергиями будут энергии, имеющие вид En = R/n2. Спектр атомарного водорода теперь можно объяснить, предположив, что, как только электрон переходит из состояния с главным квантовым числом n2 и энергией R/n22 в состояние с главным квантовым числом n1 и энергией R/n12,он излучает разность энергий в виде фотона с энергией hν и частотой ν. Согласно закону сохранения энергии, hν = R/n12-R/n22, что в точности соответствует экспериментальным наблюдениям. Атомные орбитали атома водорода имеют очень важное значение, так как они показывают, как распределен электрон (или электронная плотность) в пространстве. Амплитуда АО ψ(r) различна в разных местах пространства, а вероятность нахождения электрона в некоторой бесконечно малой области dτ вокруг точки r составляет [ψ(r)]2dτ. Пространственное распределение электрона можно изобразить путем указания величины [ψ(r)]2 с помощью разной плотности штриховки на диаграмме. Распределение плотности в некоторых АО водорода представлено на рис. 1.1 Орбиталь основного состояния атома водорода очень проста: она сферически симметрична и ее плотность экспоненциально спадает по мере удаления от ядра. Следовательно, наиболее вероятно найти электрон около ядра, где ψ и, таким образом, ψ2, максимальны. Это согласуется с представлением, что электрон для достижения наименьшей потенциальной энергии должен стремиться к ядру. Однако орбиталь не совсем «прижата» к ядру, а распространяется и на области, достаточно удаленные от него. Такая ситуация возникает вследствие того, что большое значение имеет не только потенциальная, но и кинетическая энергия электрона. Последнюю нельзя представить как кинетическую энергию движения по орбите вокруг ядра, которая приводит к появлению центробежной силы, удерживающей электрон вдали от ядра, поскольку угловой момент электрона в основном состоянии атома водорода равен нулю. (При n=1 может быть только одно квантовое число величины углового момента: l=0, и, следовательно, величина углового момента [l(l +1)]1/2ђ равна нулю.) Таким образом, в классическом понимании электрон в основном состоянии атома водорода как бы не вращается вокруг ядра, а просто качается вдоль радиуса. С этим и связана его кинетическая энергия. С точки зрения квантовой теории, кинетическая энергия электрона связана с длиной волны электрона, распространяющейся в радиальном направлении. Если орбиталь «поджимается» к ядру, длина волны в радиальном направлении неизбежно уменьшается, и поэтому кинетическая энергия возрастает (разд. 1.1). Реальная орбиталь является результатом компромисса между умеренно низкой потенциальной энергией и умеренно высокой кинетической энергией. Ближе к ядру электронная плотность выше, но она имеется и на удаленном от ядра расстоянии. 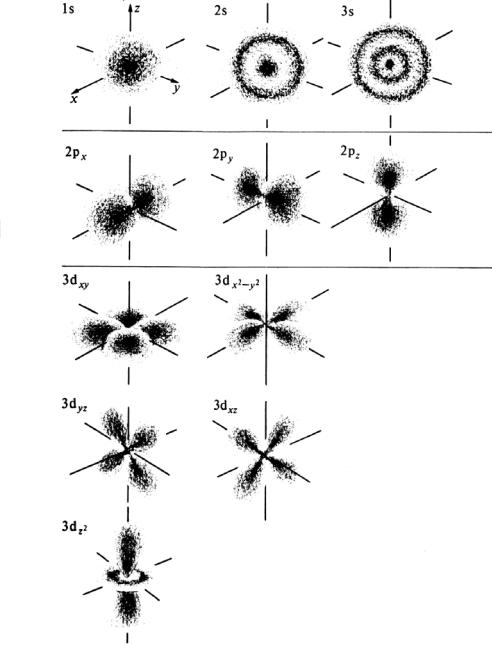 Рис. 1.1. Распределение плотности некоторых атомных орбиталей атома водорода в пространстве. Все орбитали с нулевым угловым моментом называются s-орбиталями. s- Орбиталь низшей энергии (n=1, l=0, m=0) называется 1s-орбиталью. Если n=2 и l=0, то это 2s-орбиталь. Ее энергия выше, чем энергия 1s-орбитали, по двум причинам. Во-первых, она имеет радиальный узел (рис. 1.2), представляющий собой сферическую поверхность, внутри и снаружи которой волновая функция имеет разные знаки, и на самой этой поверхности электронная плотность равна нулю. Появление узлов на любой орбитали повышает энергию электрона, занимающиего эту орбиталь, и чем больше узлов, тем энергия орбитали выше. 1.1.2. Размеры атомных орбиталейСкорость многих реакций органических соединений зависит от того, насколько эффективно взаимодействуют, т.е. перекрываются, молекулярные орбитали реагентов. Объемистые группы (например, трет-бутильная) препятствуют сближению реагентов, снижают степень взаимодействия орбиталей (иногда до нуля) и поэтому затрудняют реакцию. Для оценки стерических эффектов необходимо иметь представление о том, каковы размеры орбиталей и насколько далеко они распространены от ядра. Поскольку молекулярные орбитали получаются из атомных орбиталей (раздел 1.5), размеры атомных орбиталей играют решающую роль. Размеры атомных орбиталей определяют и то, что мы называем «размерами атома». Каковы, например, размеры атома водорода в его основном электронном состоянии? Можно рассуждать так: поскольку при удалении от ядра орбиталь спадает экспоненциально, атом бесконечно велик, так как амплитуда волновой функции (орбитали) достигает нуля лишь в пределе бесконечного расстояния от ядра. Эта точка зрения принципиально правильна, но вряд ли она приемлема для химии. Другая точка зрения состоит в том, чтобы считать за размер атома радиус, на котором наиболее вероятно найти электрон. Наиболее вероятным радиусом, при котором будет найден электрон, для 1s-орбитали является радиус Бора а0=0.53 Å (53 пм). Радиус наибольшей вероятности в случае 2 s-орбитали водорода имеет величину 2.76 Å (276 пм). Таким образом, с увеличением энергии атома, т.е. при его возбуждении, его размеры увеличиваются. По мере увеличения атомного номера (Z) элемента орбитали «поджимаются» к ядру и наиболее вероятный радиус будет равен 53 пм/Z, где Z - заряд ядра 2.Правило октетаПравило октета (октетная теория) — предложено Г. Н. Льюисом для объяснения причин образования ковалентных химических связей. Согласно этому правилу при образовании молекул атомы удовлетворяют свою потребность в достижении 8 электронной валентной оболочки, подобной электронной конфигурации благородных газов за счет попарного обобществления своих валентных электронов. По своей важности это фундаментальное открытие Льюиса стоит в одном ряду с такими открытиями, как Периодический закон элементов и теория строения органических соединений. Все примеры «невыполнения» правила октетов можно подразделить на следующие три группы: Сумма валентных электронов атомов, образующих молекулу, нечётна. Пример —молекула оксида азота NO В данном случае сумма валентных электронов атома азота (5) и кислорода (6) равна 11, поэтому в этой молекуле атом кислорода достигает восьмиэлектронной оболочки, а атом азота — нет. В данном случае изначально невозможно достижение обоими атомами восьмиэлектронной оболочки. Стремление атома азота заполнить свою электронную оболочку объясняет химическую реакционную способность этой молекулы. Молекула образуется за счет трехцентровых связей, например KI3. В этой молекуле анион иода связан с молекулой иода трехцентровой четырехэлектронной связью. Аналогичные трехцентровые, но двухэлектронные связи присутствуют в молекуле B2H6. В образовании химических связей принимают участие d-орбитали. В этом случае правило октетов (в пределе, то есть в случае участия всех пяти d-орбиталей) преобразуется в правило 18-электронов. Поскольку в целом ряде случаев участие d-орбиталей в образовании химических связей у некоторых элементов остается спорным вопросом, возникает иллюзия невыполнения правила октетов. Классическими примерами выполнения правила 18-электронов являются молекулы Fe(CO)5, Ni(CO)4, Co2(СО)8, Fe(C5H5)2 (ферроцен)и многие другие.Таким образом, главным в правиле октетов Льюиса является не число 8 (или 18), а обобщение электронов как основа образования ковалентной химической связи, и приближение за счет этого к электронной конфигурации инертного газа — восьмиэлектронной или восемнадцатиэлектронной. 3.Формулы ЛьюисаЛьюис предложил представлять атом в виде "остова" и внешних электронов; остов состоит из ядра и внутренних электронов и в ходе химических превращений остается без изменений. В химических реакциях участвуют внешние (валентные) электроны. Стабильной считается комбинация из восьми электронов. Исключение составляет водород – в нем два электрона. 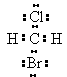 Свойства ковалентной связи Кратность ковалентной связи характеризуется количеством электронных пар между соединяемыми атомами. С увеличением кратности связи уменьшается ее длина и повышается суммарная прочность. 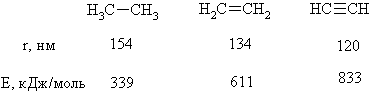 Как видно, Es > Ep Насыщаемость Каждый атом может образовать по обменному механизму такое количество связей, сколько неспаренных электронов он имеет на валентном уровне. Направленность Атомные орбитали имеют разную форму и различную ориентацию в пространстве. При образовании ковалентной связи может происходить гибридизация атомных орбиталей. Гибридизацией называется гипотетический процесс смешения различного типа, но близких по энергии атомных орбиталей атома с образованием того же числа новых (гибридных) орбиталей, одинаковых по форме и энергии.В органических молекулах наблюдается гибридизация трех видов: sp3, sp2, sp.Идея гибридизации атомных орбиталей позволяет наглядно объяснить структуру молекулы путем комбинации атомных орбиталей. Полярность Полярная ковалентная связь образуется между атомами разных элементов, отличающихся электроотрицательностью. Электронная плотность оказывается смещенной к более электроотрицательному элементу. Такие молекулы называются диполями. В двухатомных молекулах величина дипольного момента связи является мерой полярности молекул в целом. Для много атомных молекул дипольный момент равен векторной сумме дипольных моментов отдельных связей. mHCl = 1,0D , mH2O = 1,86D Поляризуемость Наряду с полярностью, ковалентная связь обладает способностью поляризоваться под влиянием внешних электромагнитных полей, что выражается в изменении ее дипольного момента и может быть причиной электролитической диссоциации. В качестве внешнего поля может выступать поле соседней молекулы или иона. Поляризуемость молекулы зависит от подвижности общей электронной пары и связана с поляризуемостью образующих ее атомов. Чем больше размер частицы и чем большим количеством электронов она обладает, тем выше поляризуемость (mHF = 1,5Д; mHJ = 0,4Д, но при этом в воде HJ диссоциирует легче, чем HF). 3.1 Параметры ковалентной связиСовокупность атомов, образующих химическую частицу, существенно отличается от совокупности свободных атомов. Образование химической связи приводит, в частности, к изменению радиусов атомов и их энергии. Происходит также перераспределение электронной плотности: повышается вероятность нахождения электронов в пространстве между связываемыми атомами. 3.1.1Длина химической связиПри образовании химической связи всегда происходит сближение атомов - расстояние между ними меньше, чем сумма радиусов изолированных атомов: r(A−B) < r(A) + r(B) Радиус атома водорода составляет 53 пм, атома фтора − 71 пм, а расстояние между ядрами атомов в молекуле HF равно 92 пм: 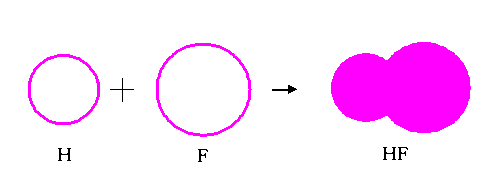 Межъядерное расстояние между химически связанными атомами называется длиной химической связи. Во многих случаях длину связи между атомами в молекуле вещества можно предсказать, зная расстояния между этими атомами в других химических веществах. Длина связи между атомами углерода в алмазе равна 154 пм, между атомами галогена в молекуле хлора - 199 пм. Полусумма расстояний между атомами углерода и хлора, рассчитанная из этих данных, составляет 177 пм, что совпадает с экспериментально измеренной длиной связи в молекуле CCl4. В то же время это выполняется не всегда. Например, расстояние между атомами водорода и брома в двухатомных молекулах составляет 74 и 228 пм, соответственно. Среднее арифметическое этих чисел составляет 151 пм, однако реальное расстояние между атомами в молекуле бромоводорода равно 141 пм, то есть заметно меньше. Расстояние между атомами существенно уменьшается при образовании кратных связей. Чем выше кратность связи, тем короче межатомное расстояние. Длины некоторых простых и кратных связей
3.1.2Валентные углыНаправление ковалентных связей характеризуется валентными углами - между линиями, соединяющими связываемые атомы. Графическая формула химической частицы не несет информации о валентных углах. Например, в сульфат-ионе SO42− валентные углы между связями сера−кислород равны 109,5o, а в тетрахлоропалладат-ионе [PdCl4]2− − 90o. Совокупность длин связей и валентных углов в химической частице определяет ее пространственное строение. Для определения валентных углов используют экспериментальные методы изучения структуры химических соединений. Оценить значения валентных углов можно теоретически, исходя из электронного строения химической частицы. Энергия ковалентной связиХимическое соединение образуется из отдельных атомов только в том случае, если это энергетически выгодно. Если силы притяжения преобладают над силами отталкивания, потенциальная энергия взаимодействующих атомов понижается, в противном случае − повышается. На некотором расстоянии (равном длине связи r0) эта энергия минимальна. 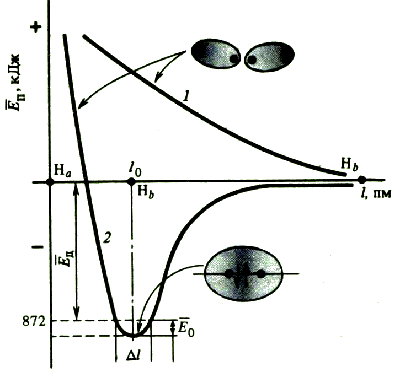 Таким образом, при образовании химической связи энергия выделяется, при ее разрыве − поглощается. Энергия E0, необходимая для того, чтобы разъединить атомы и удалить их друг от друга на расстояние, на котором они не взаимодействуют, называется энергией связи. Для двухатомных молекул энергия связи определяется как энергия диссоциации молекулы на атомы. Она может быть измерена экспериментально. В молекуле водорода энергия связи численно равна энергии, которая выделяется при образовании молекулы Н2 из атомов Н: Н + Н = Н2 + 432 кДж Эту же энергию нужно затратить, чтобы разорвать связь Н-Н: H2 = H + H − 432 кДж Для многоатомных молекул эта величина является условной и отвечает энергии такого процесса, при котором данная химическая связь исчезает, а все остальные остаются без изменения. При наличии нескольких одинаковых связей (например, для молекулы воды, содержащей две связи кислород−водород) их энергию можно рассчитать, используя закон Гесса. Величины энергии распада воды на простые вещества, а также энергии диссоциации водорода и кислорода на атомы известны: 2Н2О = 2Н2 + О2; 484 кДж/моль Н2 = 2Н; 432 кДж/моль О2 = 2О; 494 кДж/моль Учитывая, что в двух молекулах воды содержится 4 связи, энергия связи кислород-водород равна: Е(О−Н) = (2 . 432 + 494 + 484) / 4 = 460,5 кДж/моль В молекулах состава ABn последовательный отрыв атомов В сопровождается определенными (не всегда одинаковыми) затратами энергии. Например, значения энергии (кДж/моль) последовательного отщепления атомов водорода от молекулы метана существенно различаются: При этом энергия связи А−В определяется как средняя величина затраченной энергии на всех стадиях: СН4 = С + 4Н; 1649 кДж/моль Е(С−Н) = 1649 / 4 = 412 кДж/моль Чем выше энергия химической связи, тем прочнее связь. Связь считается прочной, или сильной, если ее энергия превышает 500 кДж/моль (например, 942 кДж/моль для N2), слабой - если ее энергия меньше 100 кДж/моль (например, 69 кДж/моль для NO2). Если при взаимодействии атомов выделяется энергия менее 15 кДж/моль, то считают, что химическая связь не образуется, а наблюдается межмолекулярное взаимодействие (например, 2 кДж/моль для Xe2). Прочность связи обычно уменьшается с увеличением ее длины.
Одинарная связь всегда слабее, чем кратные связи - двойная и тройная - между теми же атомами. Энергии некоторых простых и кратных связей
3.1.3Полярность ковалентной связиПолярность химической связи зависит от разности электроотрицательностей связываемых атомов. Электроотрицательность − условная величина, характеризующая способность атома в молекуле притягивать электроны. Если в двухатомной молекуле А−В образующие связь электроны притягиваются к атому В сильнее, чем к атому А, то атом В считается более электроотрицательным. Шкала электроотрицательности была использована Л. Полингом для количественной характеристики способности атомов к поляризации ковалентных связей. Для количественного описания электроотрицательности, помимо термохимических данных, используют также данные о геометрии молекул (метод Сандерсона) или спектральные характеристики (метод Горди). Широко используют также шкалу Олреда и Рохова, в которой при расчете используют эффективный заряд ядра и атомный ковалентный радиус. Наиболее ясный физический смысл имеет метод, предложенный американским физикохимиком Р. Малликеном (1896-1986). Он определил электроотрицательность атома как полусумму его сродства к электрону и потенциала ионизации. Значения электроотрицательности, базирующиеся на методе Малликена и распространенные на широкий круг разнообразных объектов, называют абсолютными. Самое высокое значение электроотрицательности имеет фтор. Наименее электроотрицательный элемент - цезий. Чем выше значение разности электроотрицательностей двух атомов, тем более полярной является химическая связь между ними. В зависимости от того, как происходит перераспределение электронной плотности при образовании химической связи, различают несколько ее типов. Предельный случай поляризации химической связи - полный переход электрона от одного атома к другому. При этом образуются два иона, между которыми возникает ионная связь. Для того чтобы два атома смогли создать ионную связь, необходимо, чтобы их электроотрицательности очень сильно различались. Если электроотрицательности атомов равны (при образовании молекул из одинаковых атомов), связь называют неполярной ковалентной. Чаще всего встречается полярная ковалентная связь - она образуется между любыми атомами, имеющими разные значения электроотрицательности. Количественной оценкой полярности ("ионности") связи могут служить эффективные заряды атомов. Эффективный заряд атома характеризует разность между числом электронов, принадлежащих данному атому в химическом соединении, и числом электронов свободного атома. Атом более электроотрицательного элемента притягивает электроны сильнее. Поэтому электроны оказываются ближе к нему, и он получает некоторый отрицательный заряд, который называют и эффективным, а у его партнера появляется такой же положительный заряд. Если электроны, образующие связь между атомами, принадлежат им в равной степени, эффективные заряды равны нулю. В ионных соединениях эффективные заряды должны совпадать с зарядами ионов. А для всех других частиц они имеют промежуточные значения. Лучший метод оценки зарядов атомов в молекуле - решение волнового уравнения. Однако это возможно лишь при наличии малого числа атомов. Качественно распределение заряда можно оценить по шкале электроотрицательности. Используют также различные экспериментальные методы. Для двухатомных молекул охарактеризовать полярность связи и определить эффективные заряды атомов можно на основе измерения дипольного момента: μ = q r, где q − заряд полюса диполя, равный для двухатомной молекулы эффективному заряду, r − межъядерное расстояние. Дипольный момент связи является векторной величиной. Он направлен от положительно заряженной части молекулы к ее отрицательной части. На основании измерения дипольного момента было установлено, что в молекуле хлороводорода HCl на атоме водорода имеется положительный заряд +0,2 доли заряда электрона, а на атоме хлора отрицательный заряд −0,2. Значит, связь H−Cl на 20% имеет ионный характер. А связь Na−Cl является ионной на 90%. Литература 1.С.С.Бацанов, Ж.неорган.хим., 2, 1482 (1957) 4.2 P.A.Madden, M.Wilson, Chem.Soc.Rev., 25, 339 (1996) 13 M.Gussoni, C.Castiglioni, G.Zerbi, Chem.Phys.Lett., 95,483 (1983); B.Galabov, T.DuIev, S.Ilieva, Spectrochim.Acta, A51, 739 (1995) 4 РЛ.Баринский, Ж.структ.хим., 1,200 (1960) 5 С.С.Бацанов, Усп.хим., 51,1201 (1982) 6 A.Wagner, S.Gundel, J.Geurts, e al., J.Cryst.Growth, 184/185,1067 (1998) 7 C.Julien, M.Eddrief, I.Samaras, M.Balkanski, Mater.Sci.Engin., 815,70(1992) |
