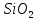огнеупоры. Производство карбида кремния
 Скачать 246.65 Kb. Скачать 246.65 Kb.
|
|
Министерство науки и высшего образования РФ Федеральное государственное бюджетное образовательное учреждение высшего образования «Сибирский государственный индустриальный университет» Кафедра металлургии цветных металлов и химической технологии Реферат На тему: «Производство карбида кремния» Выполнил: обучающийся гр.МХТ-18, Водолазова К.А Проверил: к.т.н Ноздрин И.В Новокузнецк, 2022 г. Содержани Министерство науки и высшего образования РФ 1 Введение 4 1.Основные свойства карбида кремния и его соединения 5 1.1 Физические свойства 8 1.2 Химические свойства 9 1.3 Применение карбида кремния 10 2.Производство карбида кремния 17 Заключение 24 Список используемой литературы 25 Введение 3 1. Основные свойства карбида кремния и его соединения 4 1.1 Физические свойства 7 1.2 Химические свойства 8 1.3 Применение карбида кремния 9 2. Производство карбида кремния 16 Заключение 23 Список используемой литературы 24 ВведениеКарби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. Химическая формула SiC. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, в микроэлектронике (в силовых установках электроавтомобилей), для имитирующих алмазвставок в ювелирные украшения. Исторически первым способом использования карбида кремния было использование в качестве абразива. За этим последовало применение и в электронных устройствах. В начале XX века карбид кремния использовался в качестве детектора в первых радиоприемниках. В 1907 году Генри Джозеф Раунд создал первый светодиод, подавая напряжение на кристаллы SiC и наблюдая за жёлтым, зелёным и оранжевым излучением на катоде. Эти эксперименты были повторены О. В. Лосевымв СССР в 1923 году[1]. Целью работы является изучить производство карбида кремния для достижения которой изучила следующие задачи: 1 Основные свойства карбида кремния и его соединения, области применения, 2 Способы получения карбида кремния и его соединений, Производства карбида кремния. Основные свойства карбида кремния и его соединенияИзвестно примерно 250 кристаллических форм карбида кремния[1]. Полиморфизм SiC характеризуется большим количеством схожих кристаллических структур, называемых политипами. Они являются вариациями одного и того же химического соединения, которые идентичны в двух измерениях, но отличаются в третьем. Таким образом, их можно рассматривать как слои, сложенные в стопку в определённой последовательности[1]. На рисунке 1 представлен альфа-карбид кремния(α-SiC).  Рисунок 1 – Альфа-карбид кремния(α-SiC) Альфа-карбид кремния (α-SiC) является наиболее часто встречающимся полиморфом. Эта модификация образуется при температуре свыше 1700 °C и имеет гексагональную решётку, кристаллическая структура типа вюрцита. На рисунке 2 представлена бета-модификация (β-SiC).  Рисунок 2 – Бета-модификация (β-SiC) Бета-модификация (β-SiC), с кристаллической структурой типа цинковой обманки (аналог структуры алмаза), образуется при температурах ниже 1700 °C[2]. До недавнего времени бета-форма имела сравнительно небольшое коммерческое использование, однако в настоящее время в связи с использованием его в качестве гетерогенных катализаторов интерес к ней увеличивается. Нагревание бета-формы до температур свыше 1700 °C способно приводить к постепенному переходу кубической бета-формы в гексагональную (2Н, 4Н, 6Н, 8Н) и ромбичеcкую (15R).[2] При повышении температуры и времени процесса все образующиеся формы переходят в конечном итоге в гексагональный альфа-политип 6Н.[2] Чистый карбид кремния бесцветен. Его оттенки от коричневого до чёрного цвета связаны с примесями железа. Радужный блеск кристаллов обусловливается тем, что при контакте с воздухом на их поверхности образуется плёнка из диоксида кремния, что приводит к пассивированию внешнего слоя. На рисунке 3 представлен карбид кремния 4H-SiC.  Рисунок 3 – 4H-SiC Карбид кремния является весьма инертным химическим веществом: практически не взаимодействует с большинством кислот, кроме концентрированных фтористоводородной (плавиковой), азотной и ортофосфорной кислот.Способен выдерживать нагревание на открытом воздухе до температур порядка 1500 °C. Карбид кремния не плавится при любом известном давлении, но способен сублимировать при температурах свыше 1700 °C. Высокая термическая устойчивость карбида кремния делает его пригодным для создания подшипников и частей оборудования для высокотемпературных печей. Существует большой интерес в использовании данного вещества в качестве полупроводникового материала в электронике, где высокая теплопроводность, высокое электрическое напряжение пробоя и высокая плотность электрического тока делают его перспективным материалом для высокомощных устройств[2], в том числе при создании сверхмощных светодиодов. Карбид кремния имеет очень низкий коэффициент теплового расширения (4,0⋅10−6K) и в достаточно широком температурном диапазоне эксплуатации он не испытывает фазовых переходов (в том числе фазовых переходов второго рода), из-за которых может произойти разрушение монокристаллов. Таблица 1 – Свойства основных политипов карбида кремния
1.1 Физические свойстваКарбид кремния является твердым, тугоплавким веществом. Кристаллическая решётка аналогична решётке алмаза. Является полупроводником.[3] Стандартная энтальпия образования (298 К, кДж/моль): −66,1 Стандартная энергия Гиббса образования (298 К, кДж/моль): −63,7 Стандартная энтропия образования (298 К, Дж/моль·K): 16,61 Стандартная мольная теплоемкость (298 К, Дж/моль·K): 26,86 Характер кристаллической решётки: атомный. Энергия кристаллической решётки: 299 ккал/г·форм 1.2 Химические свойстваКарбид кремния является единственным бинарным соединением, образуемым элементами IV группы Периодической таблицы элементов Д. И. Менделеева. По типу химической связи карбид кремния относится к ковалентным кристаллам. Доля ионной связи, обусловленной некоторым различием в электроотрицательностях атомов Si и C, не превышает 10—12 %. Энергия ковалентной связи между атомами кремния и углерода в кристаллах SiC почти в три раза превышает энергию связи между атомами в кристаллах кремния. Благодаря сильным химическим связям карбид кремния выделяется среди других материалов высокой химической и радиационной стойкостью, температурной стабильностью физических свойств, большой механической прочностью и высокой твердостью. В инертной атмосфере карбид кремния разлагается только при очень высокой температуре:  (1) (1)Сильно перегретый пар разлагает карбид кремния:  (2) (2)Концентрированные кислоты и их смеси растворяют карбид кремния:  (3) (3) (4) (4)В присутствии кислорода щёлочи растворяют карбид кремния:  (5) (5)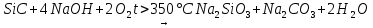 (6) (6)При нагревании реагирует с кислородом:  (7) (7)с галогенами:  (8) (8)с азотом, образуя нитрид кремния:  (9) (9)с активными металлами:  (10) (10)и их пероксидами:  (11) (11)1.3 Применение карбида кремнияВ современной гранильной мастерской карбид кремния является популярным абразивом из-за его прочности и низкой стоимости. В обрабатывающей промышленности из-за его высокой твердости он используется в абразивной обработке в таких процессах как шлифование, хонингование, водоструйная резка и пескоструйная обработка. Частицы карбида кремния ламинируются на бумагу для создания шлифовальной шкурки[3]. Суспензии мелкодисперсных порошков карбида кремния в масле, глицерине или этиленгликоле используются в процессе проволочной резки полупроводниковых монокристаллов на пластины. В 1982 году случайно был обнаружен композит, состоящий из оксида алюминия и карбида кремния, кристаллы которого растут в виде очень тонких нитей [3]. Карбид кремния наряду с карбидом вольфрама и другими износостойкими материалами применяется для создания торцевых механических уплотнений. В 1980-х и 1990-х годах карбид кремния исследовался в нескольких научно-исследовательских программах разработки высокотемпературных газовых турбин в США, Японии и Европе. Планировалось, что разработанные компоненты из карбида кремния заменят рабочие и сопловые лопатки турбин из никелевых жаропрочных сплавов. Тем не менее, ни один из этих проектов не привёл к промышленному производству, в основном из-за низкого сопротивления ударным нагрузкам и низкой вязкости разрушения карбида кремния[3]. Подобно другим высокотвердым керамическим материалам (оксид алюминия и карбид бора), карбид кремния используется как компонент композитной брони, применяемой для защиты вооружения и военной техники, а также в виде составного элемента слоистой брони керамика/органопластик противопульных жилетов. В бронежилете «Шкура дракона», созданном компанией PinnacleArmor, используются диски из карбида кремния[3]. Инфильтрованый кремний в материале «композит углерод-углерод» используется для производства высококачественных «керамических» дисковых тормозов, так как способен выдерживать экстремальные температуры. Кремний вступает в реакцию с графитом в «композите углерод-углерод», становясь армированным углеродным волокном карбида кремния (C/SiC). Диски из этого материала используются на некоторых спортивных автомобилях, в том числе PorscheCarrera GT, BugattiVeyron, ChevroletCorvette ZR1, Bentley, Ferrari, Lamborghini. Карбид кремния используется также в спечённых формах в дизельных фильтрах для очистки от твердых частиц. Электроника и электротехника. Первыми электрическими устройствами из SiC были нелинейные элементы варисторы и вентильные разрядники (см. также: тирит, вилит, лэтин, силит) для защиты электроустановок от перенапряжений. Карбид кремния в разрядниках применяется в виде материала вилита — смеси SiC и связующего. Варистор обладает высоким сопротивлением до тех пор, пока напряжение на нём не достигнет определённого порогового значения VT, после чего его сопротивление падает до более низкого уровня и поддерживает это значение, пока приложенное напряжение не упадёт ниже VT[4]. Светодиод. Карбид кремния используется в сверхбыстрых высоковольтных диодах Шоттки, n-МОП транзисторах и в высокотемпературных тиристорах[4]. По сравнению с приборами на основе кремния и арсенида галлия приборы из карбида кремния имеют следующие преимущества: -в несколько раз большая ширина запрещённой зоны; -в 10 раз большая электрическая прочность; -высокие допустимые рабочие температуры (до 600 °C); -теплопроводность в 3 раза больше, чем у кремния, и почти в 10 раз больше, чем у арсенида галлия; -устойчивость к воздействию радиации; -стабильность электрических характеристик при изменении температуры и отсутствие дрейфа параметров во времени. Из почти двухсот пятидесяти модификаций карбида кремния только две применяются в полупроводниковых приборах — 4H-SiC и 6H-SiC. Проблемы с интерфейсом элементов, основанных на диоксиде кремния, препятствуют развитию n-МОП транзисторов и IGBT, основанных на карбидокремнии. Другая проблема заключается в том, что сам SiC пробивается при высоких электрических полях в связи с образованием цепочек дефектов упаковки, но эта проблема может быть решена совсем скоро[4]. История светодиодов из SiC весьма примечательна: впервые свечение в SiC было обнаружено Х. Роундом в 1907 году. Первые коммерческие светодиоды были также на основе карбида кремния. Жёлтые светодиоды из 3C-SiC были изготовлены в СССР в 1970-х годах, а синие (из 6H-SiC), по всему миру — в 1980-х. Производство вскоре остановилось, потому что нитрид галлия показал в 10—100 раз более яркую эмиссию. Эта разница в эффективности связана с неблагоприятной непрямой запрещённой зоной SiC, в то время как нитрид галлия имеет прямую запрещённую зону, которая способствует увеличению интенсивности свечения. Тем не менее, SiC по-прежнему является одним из важных компонентов светодиодов — это популярная подложка для выращивания устройств из нитрида галлия, также он служит теплораспределителем в мощных светодиодах[4]. Астрономия и точная оптика. Жесткость, высокая теплопроводность и низкий коэффициент теплового расширения делают карбид кремния термостабильным материалом в широком диапазоне рабочих температур. Это обуславливает широкое применение карбидкремниевых матриц для изготовления зеркальных элементов в различных оптических системах, например в астрономических телескопах или в системах передачи энергии с использованием лазерного излучения. Развитие технологий (химическое осаждение паров) позволяет создавать диски из поликристаллического карбида кремния до 3,5 метров в диаметре. Заготовки зеркал могут формироваться различными методами, включая прессование чистого мелкого порошка карбида кремния под высоким давлением. Несколько телескопов, например Gaia, уже оснащены оптикой из карбида кремния, покрытого серебром. Пирометрия. Изображения теста пирометрии. Высота пламени 7 см Волокна из карбида кремния используются для измерения температуры газов оптическим методом, называемым тонкой пирометрией накаливания. При измерении тонкие нити (диаметр 15 мкм) из карбида кремния вводят в зону измерения. Волокна практически не влияют на процесс горения, а их температура близка к температуре пламени. Таким методом может быть измерена температура в диапазоне 800—2500 K[4]. Нагревательные элементы. Первые упоминания об использовании карбида кремния для изготовления нагревательных элементов относятся к началу 20 века, когда они были изготовлены TheCarborundumCompany в США и EKL в Берлине[источник не указан 2819 дней]. В настоящее время карбид кремния является одним из типичных материалов для изготовления нагревательных элементов, способных работать при температурах до 1400 °C на воздухе и до 2000 °C в нейтральной или восстановительной среде[источник не указан 2819 дней], что заметно выше, чем доступно для многих металлических нагревателей[источник не указан 2819 дней]. Нагревательные элементы из карбида кремния используются при плавлении цветных металлов и стекла, при термической обработке металлов, флоат-стекла, при производстве керамики, электронных компонентов и т.д. Ядерная энергетика. Благодаря высокой устойчивости к воздействию внешних неблагоприятных факторов, включая природные, высокой прочности и твердости, низкому коэффициенту термического расширения и низкому коэффициенту диффузии примесей и продуктов деления реакционноспечённый карбид кремния нашёл применение в ядерной энергетике[4]. Карбид кремния, наряду с другими материалами, используется в качестве слоя из триструктурально-изотропного покрытия для элементов ядерного топлива в высокотемпературных реакторах, в том числе в газоохлаждаемых реакторах. Из карбида кремния изготавливаются пеналы для длительного хранения и захоронения ядерных отходов. Ювелирные изделия. Как ювелирный камень карбид кремния используется в ювелирном деле: называется «синтетический муассанит» или просто «муассанит». Муассанит похож на алмаз: он прозрачен и тверд (9—9,5 по шкале Мооса, по сравнению с 10 для алмаза), с показателем преломления 2,65—2,69 (по сравнению с 2,42 для алмаза). Муассанит имеет несколько более сложную структуру, чем обычный кубический диоксид циркония. В отличие от алмаза, муассанит может иметь сильное двулучепреломление. Это качество является желательным в некоторых оптических конструкциях, но только не в драгоценных камнях. По этой причине муассанитовые драгоценности разрезают вдоль оптической оси кристалла, чтобы свести к минимуму эффект двупреломления. Муассанит имеет более низкую плотность 3,21 г/см³ (против 3,53 г/см³ для алмаза) и гораздо более устойчив к теплу. В результате получается камень с большим блеском минерала, с четкими гранями и хорошей устойчивостью к внешним воздействиям. В отличие от алмаза, который горит при температуре 800 °C, муассанит остаётся неповреждённым вплоть до температуры в 1800 °C (для сравнения: 1064 °C — температура плавления чистого золота). Муассанит стал популярен как заменитель алмаза, и может быть ошибочно принят за алмаз, так как его теплопроводность гораздо ближе к алмазу, чем у любого другого заменителя бриллианта. Драгоценный камень можно отличить от алмаза с помощью его двулучепреломления и очень небольшой зелёной или жёлтой флуоресценции в ультрафиолетовом свете[4]. Производство стали. Карбид кремния выступает в качестве топлива для изготовления стали в конвертерном производстве. Он чище, чем уголь, что позволяет сократить отходы производства. Также может быть использован для повышения температуры и регулирования содержания углерода. Использование карбида кремния стоит меньше и позволяет производить чистую сталь из-за низкого уровня содержания микроэлементов, по сравнению с ферросилицием и сочетанием с углеродом[4]. Катализатор. Естественная резистентность карбида кремния к окислению, а также открытие новых путей синтеза кубической формы β-SiC с большей площадью поверхности, приводит к большому интересу в использовании его в качестве гетерогенного катализатора. Эта форма уже использовалась в качестве катализатора при окислении углеводородов, таких как н-бутан, малеиновый ангидрид[4]. Производство графена. Карбид кремния используется для производства графена с помощью графитизации при высоких температурах. Это производство рассматривается как один из перспективных методов синтеза графена в больших масштабах для практических применений. Высокая температура (2830 °C, как выше указано в реакции) приводит к разложению карбида кремния. Кремний как более летучий элемент уходит из приповерхностных слоёв, оставляя моно- или полислойныйграфен, нижние из которых сильно связаны с объёмным кристалом. В качестве исходного материала используют монокристаллы 6H-SiC(0001), на поверхности которых формировались террасы графена в результате термообработки с размерами около 1 микрона, разделённые областями с несколькими слоями[4]. Применение в строительстве. Может использоваться в качестве фибры в фибробетоне (аналогично базальтовому волокну)[4]. Производство карбида кремнияИз-за редкости нахождения в природе муассанита карбид кремния, как правило, имеет искусственное происхождение. Простейшим способом производства является спекание кремнезёма с углеродом в графитовой электропечи Ачесона при высокой температуре 1600—2500 °C:  (12) (12)Чистота карбида кремния, образующегося в печи Ачесона, зависит от расстояния до графитового резистора в ТЭНе. Кристаллы высокой чистоты бесцветного, бледно-жёлтого и зелёного цвета находятся ближе всего к резистору. На большем расстоянии от резистора цвет изменяется на синий или чёрный из-за примесей. Загрязнителями чаще всего являются азот и алюминий, они влияют на электропроводность полученного материала[5]. Кристаллы карбида кремния, полученные благодаря процессу Лели[en] Чистый карбид кремния можно получить с помощью так называемого процесса Лели[en], в котором порошкообразный SiC возгоняется в атмосфере аргона при 2500 °C и осаждается на более холодной подложке в виде чешуйчатых монокристаллов размерами до 2×2 см. Этот процесс даёт высококачественные монокристаллы, получающиеся из-за быстрого нагрева до высоких температур и в основном состоящие из 6H-SiC фазы. Улучшенный процесс Лели при участии индукционного нагрева в графитовых тиглях даёт ещё большие монокристаллы до 10 см в диаметре. КубическийSiC, как правило, выращивается с помощью более дорогостоящего процесса — химического осаждения паров[6]. Чистый карбид кремния также может быть получен путём термического разложения полимера полиметилсилана (SiCH3)n, в атмосфере инертного газа при низких температурах. Относительно CVD-процесса метод пиролиза более удобен, поскольку из полимера можно сформировать изделие любой формы перед запеканием в керамику[6]. Карбид кремния (карборунд) широко применяется в качестве искусственного абразивного материала с высокой микротвердостью. Абразивныйинструмент, изготовленный из карбида кремния (SiС), используют в металлообрабатывающей и металлургической промышленности для зачистки металлопродукции. Высокая термическая и химическая стойкость позволяет использовать его для изготовления огнеупоров. В сочетании с алюмосиликатными волокнами SiC, SiO2 входят в состав композиционных материалов[7]. В электрометаллургии кремния и кремнистых ферросплавов карборунд представляет интерес как промежуточный продукт в сложном физико-химическом процессе выплавки кремния технической чистоты, силикокальция, ферросилиция, силикоалюминия и др. В природе карбид кремния встречается в виде муасса-нита (SiC), который обнаружен в Иркутской области в 1956г. и в песках Днепровско-Донецкой впадины в 1965г. Искусственный карбид кремния получают восстановлением SiО2 углеродом. Процесс в общем виде может быть представлен реакцией: SiО2 + 3С = SiС + 2СO; ∆G = 555615 – 322,11Т.(13) Условие ∆G = 0 при рСО 100 кПа соблюдается при 1725 K. Плотность SiС равна 3,22 г/см3, температура разложения 2880 K, теплота образования ∆Н= 66,16 кДж/моль. Различают черный и зеленый карбокорунд. Оба вида промышленного продукта получают в электрических печах, в которых рабочим сопротивлением является слойкокса (так называемый керн), а также непосредственно шихта, состоящая из углеродистого восстановителя и кварцевого песка. Дляполучения зеленого карбида кремния в шихту добавляют хлорид натрия, снижающий вредное влияние некоторых шихтовых примесей[7]. Обращают внимание на вредное влияние глинозема в кварцевом песке. Поэтому кварцевые пески подвергаются тщательной промывке. Однако не исключено, что оставшиеся примазки глины, а также зола восстановителей в восстановительных условиях могут образовывать комплексные карбиды типа Аl4SiС и Al4CSi4, имеющие различную стабильность*. При высоких температурах Аl4SiС4 может диссоциировать с образованием SiС, Аlг, Ст. Давление пара Аlг над системой Аl4SiС4–SiС–Ст зависит от температуры по выражению lgр(Па) = –1856/Т + 12143. По некоторым данным предположительно черный цвет промышленного карбида кремния обусловлен присутствием алюминия. Поваренная соль устраняет это влияние. Единичная мощность печи сопротивления составляет 4000–4500 кВ×А. Печь представляет собой самоходную платформу, на концах которой размещены токоподводящие угольные электроды. На дно платформы насыпают возврат, кварцевый песок, а затем выкладывают из кускового нефтяного кокса керн, который и является в начальный период процесса рабочим сопротивлением. Сверху на керн насыпают реакционную шихту (рисунок 2). Ниже приведен удельный расход шихтовых материалов и электроэнергии при получении черного (числитель) и зеленого (знаменатель) карбида кремния: Расход материалов, кг/т: песка кварцевого 1750/2000 антрацита 900/700 кокса нефтяного 300/600 опилок древесных 170/370 соли поваренной (NаСl) –/230 Расход электроэнергии, кВт×ч/т 8200/10000  1 – тележка; 2 – механизм передвижения печи; 3 – узел токоподвода; 4 – торцевые стенки; 5 – съемные щиты; 6 – упорные стойки; 7 – шихта; 8 – керн; 9 – колесные пары Рисунок 2 – Самоходная электропечь сопротивления для получения карбида кремния Кварцевый песок должен применяться чистым по примесям (99,6% SiO2; 0,3% FeО; 0,07% Аl2O3; 0,04% СаО; 0,03% Мg0; 0,02% ТiO2). В качестве восстановителя могут использоваться только малозольные углеродистые материалы: антрацит (3% золы, 93% Ст); нефтяной кокс (0,8% золы, 94% Ст, 5% летучих веществ, 3% влаги). В печь загружают 50–65 т шихты и 3200–4500 кг керна, затем ее подключают к печному трансформатору. Процесс получения карбокорунда контролируют в основном по расходу электроэнергии[7]. Для печи с установленной мощностью трансформатора 3500 кВт процесс считается законченным, если расход электроэнергии составляет 65–70 МВт×ч. Охлаждают печь в течение 24–32 ч, затем ее содержимое разбирают. Химический состав продуктов приведен таблице 2. Таблица 2 – Химический состав, %, продуктов получения зеленого карбокорунда
Кусковой SiС направляют на дальнейшую переработку для получения абразивного зерна различных классов, а «сростки», содержащие до 70% SiС, используют при выплавке ферросилиция, производстве огнеупорных масс, в составе углеродных масс для самообжигающихся электродов и других целей. Карбид кремния, вводимый в шихту для выплавки ферросилиция, сравнительно легко разрушается металлическим железом по реакции: SiС + Fе = [Si]Fe + Ст (14) Эта реакция может протекать до тех пор, пока содержание кремния в сплаве не достигнет 23–24% с образованием силикокарбида Fе5Si3Сx, находящегося в равновесии с карбидом кремния. Промышленное производство карбида кремния сопровождается выделением большого объема газообразных продуктов химических реакций. В соответствии с конструкцией печи и способом ее загрузки СО, образующийся по реакции SiO2 + 3С = SiC + 2СO должен догореть до СО2. Однако по некоторым причинам имеет место неполное окисление СО до СО2, и часть СО поступает в окружающую среду. Сера, содержащаяся в углеродистых восстановителях, переходит в газообразную фазу в виде различных соединений. При t > 900оС SiС может взаимодействовать с парами серы по реакции: SiС + 4Sпар ↔ SiS2 + СS2 (15) а также с галогенами с образованием вредных соединений. Изложенное требует создания систем улавливания и очистки пылегазовых выбросов, что реализовано в промышленности. Все применяемые в мире аппаратные схемы производства карбида кремния объединяет то, что процесс происходит в печах сопротивления различных конструкций, где горизонтальный нагреватель (керн), выложенный из углеграфитового материала, окружен реакционной и наполнительной шихтой. Тип, объём и мощность применяемых печей выбирается исходя из объёмов выпуска, способа получения карбида кремния и технического уровня предприятия[8]. Условно, по конструкции основного агрегата, аппаратные схемы формируются на основе стационарных или подвижных электропечей[8]. Стационарные печи имеют пониженную стоимость и повышенный срок службы. Для стационарных печей практически нет ограничений веса, габаритов и, соответственно, мощности. Однако, при их эксплуатации все переделы производства, кроме подготовки сырья, осуществляются на одной площадке. Каждый передел обладает своей спецификой в отношении механизации и удаления вредных выбросов. Это требует отделения рабочих зон различных печей, привлечения отдельных кранов и множества средств механизации. Это целесообразно на больших печах мощностью более 10 Мвт. На постсоветстком пространстве нашли применение только самоходные электропечи небольшой мощности (3…5Мвт), которые позволяют механизировать процесс и на всех переделах локализовать выбросы. Но очевидно, что такие процессы себя изживают из-за значительных теплопотерь в процессе синтеза, низкого выхода продукта и затрат на обслуживания печей[8]. ЗаключениеКарби́д кре́мния (карбору́нд) — бинарное неорганическое химическое соединение кремния с углеродом. В природе встречается в виде чрезвычайно редкого минерала — муассанита. Порошок карбида кремния был получен в 1893 году. Используется как абразив, полупроводник, в микроэлектронике (в силовых установках электроавтомобилей), для имитирующих алмаз вставок в ювелирные украшения. В данной работе: производство карбида кремния изучила следующие задачи: 1 Основные свойства карбида кремния и его соединения, области применения, 2 Способы получения карбида кремния и его соединений, 3. Производства карбида кремния. Список используемой литературыКарбид кремния: технология, свойства, применение / Под ред. Беляева А. Е., Конаковой Р. В. — Харьков: ИСМА, 2010. — 532 с. — ISBN 978-966-02-5445-9 Дигонский С. В. Газофазные процессы синтеза и спекания тугоплавких веществ. — М.: ГЕОС, 2013. — 462 с. 212. К. А. Сарайкина, В. А. Шаманов Дисперсное армирование бетонов // Вестник ПГТУ. Урбанистика. 2011. № 2. Елецкий А. В., Искандарова И. М., Книжник А. А., Красиков Д. Н. Графен: методы получения и теплофизические свойства // Успехи физических наук. — Российская академия наук, 2011. — Т. 181. — С. 227—258. — doi:10.3367/UFNr.0181.201103a.0233 Рабинович, В. А. Кремния карбид // Краткий химический справочник / В. А. Рабинович, З. Я. Хавин. — Л. : Химия, 1977. — С. 74. стр. 119—128 в «Карбид кремния» под ред. Г.Хенита и Р.Рол, пер. с англ.; М. Мир: 1972 349с., с ил. Технология производства карбида кремнияhttps://ttvsif.at.ua/page17.html Основные технологические процессы производства карбида кремния https://www.abrasive.pro/post/ranking-this-year-hs-prospects-by-position |