Реферат Химия Простые сложные вещества. Простые сложные вещества
 Скачать 249.27 Kb. Скачать 249.27 Kb.
|
|
Частное профессиональное образовательное учреждение «Гуманитарный колледж «Эдельвейс» Специальность «Сестринское дело» РЕФЕРАТ  Дисциплина: «Химия» Тема: «Простые сложные вещества» Работу выполнил студент: Группы 22-СД (9)-4 Работу проверил(а) Преподаватель общеобразовательных дисциплин ВВЕДЕНИЕ 1 Различие между атомами 2 Химические элементы и их соединения 2.1 Соединения. Химические формулы 3 Простое и сложное химическое вещество 3.1 Простые вещества 3.2 Сложные вещества Список литературы ВВЕДЕНИЕ Классификация чистых веществ в химии начинается с разделения их на простые и сложные в зависимости от состава. Различие между ними, связанное с понятиями химического элемента и соединения, обусловлено атомно-молекулярным строением вещества. 1. Различие между атомами Атом представляет собой связанную электрическими силами систему из ядра и электронного облака. Ядро образовано протонами и нейтронами и имеет положительный электрический заряд, складывающийся из зарядов протонов. Нейтроны, не имеющие заряда, вносят вклад в массу ядра и, соответственно, атома. Мельчайшие носители отрицательного заряда – электроны – образуют вокруг ядра облако. Зарядом ядра определяется их число, от которого зависит конфигурация облака, – в частности, заполнение электронами его внешней оболочки, то есть химические свойства атома. Разнообразие атомов – это следствие существования ядер с разным количеством протонов. 2. Химические элементы и их соединения Совокупность атомов с одинаковой величиной заряда ядра называют химическим элементом. Эта величина в периодической таблице представлена порядковым номером элемента. Например, номер азота – 7 – означает, что в ядре атома азота 7 протонов. У химических элементов существуют разновидности – изотопы, отличающиеся числом нейтронов в ядре и значениями атомных масс. Физические свойства изотопов неодинаковы, а химические идентичны, поскольку они представляют один и тот же элемент. Число внешних электронов в атоме может изменяться. В этом случае он приобретает электрический заряд и становится ионом: отрицательным, если присоединяет лишний электрон, и положительным при потере своего. При этом не происходит превращения одного химического элемента в другой, так как заряд ядра сохраняется. 2.1 Соединения. Химические формулы Атомы вступают в химическую связь, взаимодействуя внешними электронными оболочками, и образуют молекулы или немолекулярные структуры с регулярным строением. Вещества, частицы которых представляют собой устойчивые сочетания атомов или ионов, называются химическими соединениями. Химические обозначения соединений – формулы – отражают элементный состав и количество атомов каждого элемента в структурной единице вещества. Формула H2 означает, что молекула вещества образована одним элементом и состоит из двух атомов. По формуле KNO3 видно, что вещество составлено тремя элементами – калием, азотом и кислородом в соотношении 1:1:3. 3. Простое и сложное химическое вещество 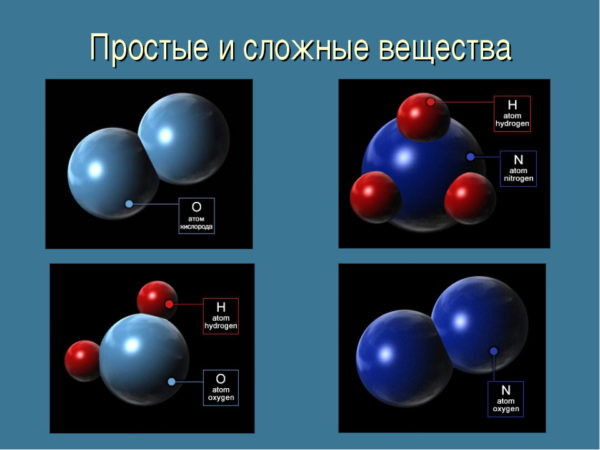 3.1 Простые вещества Простые вещества – вещества, в состав которых входят атомы одного вида Простым называют вещество, состоящее из однотипных атомов, то есть образованное одним элементом. Его нельзя разложить на другие вещества. Простые вещества подразделяют на две группы: металлы: натрий, алюминий, марганец, золото, железо и т. д.; неметаллы: кислород, озон, водород, хлор, графит и пр. Если атомы связаны в молекулы, то простое вещество считается соединением (бром, фосфор, большинство газов). В отличие от них, металлы, алмаз, графит, инертные газы – это атомарные вещества. Элемент и вещество Понятие простого вещества необходимо отличать от понятия химического элемента. Элемент – это совокупность химически одинаковых атомов. В свободном виде он существует в форме природного или искусственного простого вещества.
Аллотропия Некоторые элементы в свободном виде существуют в нескольких формах. Это явление называется аллотропией. Различным формам одного элемента – аллотропным модификациям – присущи разные свойства. Аллотропия обусловлена следующими причинами: Различия в составе. Например, вещества кислород (O2) и озон (O3) – аллотропные модификации химического элемента кислород. Различия в строении. Элемент углерод представлен такими веществами, как алмаз, графит, графен, фуллерены. Различают аморфный и кристаллический кремний, белый, красный, черный и другие виды фосфора. 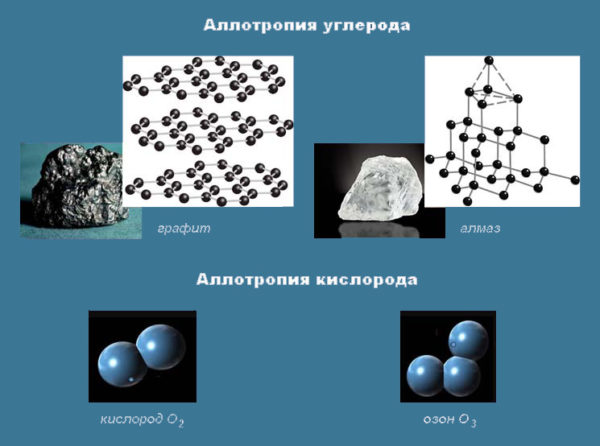 Число химических элементов достигло 118, но вследствие аллотропии простых веществ насчитывается свыше 400. 3.2 Сложные вещества Сложные вещества – вещества, в состав которых входят атомы различных видов Сложное вещество построено из химически связанных атомов различных элементов. Получение и разложение сложных веществ осуществляется в химических реакциях. Это отличает их от смесей. Неметаллы, как правило, образуют вещества, состоящие из молекул: воду H2O, аммиак NH3, углекислый газ CO2, метан CH4. Металлы образуют немолекулярные соединения: поваренную соль NaCl, негашеную известь CaO, гидрид меди CuH. Классификация сложных химических веществ Исходя из строения и свойств, выделяют следующие классы сложных соединений: Бинарные. Это вещества, образованные двумя элементами: гидриды (CaH2, KH), карбиды (SiC, Mg2C) бескислородные кислоты (соляная HCl, сероводород H2S) и их соли (хлориды, сульфиды и др.). Оксиды. Это сложные бинарные вещества, в составе которых есть кислород со степенью окисления (условным зарядом иона) -2. Различают основные K2O, MgO (степень окисления металла +1, +2), кислотные SO3, CO2, CrO3 с неметаллами или металлами в степени окисления от +5 до +7, амфотерные ZnO, Al2O3 и несолеобразующие (CO, SiO, NO и N2O) оксиды. Гидроксиды характеризуются составом вида «элемент – группа OH». К этому классу веществ относят: Кислоты (азотная HNO3, фосфорная H3PO4, серная H2SO4). Образуются в результате взаимодействия кислотных оксидов с водой. Имеют в составе один или несколько атомов водорода, которые могут замещаться атомом металла, и кислотный остаток. Основания (едкий натр NaOH, гашеная известь Ca(OH)2), образующиеся в реакциях воды с основными оксидами. Растворимые основания (KOH, NaOH) называются щелочами. Амфотерные гидроксиды способны проявлять и кислотные, и основные свойства. Соли. Это сложные химические вещества с составом типа «металл – кислотный остаток». Соль – продукт реакции между кислотой и основанием. Карбонат калия (поташ) K2(CO)3, сульфат меди (медный купорос) CuSO4 – примеры солей. 
Количество сложных веществ, включая полученные искусственно соединения, превышает 25 миллионов. Выводы Выводы по теме Простые и сложные вещества Простые вещества – вещества, в состав которых входят атомы одного вида Простые вещества делят на металлы и неметаллы Сложные вещества – вещества, в состав которых входят атомы различных видов Сложные вещества делят на органические и неорганические Существуют вещества атомного, молекулярного и ионного строения, их свойства различны Кристаллическая решетка – вспомогательный геометрический образ, вводимый для анализа строения кристалла Список литературы 1. Ахметов Н.С. Общая и неорганическая химия. — 4 изд., испр. — Москва: Высшая школа, Издательский центр "Академия", 2001. — 743 с. — 15 000 экз. — ISBN 5-06-003363-5, 5-7695-0704-7 2.Врублевский А.И. Химия: базовый школьный курс. — Минск: Юнипресс, 2009. — 576 с. — 3 100 экз. — ISBN 978-985-507-813-6 3. Ауэрман, Т.Л. Основы биохимии: Учебное пособие / Т.Л. Ауэрман, Т.Г. Генералова, Г.М. Суслянок. - М.: НИЦ ИНФРА-М, 2018. - 400 c. 4. Бабкина, С.С. Общая и неорганическая химия. Лабораторный практикум: Учебное пособие для бакалавров и специалистов / С.С. Бабкина, Р.И. Росин, Л.Д. Томина. - М.: Юрайт, 2016. - 481 c. 5. Барагузина, В.В. Общая и неорганическая химия: Учебное пособие / В.В. Барагузина, И.В. Богомолова, Е.В. Федоренко. - М.: ИЦ РИОР, 2017. - 272 c. 6. Богомолова, И.В. Неорганическая химия: Учебное пособие / И.В. Богомолова. - М.: Альфа-М, НИЦ ИНФРА-М, 2016. - 336 c. 7. Боровлев, И.В. Органическая химия: термины и основные реакции / И.В. Боровлев. - М.: БИНОМ. ЛЗ, 2018. - 359 c. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
