РГР Шаповалова мирзоев-1. Расчетнографическая работа по курсу Материаловедение
 Скачать 0.97 Mb. Скачать 0.97 Mb.
|
|
Министерство науки и высшего образования РФ Рыбинский государственный авиационный технический университет П.А.Соловьева Кафедра «Материаловедения, литья и сварки» РАСЧЕТНО-ГРАФИЧЕСКАЯ РАБОТА по курсу «Материаловедение »Вариант задания 8 Студент группы МТБ-19 Преподаватель Шаповалова М.А. Рыбинск-2021 Вариант 8 1.Определите какие дефекты кристаллического строения (1 – 6) имеются в решетке кристаллов, приведенных на рисунке. Опишите влияние на свойства, дефектов кристаллического строения, указанных под номером 6. Описать механизм упрочнения. 2. Вычертить диаграмму состояния системы «алюминий – медь». Указать линии ликвидуса и солидуса, структурно – фазовый состав областей. Для сплава содержащего 20%Cu, построить кривую охлаждения и описать происходящие при охлаждении превращения. Определить интервал кристаллизации. Предположить, исходя из положения на диаграмме состояния, механические и технологические свойства. Для данного сплава определить количество структурных составляющих при 5600С и 200С. Схематично изобразить структуру при температуре 200С. 3.Вычертите диаграмму состояния «железо – цементит» строго в масштабе, укажите структурные составляющие и фазы во всех областях диаграммы, опишите превращения и постройте кривую охлаждения с применением правила фаз для сплавов, содержащих 1 сплав 0,5%С и 2 сплав 4,4%С процентов углерода, объясните физическую природу хода этой кривой. Для заданных сплавов, определите химический состав фаз и их массу в процентах ко всему сплаву при температуре 1 сплав 14500С и 200С, 2 сплав 12000С и 200С. Какова микроструктура этих сплавов при комнатной температуре и как эти сплавы называются? Зарисуйте схематически микроструктуру. 1.Определите какие дефекты кристаллического строения (1 – 6) имеются в решетке кристаллов, приведенных на рисунке. Опишите влияние на свойства, дефектов кристаллического строения, указанных под номером 6. Описать механизм упрочнения. 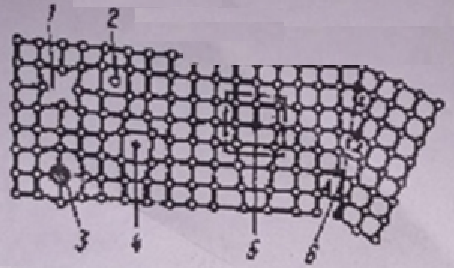 В кристаллах, приведённых на заданном рисунке представлены следующие дефекты кристаллического строения: 1 - вакансия, отсутствие атома в положении равновесия; приводит к изменению межплоскостного расстояния , искажению кристаллической решетки, смещению соседних атомов из положения равновесия. 2 - межузельный атом; - межузельные (дислоцированные) атомы образуются в результате перехода атома из узла решетки в междоузлие (на месте атома образуется вакансия). Их образование связано с большими затратами энергии. 3. Атом замещения, превосходящей размер атомов исходной решётки Вызывает увеличение периода кристаллической решётки, увеличение микро напряжений. 4 - чужеродный атом внедрения, в зависимости от размера в разной степени искажает кристаллическую решётку (сжатие, растяжение), 5. атомные дефекты в виде внедрения в решетку чужеродного атома или иона. 6. Дислокации - линейные, одномерные дефекты кристаллических материалов, имеющие большую протяжённость в одном направлении. Под действием внешних механических напряжений, термическом воздействии дислокации перемещаются в кристаллической решётке. Перемещение дислокаций приводит к их размножению, взаимодействию, торможению. В результате возрастает плотность дислокаций в единице объёма кристаллического материала и значительно возрастает его прочность. 2. Вычертить диаграмму состояния системы «алюминий – медь». Указать линии ликвидуса и солидуса, структурно – фазовый состав областей. Для сплава содержащего 20%Cu, построить кривую охлаждения и описать происходящие при охлаждении превращения. Определить интервал кристаллизации. Предположить, исходя из положения на диаграмме состояния, механические и технологические свойства. Для данного сплава определить количество структурных составляющих при 5600С и 200С. Схематично изобразить структуру при температуре 200С. На рис 2.1 представлена заданная диаграмма состояний системы Al - Cu 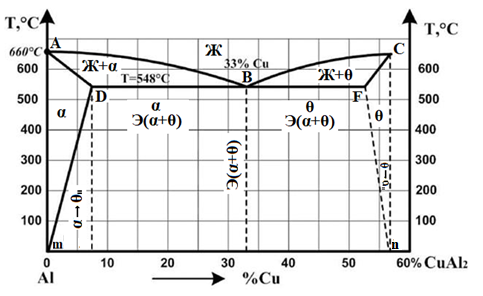 Рис. .2.1 Заданная диаграмма состояний Описание диаграммы Все сплавы системы состоят их двух компонентов Al и Cu Фазы системы сплавов: Ж - жидкий расплав атомов алюминия и меди, α - ограниченный твёрдый раствор внедрения атомов меди в кристаллической решётке алюминия, максимальная растворимость наблюдается при температуре, соответствующей точке D. θ - твёрдый раствор на атомов Al на базе химического соединения CuAl2 АВС – линия ликвидус. На ней лежат точки, соответствующие температурам начала кристаллизации сплавов рассматриваемого участка диаграммы. ADBF – линия солидус. На ней лежат точки, соответствующие температурам завершения кристаллизации сплавов. Dm– линия предельной растворимости атомов Cu в кристаллической решёткеAl. Fm– линия предельной растворимости атомов Al в кристаллической решётке CuAl2. Сплавы рассматриваемого участка диаграммы системы испытывают при температуре 5480С эвтектическое превращение. Эвтектическим называется превращение, когда сплав строго определённого состава, при строго определённой температуре, пересыщен сразу обоими компонентами и кристаллизуется сразу в две кристаллические фазы (α + θ). Механическая смесь этих фаз называется эвтектика (Э). Состав эвтектического сплава в рассматриваемой диаграмме соответствует точке С (33%Cu). Сплавы левее точки С называются доэвтектическими, правее заэвтектическими. Структурные и фазовые составляющие указаны во всех областях диаграммы. На рис.2.2 а) представлена заданная диаграмма состояний сплавов На диаграмме проведена температурная ордината заданного сплава 20%Cu, отмечены все точки пересечения ординаты с линиями сплава (1, 2, 3, точка 0 в расплаве). Справа рис 2.2б) построена кривая охлаждения заданного сплава. Для каждого температурного интервала написаны фазовые превращения  Рис 2.2 а) заданная диаграмма состояний, б) кривая охлаждения Описание кривой охлаждения В интервале температур 0 – 1 сплав находится в жидком состоянии и самопроизвольно, равномерно охлаждается рис. 2.2.1  Рис 2.1 Схема сплава в интервале температур 1-2 При температуре 1 начинается кристаллизация из сплава кристаллов α- фазы и продолжается до температуры, соответствующей точке 2 рис . 2.2  Рис 2.2 Схема сплава в интервале температур 1 - 2 Состав жидкого расплава изменяется от точки 1 – до точки В 1 - 2- При температуре, соответствующей точке 2 сплав испытывает эвтектическое превращение. Кристаллизация сплава завершается. Незакристовавшаяся жидкость состава точки В кристаллизуется сразу в две кристаллических фазы, в эвтектику Э(α + θ) рис. 2.3 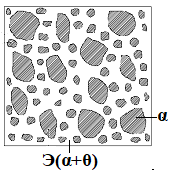 Рис 2.3 Схема микроструктуры сплава после завершения кристаллизации Предположить, исходя из положения на диаграмме состояния, механические и технологические свойства. Как известно закон Курнакова устанавливает связь между видом диаграммы состояния и свойствами сплавов. Вид диаграммы, также как и свойства сплава, зависит от того, какие соединения или какие фазы образовали компоненты сплава, между ними существует определенная связь. Эта зависимость установлена Курнаковым. Согласно правилам Курнакова, если сплав представляет собой механическую смесь компонентов (эвтектику), то свойства сплавов изменяются линейно, пропорционально концентрации рис.2.4а). Значение любого из свойств сплавов будет изменяться только в пределах свойств чистых компонентов. В системе сплавов с ограниченными твердыми растворами, свойства в области твердого раствора изменяются по криволинейной зависимости, а в областях, где присутствует эвтектика, – по линейной зависимости рис.2.4 б)  а) б) Рис. 2.4 Связь между видом диаграммы состояний и свойствами сплавов (правила Курнакова) Как видно из диаграммы состояний Al – Cu в представленном диапазоне концентраций рис.2.5, растворимость компонент системы друг в друге в равновесном состоянии практически отсутствует. Согласно правилам Курнакова можно предполагать линейное изменение свойств сплавов в равновесном состоянии рис.2.5  Риc. 2.5 Изменение свойств для системы сплавовAl – Cu при комнатной температуре По диаграмме состояния можно определить так же и технологические характеристики сплава. В данном случае, двухфазная эвтектическая механическая смесь обладает хорошими литейными свойствами и достаточно легко обрабатывается резанием. Для данного сплава определить количество структурных составляющих при 5600С и 200С. При температуре 5600С сплав, содержащий 20%Cu состоит из кристаллической α-фазы и жидкой фазы.. Согласно правилу отрезков при температуре 5600С проводим линию параллельную оси концентрации, отрезок aob – называется конода,пересекает линию, граничащую с областью существования жидкости в точке b, и с областью существования α – фазы в точке а. Рис 2.6 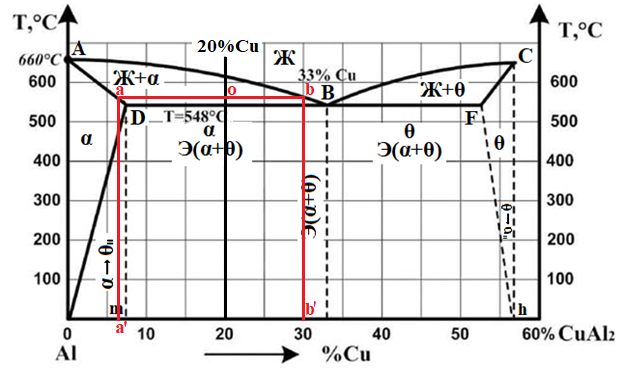 Рис. 2.6 Диаграмма состояний системы Al – CuAl2 Состав α – фазы (содержание в ней компоненты Cu) определяется проекцией точки α на ось концентраций, то есть точкой α’. Следовательно, в α – фазе при температуре 5600С содержится ≈ 6,4%Cu, остальное СuAl2 и примеси. Содержание компонента Cu в жидкой фазе при указанной температуре определяется точкой b’ и равно ≈ 30%, остальное Alи примеси. Температурная ордината сплава делит коноду на два отрезка aoи ob. По правилу отрезков количество фазы пропорционально длине отрезка противоположного области её существования. Обозначим Qα – количество α – фазы (отрезок ob , QЖ – количество жидкой фазы (отрезок ao), QСПЛ– количество всего сплава (100%), при указанной температуре (отрезок ab). Согласно правилу отрезков справедливо соотношение QЖ/Qα = оb/ao. Длины отрезков измерены на компьютере в относительных единицах (пикселях), ao = 107, ob= 78, ab = 185 Составим пропорции: Qспл – 100% или ab- 100% Qж - X% или ao - X Следовательно, QЖ = (ao/ab)*100% = (107/185)*100 = 57,84% Qα = Qспл - Qж = 100 – 57,84 = 42,16% Зная количество каждой фазы (т.е. концентрацию в сплаве) можно определить их массовые или объемные соотношения, поскольку концентрация – это количество вещества, содержащееся в единице массы или объема сплава. Таким образом, обозначив массу сплава буквой М, массовую долю феррита и аустенита (для данного случая) можно вычислить, используя следующие выражения: QЖ = (ao/ab)*М (3), для жидкой фазы и соответственно для α – фазы имеем: Qα = (ob/ab)*М (4) Например, если масса заданного сплава равна 1кг = 1000г, то: QЖ = (ao/ab)*М = (107/185)*1000 = 578,4(г) Qα = Мспл – Qж = 1000 – 578,4 = 421,6(г) При температуре 200С сплав, содержащий 20%Cu имеет твердую α-фазу и твердую θ-фазу, (рис.2.7) фрагмент диаграммы состояний системы Al – Cu) При температуре 200С проводим линию параллельную оси концентрации, отрезок aob – называется конода,пересекает линию, граничащую с областью существования жидкости в точке b, и с областью существования α – фазы в точке а.  Рис.2.7 Фрагмент диаграмма состояний Al - Cu Состав α – фазы (содержание в ней компоненты Cu) определяется проекцией точки α на ось концентраций, то есть точкой α’. Следовательно, в α – фазе при температуре 200С содержится ≈ 0,6% Cu, остальное компонент Al. Содержание компонента Cu в θ-фазу при указанной температуре определяется точкой b’ и равно ≈ 56,5%, остальное компонент Al. Температурная ордината сплава делит коноду на два отрезка aoи ob. По правилу отрезков количество фазы пропорционально длине отрезка противоположного области её существования. Обозначим Qα – количество α – фазы (отрезок ob, Qθ – количество θ-фазу (отрезок ao), QСПЛ– количество всего сплава (100%), при указанной температуре (отрезок ab). Согласно правилу отрезков справедливо соотношение Qα/Qθ = оb/ao. Длины отрезков измерены на компьютере в относительных единицах (пикселях), ao = 152, ob= 287, ab = 439 Составим пропорции: Qспл – 100% или ab- 100% Qθ - X% или ao - X Следовательно, Qθ = (ao/ab)*100% = (152/439)*100 = 34,62% Qα = Qспл - Qθ = 100 – 34,62 = 65,38% Зная количество каждой фазы (т.е. концентрацию в сплаве) можно определить их массовые или объемные соотношения, поскольку концентрация – это количество вещества, содержащееся в единице массы или объема сплава. Таким образом, обозначив массу сплава буквой М, массовую долю феррита и аустенита (для данного случая) можно вычислить, используя следующие выражения: Qθ = (ao/ab)*М (3), для θ- фазы и соответственно для α – фазы имеем: Qα = (ob/ab)*М (4) Например, если масса заданного сплава равна 1кг = 1000г, то: Qθ = (ao/ab)*М = (152/439)*1000 = 346,2(г) Qα = Мспл – Qж = 1000 – 346,2 = 653,8(г) 3.Вычертите диаграмму состояния «железо – цементит» строго в масштабе, укажите структурные составляющие и фазы во всех областях диаграммы, опишите превращения и постройте кривую охлаждения с применением правила фаз для сплавов, содержащих 1 сплав 0,5%С и 2 сплав 4,4%С процентов углерода, объясните физическую природу хода этой кривой. Для заданных сплавов, определите химический состав фаз и их массу в процентах ко всему сплаву при температуре 1 сплав 14500С и 200С, 2 сплав 12000С и 200С. Какова микроструктура этих сплавов при комнатной температуре и как эти сплавы называются? Зарисуйте схематически микроструктуру. На рис 3.1 изображена диаграмма состояний системы железо – цементит(карбид железа) 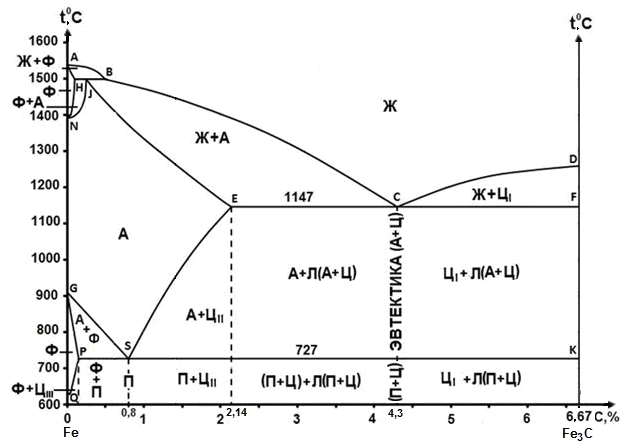 Рис.3.1 Диаграмма состояний системы железо – карбид железа Диаграмма построена в координатах: температура - в 0С, концентрация углерода - в %. Описание диаграммы Фазы в системе железоуглеродистых сплавов и их обозначение: Ж – жидкость, жидкая фаза сплавов – жидкий расплав атомов углерода и железа, растворимость неограниченная; Ф – феррит, кристаллическая фаза сплавов – ограниченный твёрдый раствор внедрения атомов углерода в кристаллической решетке ОЦК (объемно-центрированной кубической) железа. Различают низкотемпературный α – феррит ниже температуры 9110С и высокотемпературный δ – феррит выше температуры 13920С. Решётки кубические, а параметры разные. А – аустенит кристаллическая фаза - ограниченный твёрдый раствор внедрения атомов углерода в гранецентрированной кубической решетке (ГЦК) железа; Ц – цементит, кристаллическая фаза – химическое соединение (карбид железа) Fe3C. Различают ЦІ первичный, ЦІІ вторичный и ЦІІІ третичный, кристаллизующиеся, соответственно, из жидкости, из аустенита и из феррита в разных температурных интервалах. Структуры, формирующиеся в железоуглеродистых сплавах. П – перлит – структура, состоящая из смеси двух фаз (Ф + Ц); Л – ледебурит – структура, смесь фаз (А + Ц), выше температуры 7270С и (П + Ц ) ниже температуры 7270С. В равновесном состоянии практически все железоуглеродистые сплавы состоят из двух фаз, феррита (Ф) и цементита (Ц), но имеют разную структуру и свойства. Линии диаграммы состояний: АВСD - линия ликвидус, на которой лежат точки, соответствующие температурам начала кристаллизации всех сплавов системы; AHJECF-линия солидус, на которой лежат точки, соответствующие температурам окончания кристаллизации сплавов системы; AHN– линия предельной растворимости углерода в δ – феррите; PQ- линия предельной растворимости углерода в α – феррите; ES- линия предельной растворимости углерода в аустените. Нонвариантные превращения в железоуглеродистых сплавах. При различных температурах, сплавы разных концентраций испытывают превращения при постоянной температуре и постоянных концентрациях фаз (нонвариантные превращения). При температуре 14990С сплавы, содержащие 0,1 Фазовая реакция перитектического превращения Жв( 0,5%С) + Фн( 0,1%С) → АJ ( 0,25%С); HJB – линия перитектического превращения. При температуре 11470С сплавы, содержащие более 2,14 до 6,67% углерода, включительно, испытывают эвтектическое превращение. Фазовая реакция эвтектического превращения ЖC( 4,35С)→АE( 2,14%С) + ЦF( 6,67%С). ECF - линия эвтектического превращения. При температуре 7270С сплавы, содержащие более 0,022 до 6,67%С - углерода испытывают эвтектоидное превращение. Фазовая реакция эвтектоидного превращения АS( 0,8%С) → ФP(0,022%С) + ЦK( 6,67%С).. PSK - линия эвтектоидного превращения. Фазовые области на диаграмме железо – цементит. На диаграмме присутствуют четыре однофазные области. Фазы в этих областях при понижении температуры равномерно охлаждаются. 1.Выше линии ликвидус все сплавы находятся в однофазном жидком состоянии (Ж); 2.AHN - область существования δ - феррита (δ - Ф); 3.GPQ– область существования α – феррита (α – Ф); 4.NJESG – область существования аустенита (А). Остальные области двухфазные. При равномерном медленном охлаждении в них одновременно существуют две фазы и происходят следующие процессы: 1.AHB – из жидкости кристаллизуется δ - феррит Ж → δ - Ф; 2.BCEJ- из жидкости кристаллизуется аустенит; Ж → А: 3.CDF – из жидкости кристаллизуется цементит Ж → Ц первичный; 4.HJN – δ - феррит перекристаллизуется в аустенит δ - Ф → А; 5.GSP – аустенит перекристаллизуется в α - феррит А → α – феррит; 6.SECFK – из аустенита выделяется цементит А → Ц вторичный; 7.QPSKL – из феррита выделяется цементит Ф → Ц третичный. Во время медленного равномерного охлаждения и кристаллизации составы фаз (содержание в них углерода) меняются по линиям предельной растворимости, состав жидкой фазы по линии ликвидус. Во время нонвариантных превращений одновременно существуют три фазы. Температура во время превращения и составы фаз постоянны. Классификация железоуглеродистых сплавов. Железоуглеродистые сплавы классифицируются следующим образом: 1. До 0,022%С, включительно – техническое железо; 2. более 0,022 – 2,14%С, включительно – стали (до 0,8%С – стали доэвтектоидные, 0,8%С – эвтектоидная сталь, более 0,8%С до 2,14%С включительно, – стали заэвтектоидные); 3. от2,14% до 6,67%С – чугуны (до 4,3%С – доэвтектические, 4,3%С – эвтектический, более 4,3% до 6,67%С – заэвтектические). Согласно заданию строится кривая охлаждения для сплава, содержащего 0,5%С На рис 3.2а) приведён фрагмент диаграммы железо – цементит, для малоуглеродистых сплавов. На диаграмме проведена температурная ордината сплава, содержащего, согласно заданию 0,5%С  Рис.3.2 а) фрагмент диаграммы состояний Fe – Fe3C, б) кривая охлаждения для сплава, содержащего 0,5%С Сплав, содержащий 0,5%С – доэвтектоидная сталь. Кривая охлаждения, построена с применением правила фаз Правило фаз (закон Гиббса) описывается для двухкомпонентных систем уравнением: С = К – Ф + 1, где С – число степеней свободы системы – число внутренних (концентрация) и внешних факторов (температура и давление), которое можно изменять, в определённых пределах, без изменения числа фаз в системе, существующих в равновесии, при рассматриваемых условиях; К – число компонентов (химических элементов), образующих систему. Иногда в качестве компонентов удобно использовать не химические элементы, а их соединения, например, Fe3C, тогда их называют псевдокомпонентами; Ф – число фаз, находящихся в равновесии; (существующих одновременно), при рассматриваемых условиях; 1 – константа. Описание кривой охлаждения До температуры (·)1 сплав находится в жидком состоянии и равномерно охлаждается рис 3.3  Рис.3.3 Схема сплава в жидком состоянии При температуре 1 начинается кристаллизация из жидкости аустенита. В интервале температур 1- 2 из жидкости кристаллизуется аустенит, при этом состав жидкости изменяется по линии ликвидус от 1 - до 2¹, а состав аустенита по линии солидус от J до 2, сплав двухфазный в равновесии существуют две фазы (Ж + А) рис.3.4. 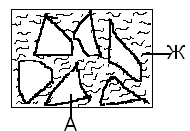 Рис.3.4 Схема сплава в интервале 1 – 2 При температуре 2 кристаллизация аустенита заканчивается. Сплав приобретает однофазную структуру - аустенит. В интервале температур 2 – 3 аустенит охлаждается рис 3.5  Рис 3.4 Схема микроструктуры сплава в интервале температур 2 - 3 При температуре 3 начинается фазовая γ→α перекристаллизация аустенита в феррит. В процессе перекристаллизации состав аустенита (содержание в нём углерода) изменяется по линии ES от точки 3 до точки S, а состав феррита от точки 3¹ до точки P. До температуры 4 весь аустенит не перекристаллизуется. В интервале температур 3 – 4 сплав находится в двухфазном состоянии (А + Ф) рис. 3.5.  Рис.3.5 Схема микроструктуры сплава в интервале температур 3 – 4 При температуре 4 неперекристаллизовавшийся аустенит испытывает эвтектоидное превращение, распадается на феррито – цементитную смесь –перлит (П). Во время превращения в равновесии существуют три фазы А (аустенит), Ф (феррит) и Ц (цементит) рис 3.6.  Рис. 3.6 Схема микроструктуры сплава после эвтектоидного превращения В интервале температур 4 -5 сплав равномерно охлаждается, в процессе охлаждения состав феррита изменяется от точки P до точки Q, из феррита выделяется цементит третичный.При дальнейшем охлаждении никаких структурных превращений не происходит. Структура сплава в равновесном состоянии Ф + П, фазовый состав Ф и Ц рис. 3.6. Определение состава и относительного количества фаз заданного сплава (0,5%C) при температуре 14500С по правилу отрезков. Согласно правилу отрезков при температуре 14500С проводим линию параллельную оси концентраций. Отрезок aоb называется – конода, рис.3.7 Температурная ось сплава делит коноду на два отрезка ао и оb. Согласно правилу отрезков (правилу рычага) количество фазы пропорционально длине отрезка противоположного области её существования. 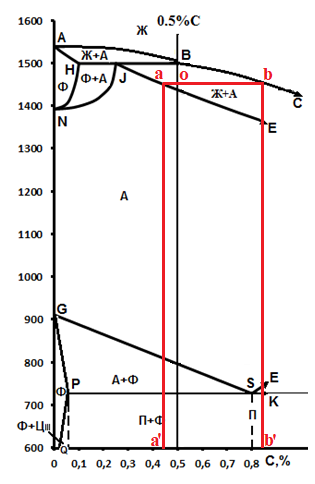 Рис. 3.7 Построение коноды для сплава 0,5%С при температуре 14500С При температуре 14500С сплав 0,5%С состоит из двух фаз аустенита и жидкости. Обозначим количество 100% всего сплава – Qспл. Количество жидкой фазы расплава – QЖ (отрезок ао). Количество аустенита – QА (отрезок оb). Содержание углерода в аустените, определяется проекцией точки «а» на ось концентраций (точкой a’); а в жидкой фазе точкой b’. a’ ≈ 0,44%С в аустените, остальное железо; b’ ≈ 0,84%С в жидкой фазе, остальное железо. По правилу отрезков справедливо соотношение QЖ/QА = ао/оb Длины всех отрезков измеряются в относительных единицах (мм, см, м, и т.д.) на компьютере в пикселях ао = 14, оb= 86, ab = 100. Составляем пропорции 1) Qспл. – 100% или ab - 100% 2)Qспл – 100% или ab - 100% Qж - Х% или ao - Х% QА - Y% или ob - Y% Следовательно, количество каждой фазы в заданном сплаве будет равно: QЖ = (ao/ab)*100% = (14/100)*100% = 14%(1) QА = (ob/ab)*100% = (86/100)*100% = 86%(2) Зная количество каждой фазы (т.е. концентрацию в сплаве) можно определить их массовые или объемные соотношения, поскольку концентрация – это количество вещества, содержащееся в единице массы или объема сплава. Таким образом, обозначив массу сплава буквой М, массовую долю феррита и аустенита (для данного случая) можно вычислить, используя следующие выражения: QЖ = (ao/ab)*М (3), для жидкой фазы и соответственно для аустенита имеем: QА = (ob/ab)*М (4) Например, если масса заданного сплава равна 1кг = 1000г, то: QЖ = (ao/ab)*М = (14/100)*1000 = 140(г) QА = (ob/ab)*М = (86/100)*1000 = 860(г) Определение составов и относительных весовых количеств равновесных фаз для комнатной (нормальной) температуры. 200С Сплав с содержанием 0,5%С при температуре 200С состоит из двух фаз: феррита и цементита. Состав фаз определяется по проекциям точек пересечения коноды с линиями, ограничивающими область существования фазы на ось концентраций. Рис. 3.8  Рис.3.8. Построение коноды для сплава 0,5 при температуре 200С Состав феррита: ≈ 0,006%С (минимальное количество углерода в точке Q при комнатной температуре), остальное железо. Состав цементита - 6,67% С, 93,33%Fe. Процентное количество фаз определяется по правилу отрезков (правилу рычага). Количество фазы пропорционально длине противолежащего ей отрезка. Обозначим количество феррита QФ, количество цементита QЦ. Согласно правилу отрезков QФ//QЦ.= оb/ао. Длина отрезков в условных единицах: ао=37, оb= 474, ab = 511. Если длину всего отрезка ab = 511 обозначить Qсп и принять за 100% сплава, то процентное содержание фаз определяется из соотношений: QФ= (оb/ab)*100% = (474/511)*100% = 92,76%. QЦ = (ао/ab)*100% = (37/511)*100% = 7,24% Зная количество каждой фазы (т.е. концентрацию в сплаве) можно определить их массовые или объемные соотношения, поскольку концентрация – это количество вещества, содержащееся в единице массы или объема сплава. Таким образом, обозначив массу сплава буквой М, массовую долю феррита и аустенита (для данного случая) можно вычислить, используя следующие выражения: QЦ = (ao/ab)*М (3), для цементита соответственно для феррита имеем: QФ = (ob/ab)*М (4) Например, если масса заданного сплава равна 1кг = 1000г, то: QЦ = (ao/ab)*М = (37/511)*1000 = 72,4(г) QФ = Мспл – Qж = 1000 – 72,4 = 927,6(г) Сплав, содержащий 4,4%C - заэвтектический белый чугун. На рис.3.9а) приведена диаграмма состояний системы железоуглеродистых сплавов. На диаграмме проведена температурная ордината заданного сплава и отмечены все точки её пересечения с линиями диаграммы (1, 2, 3, 4) точка «0» в расплаве. Слева построена кривая охлаждения сплава рис.3.9 б). 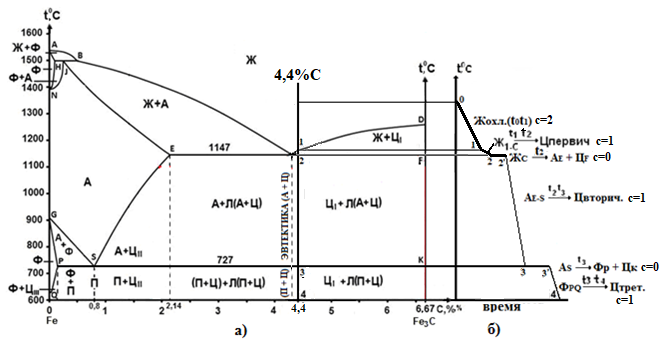 Рис 3.9 а) Диаграмма состояний системы сплавов Fe – Fe3C, б) Кривая охлаждения сплава, содержащего 4,4%С и фазовые реакции Для каждого интервала температур указаны фазовые реакции происходящих в сплаве при охлаждении фазовых превращений и число степеней свободы системы (с). Описание кривой охлаждения От температуры (·)0 до температуры (·)1 сплав находится в жидком состоянии и равномерно охлаждается, рис.3.2 .  Рис.3. 2 Схема сплава в интервале температур 0 – 1 При температуре 1 из жидкости начинается кристаллизация цементита первичного Ц1. В интервале (1 - 2) в процессе кристаллизации состав цементита остаётся неизменным (.)1′ до(.) F по линии солидус, а состав жидкости изменяется от(.) 1 до(.) C по линии ликвидус. Сплав в этом интервале температур двухфазный (Ж + Ц первичный), рис.3.3 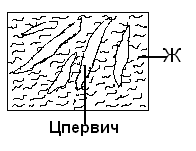 Рис.3.3. Схема сплава в интервале температур 1 - 2 При температуре 2 незакристаллизовавшаяся жидкость (ЖС) испытывает эвтектическое превращение, кристаллизуется сразу в две фазы – аустенит и цементит (АЕ +ЦF), смесь этих фаз называется ледебурит (Л), цементит первичный в структуре остаётся неизменным рис. 3.4. В процессе эвтектического превращения одновременно существуют три фазы Ж , ЦІ и А. 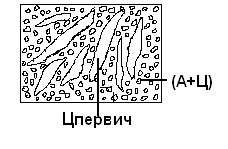 Рис.3.4 Схема микроструктуры сплава сразу после эвтектического превращения В интервале (2 - 3) закристаллизовавшийся сплав охлаждается и из аустенита в соответствие с линией ES выделяется цементит вторичный, который сливается с цементитом в составе ледебурита. Содержание углерода в аустените при этом уменьшается от 2,14% (.)Е до 0,8%(.)S. Сплав в интервале температур 2 - 3 двухфазный. При температуре 3 аустенит состава точки S испытывает эвтектоидное превращение, (распадается на феррит и цементит). Эта смесь называется перлит (П). Во время превращения одновременно существуют 3 фазы (А, Ф и Ц). После окончания превращения структура сплава состоит из кристаллов первичного цементита и ледебурита (П + Ц), рис.3.5. В интервале температур(3 - 4) сплав равномерно охлаждается, при этом из феррита выделяется цементит третичный, состав феррита изменяется по линии PQ. Сплав в интервале температур 3 -4 двухфазный. Структура сплава в равновесном состоянии (при температуре ≈ 6000С) цементит первичный (Ц1) + ледебурит рис.3.5. 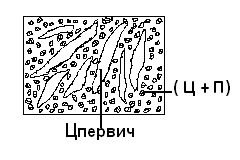 Рис.3.5 Схема микроструктуры сплава после эвтектоидного превращения Определение состава и относительного количества фаз заданного сплава (4,4%C) при температуре 12000С по правилу отрезков. При температуре сплав однофазный. 100% Ж Правила отрезков на однофазную область не распространяются. 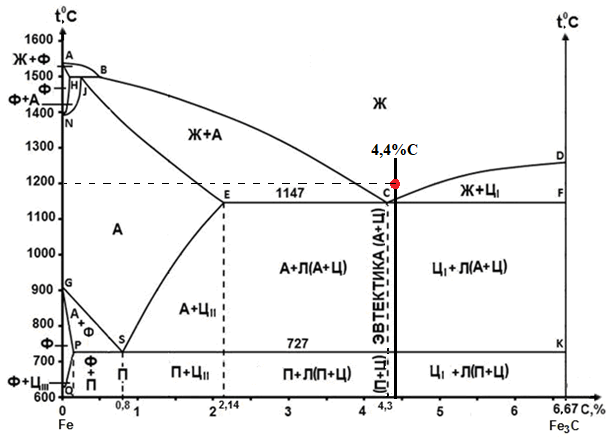 Рис. 3.6 Построение на диаграмме состояний Fe – Fe3C точки соответствующей сплаву состава 4,4%С при температуре 12000С Определение состава и относительного количества фаз заданного сплава (4,4%C) при температуре 200С по правилу отрезков. Сплав с содержанием 4,4%С при температуре 200С состоит из двух фаз: феррита и цементита. Состав фаз определяется по проекциям точек пересечения коноды с линиями, ограничивающими область существования фазы на ось концентраций. 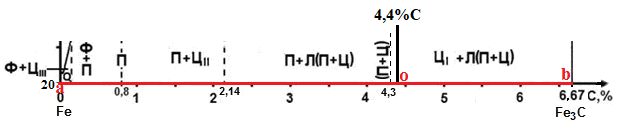 Рис. .3.11. Построение коноды для сплава 4,4%С при температуре 200С Состав феррита: ≈ 0,006%С (минимальное количество углерода в точке Q при комнатной температуре), остальное железо. Состав цементита - 6,67% С, остальное железо. Процентное количество фаз определяется по правилу отрезков (правилу рычага). Количество фазы пропорционально длине противолежащего ей отрезка. Обозначим количество феррита QФ, количество цементита QЦ. Согласно правилу отрезков QФ//QЦ.= оb/ао. Длина отрезков в условных единицах: ао=338, оb= 174, ab = 512. Если длину всего отрезка ab = 512 обозначить Qсп и принять за 100% сплава, то процентное содержание фаз определяется из соотношений: QФ= (оb/ab)*100% = (174/512)*100% = 33,98%. QЦ= (ао/ab)*100% (338/512)*100% = 66,02% Зная количество каждой фазы (т.е. концентрацию в сплаве) можно определить их массовые или объемные соотношения, поскольку концентрация – это количество вещества, содержащееся в единице массы или объема сплава. Таким образом, обозначив массу сплава буквой М, массовую долю феррита и аустенита (для данного случая) можно вычислить, используя следующие выражения: QЦ = (ao/ab)*М (3), для цементита соответственно для феррита имеем: QФ = (ob/ab)*М (4) Например, если масса заданного сплава равна 1кг = 1000г, то: QЦ = (ao/ab)*М = (338/512)*1000 = 660,2(г) QФ = (оb/ab)*М = (174/512)*1000 = 339,8(г). Точки перегиба на кривых охлаждения свидетельствуют об изменении скорости охлаждения сплава в зависимости от выделения скрытой теплоты кристаллизации. Список литературы 1. Арзамасов Б.Н., Макарова В.И., Мухин Г.Г. и др. Материаловедение. – М.: Изд-во МГТУ им. Н.Э. Баумана, 2005. – 648с. 2. Хворова И.А.Материаловедение. Технология конструкционных материалов: учебное пособие в 2-х ч. Часть 1 / И.А. Хворова; Национальный исследовательский Томский политехнический университет. − Томск: Изд-во Томского политехнического университета, 2011. – 74с. 3. Гуляев А.П. Металловедение: учебник для студентов вузов /А.П. Гуляев. 6-е изд., перераб. и доп - М.: Металлургия. 1986. – 542с. 4. Лахтин Ю.М., Леонтьева В.П. Материаловедение. – М.: ООО «Издательский дом Альянс», 2009. – 528с. |
