ьмсчя. 3 тема. Реферат по дисциплине Общая хирургия
 Скачать 0.57 Mb. Скачать 0.57 Mb.
|
|
Министерство здравоохранения ЛНР ГОСУДАРСТВЕННОЕ УЧРЕЖДЕНИЕ ЛУГАНСКОЙ НАРОДНОЙ РЕСПУБЛИКИ «ЛУГАНСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ ИМЕНИ СВЯТИТЕЛЯ ЛУКИ» Кафедра общей и факультетской хирургии Реферат по дисциплине «Общая хирургия» на тему: «Организация работы в стерилизационной. Подготовка и стерилизация режущих, оптических, общехирургических инструментов. Стерилизация шовного материала.» Выполнил: студент 3 курса 9А группы лечебного факультета Кобзарь Е. А. Проверил: кандидат медицинских наук, доцент Ходырев В. Н. Луганск – 2021 Содержание Введение 1. Методы стерилизации Паровой метод стерилизации Воздушный метод стерилизации Гласперленовая стерилизация Стерилизация газовым методом Инфракрасное воздействие Стерилизация растворами химических средств 2. Контроль эффективности стерилизации Список литературы Введение Стерилизация – это процесс уничтожения всех видов микробной флоры, в том числе их споровых форм, и вирусов с помощью физических или химических воздействий. Принято считать медицинское изделие стерильным, если вероятность его бионагрузки равна или менее 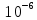 . Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, с раневой поверхностью, соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Стерилизация – сложный процесс, для успешной реализации которого необходимы следующие требования: . Стерилизации должны подвергаться медицинские изделия, контактирующие с кровью пациента, с раневой поверхностью, соприкасающиеся со слизистой оболочкой и могущие вызвать нарушение ее целостности. Стерилизация – сложный процесс, для успешной реализации которого необходимы следующие требования:эффективная очистка; соответствующие упаковочные материалы; соблюдение правил упаковки медицинских изделий; соблюдение правил по загрузке стерилизатора упаковками с медицинскими изделиями; адекватное качество и количество стерилизуемого материала; соответствующая работа оборудования; соблюдение правил хранения, обращения и транспортировки простерилизованного материала. Процесс стерилизации медицинских инструментов и изделий от момента окончания операции и до стерильного хранения или следующего применения включает в себя выполнение мероприятий в определенной последовательности. Все этапы должны быть строго соблюдены для обеспечения стерильности. Схематично это можно представить следующим образом: Отложить инструменты после использования -> Дезинфекция -> Механическая очистка инструмента -> Проверка на повреждения -> Промывание инструмента -> Сушка -> Укладка в стерилизационную упаковку -> Стерилизация -> Стерильное хранение/применение. При применении стерилизационной упаковки (бумага, фольга или стерилизационные контейнеры) инструменты могут храниться в стерильном виде и позднее использоваться от 24 часов до 6 месяцев. В лечебно-профилактических учреждениях применяется несколько форм организации стерилизации: децентрализованная, централизованная, осуществляемая в ЦСО, и смешанная. В амбулаторной стоматологической практике чаще применяется децентрализованная стерилизация (особенно в частных клиниках). Централизованная стерилизация характерна для районных стоматологических поликлиник и больших частных клиник. Децентрализованная стерилизация имеет ряд существенных недостатков, влияющих на ее эффективность. Предстерилизационная обработка изделий выполняется чаще всего вручную и при этом качество очистки изделий оказывается низким. Контроль за соблюдением технологии проведения стерилизации, правил упаковки, загрузки изделий в стерилизаторы и за эффективностью работы оборудования в условиях децентрализованной стерилизации затруднен. Все это приводит к снижению качества стерилизации. При применении централизованной формы стерилизации удается достичь более высоких результатов стерилизации за счет совершенствования существующих и внедрению новейших методов стерилизации. В централизованном стерилизационном отделении выделяют: моечную, дезинфекционную, упаковочную и подразделение для стерилизации и раздельного хранения стерильных предметов. Температура воздуха во всех подразделениях должна быть от 18°С до 22°С, относительная влажность – 35-70%, направление потока воздуха – от более чистых к менее чистым зонам. 1. Методы стерилизации Стерилизация осуществляется физическими методами: паровая, воздушная, гласперленовая (в среде нагретых стеклянных шариков), радиационная с применением инфракрасного излучения и химическими методами: растворы химических средств и газы. В последние годы применяется озоновая (стерилизатор С0-01-СПБ) и плазменная стерилизация (установка «Стеррад»), используются установки на основе окиси этилена, паров формальдегида. Выбор метода стерилизации изделий зависит от их устойчивости к методам стерилизационного воздействия. Контроль качества стерилизации является одним из наиболее важных мероприятий. Физический метод контроля работы стерилизаторов заключается в измерении таких параметров, как температура, давление и время стерилизации. Любое отклонение от стандартных режимов стерилизации является сигналом для оператора о вероятном сбое аппаратуры. Химический метод контроля заключается в регистрации изменения цвета или физических свойств индикаторов, использующихся для контроля времени экспозиции и условий стерилизации. Наиболее важным методом контроля качества стерилизации является биологический метод. Центры по контролю и профилактике заболеваний рекомендуют проводить контроль работы паровых стерилизаторов в стационарах как минимум 1 раз в неделю. В качестве биологических индикаторов в воздушных стерилизаторах используются споры Bacillus stearothermophilus, в газовых стерилизаторах - споры Bacillus subtilus. Споровый биологический контроль необходимо проводить при каждой загрузке стерилизатора «критическими» предметами. Критические инструменты и сосудистые катетеры не должны использоваться до получения отрицательного результата спорового теста. В идеале зона хранения стерильных предметов должна находиться рядом со стерилизационной, при этом стерильные изделия должны быть защищены от пыли, влаги, насекомых, паразитов, перепадов температуры и влажности. Стерильные изделия должны быть разложены таким образом, чтобы защитить упаковку от повреждений, изломов, сдавления и проколов. «Сроком годности» называется время, в течение которого изделия сохраняют стерильность. По различным данным, срок годности измеряется от 2 дней до неопределенного времени, однако в большинстве исследований не учитывался тип упаковочного материала и условия хранения. Потеря стерильности зависит от условий хранения и практически не зависит от времени. Для транспортировки стерильных инструментов в операционную и другие отделения стационара необходимо обеспечить дополнительное покрытие, защищающее от пыли, которое можно легко удалить перед входом в чистую зону. Все изделия подвергаются предстерилизационной очистке. 1.1 Паровой метод стерилизации Паровой метод стерилизации применяют для изделий из коррозионностойких металлов, стекла, текстиля, резины. Стерилизацию производят насыщенным паром под избыточным давлением в паровом стерилизаторе — автоклаве. Автоклав представляет собой котел с двойными стенками, между которыми находится водопаровая камера. В нее через воронку вливают воду. Образующийся пар проходит в стерилизационную камеру, где расположен стерилизуемый материал. Уровень воды определяют по водомерной трубе. Аппарат герметично закрывают крышкой, которую привинчивают болтами с гайками или центральным затвором. На крышке имеется манометр, стрелка которого указывает давление в аппарате. Снаружи аппарат покрыт кожухом. Под нижнюю часть аппарата подводят источник тепла для нагревания воды и образования пара. При заполнении аппарата паром давление в нем повышается и соответственно повышается температура. Пар проникает во все поры предмета, и содержащиеся в нем микробы погибают. Стерилизацию проводят в стерилизационных коробках (биксах), в двойной мягкой упаковке из бязи, пергамента, бумаги, мешочной непропитанной бумаге, мешочной влагопрочной. Для контроля стерилизации в бикс закладывают ленту Винара, которая изменяет цвет до эталона. Металлические биксы, применяемые для стерилизации, выпускают диаметром 16 см (малые биксы), 25 см (средние биксы) и 45 см (большие биксы). Наиболее распространены круглые биксы, но существуют и квадратные. В хирургическом отделении на 70-100 коек нужно иметь не менее 10 малых, 15 средних и 25 больших биксов. Чтобы пар мог проникнуть внутрь барабана, по окружности бикса проделаны отверстия, которые открываются или закрываются перемещением металлического ободка с окнами, соответствующими группам отверстий. Герметичность бикса обеспечивает зажимающее устройство, которое плотно прижимает ободок к стенке барабана. Укладка белья в биксы: биксы вытирают изнутри и снаружи 0,5%-ным раствором нашатырного спирта, затем отодвигают на боковой стенке бикса круговую пластинку, закрывающую боковые отверстия, откидывают крышку и выстилают дно и стенки бикса холщовым мешком, салфеткой, простыней. При укладке белья и перевязочного материала следует соблюдать раз и навсегда установленный порядок — это позволяет быстро и легко найти необходимое. Аккуратно сложенное белье укладывают секторально друг за другом в вертикальном положении, чтобы можно было вынуть из бикса любую вещь, не трогая остальные. Перевязочный материал также укладывают с таким расчетом, чтобы каждую пачку или пакет можно было извлечь отдельно. Когда бикс наполнен, края выстилающей простыни заворачивают один на другой поверх содержимого. В один из биксов поверх простыни закладывают халат, а на него несколько марлевых салфеток и полотенце. Это необходимо, чтобы, вымыв руки, операционная сестра могла их вытереть и надеть стерильный халат, не открывая остального белья и материала. На крышке каждого бикса должна быть привязана клеенчатая этикетка с перечнем всего, что в нем содержится, с датой стерилизации, указанием фамилии сестры, готовившей бикс. Закрыв крышку бикса, ее укрепляют имеющимся крючком на цепочке и прочно привязывают тесьмой, чтобы она случайно не открылась. В заключение проверяют, открыты ли боковые отверстия биксов. 1.2 Воздушный метод стерилизации Стерилизация при воздушном методе осуществляется сухим горячим воздухом температурой 160°, 180° и 200°С. Воздушным методом стерилизуют медицинские изделия, детали приборов и аппаратов из коррозионностойких металлов, стекла с пометкой 200°С, изделия из силиконовой резины. Перед стерилизацией воздушным методом изделия подвергаются предстерилизационной очистке и обязательно высушиваются в сушильном шкафу при температуре 85°С до исчезновения видимой влаги. Полный цикл составляет до 150 минут. Преимущество стерилизации горячим воздухом по сравнению с паровым методом состоит в низкой себестоимости оборудования. Недостатками являются: длинный полный цикл стерилизации (не менее 30 мин), опасность повреждения инструментов высокими температурами, невозможность стерилизации тканей и пластмасс, только один контрольный параметр - температура, высокие энергозатраты. В медицинских учреждениях используются воздушные аппараты различных конструкций. Размеры, производительность, функциональные свойства и другие показатели определяются назначением стерилизуемых объектов, количественной потребностью стерильного материала, местными условиями и возможностями. Воздушные стерилизаторы состоят из следующих основных узлов: корпуса с теплоизоляцией, крышки, подставки, стерилизационной камеры. Внутри камеры расположены загрузочные сетки для размещения предметов, подлежащих стерилизации. Стерилизационные камеры обычно нагреваются электронагревателями. На передней стенке подставки смонтированы реле времени со шкалой отсчета, предназначенное для установки длительности цикла стерилизации, сигнальная лампа для контроля начала стерилизации, тумблер, предназначенный для включения стерилизатора на выбранный режим работы. Сверху на корпусе стерилизатора установлен термометр для контроля температуры внутри стерилизационной камеры и электроконтактный термометр для автоматического поддержания заданной температуры в стерилизационной камере. Конструкция стерилизатора обеспечивает его работу в автоматическом и полуавтоматическом режиме. 1.3 Гласперленовая стерилизация Гласперленовая стерилизация осуществляется в стерилизаторах, стерилизующим средством в которых является среда нагретых стеклянных шариков при рабочей температуре 190-330°С. При стерилизации сухие инструменты помещают в среду раскаленных стеклянных гранул на глубину более 15 мм. Этим методом могут быть простерилизованы только инструменты, размер которых не превышает 52 мм, они должны быть целиком погружены в камеру на 20-180 с в зависимости от размера. После стерилизации изделия используются сразу по назначению. Высокая рабочая температура и невозможность полного погружения инструментов в стерилизующую среду ограничивают возможность стерилизации широкого ассортимента медицинских изделий. Гласперленовый способ предназначен для быстрой стерилизации цельнометаллических инструментов, не имеющих полостей, каналов и замковых частей. Инструмент погружается в среду мелких стеклянных шариков, нагретых до 190–2900С, так, чтобы над рабочей поверхностью инструмента оставался слой шариков не менее 1 см. Время выдержки составляет 20–180 сек, в зависимости от размера и массы инструмента. Гласперленовый способ используется в стоматологии для экспресс-стерилизации мелких инструментов (боров, пульпоэкстракторов, корневых игл), а также рабочих частей более крупных инструментов (зондов, гладилок, шпателей). Так же можно стерилизовать акупунктурные иглы. Гласперленовый стерилизатор может находиться в рабочем состоянии в течение дня. Стерилизуемые инструменты не затупляются и не ржавеют. Гласперленовый метод используется для стерилизацции стоматологического инструментарияв европейских странах и Израиле с 1997 года. Однако он не одобряется в США, так как при гласперленовой стерилизации инструмент стерилизуется не полностью, а только его рабочая зона. Его можно использовать только вместе с химической стерилизацией. 1.4 Стерилизация газовым методом Для газового метода стерилизации применяют смесь окиси этилена и бромистого метила в весовом соотношении 1 : 2,5 соответственно (ОБ), окись этилена, пары раствора формальдегида в этиловом спирте, озон. Стерилизацию смесью ОБ и окисью этилена осуществляют при температуре не менее 18°С, 35°С и 55°С, парами раствора формальдегида в этиловом спирте при температуре 80°С. Перед газовой стерилизацией изделия после предстерилизационной очистки подсушивают до исчезновения видимой влаги. Удаление влаги из полостей изделий производят с использованием централизованного вакуума, а при его отсутствии с помощью водоструйного насоса, подсоединенного к водопроводному крану. При стерилизации ОБ и окисью этилена удаляют воздух до давления 0,9 кгс/см2. При использовании портативного аппарата после окончания стерилизации его выдерживают в вытяжном шкафу на протяжении 5 часов. Озоном, вырабатываемым в озоновом стерилизаторе С0-01 -СПБ, стерилизуют изделия простой конфигурации из коррозионностойких сталей и сплавов, в неупакованном виде при температуре не более 40°С. Цикл стерилизации (выход на режим, стерилизация, дезактивация) составляет 90 минут. После стерилизации инструменты используют по назначению сразу без дополнительного проветривания. Срок сохранения стерильности изделий 6 часов, при соблюдении правил асептики. При упаковке в стерильную двухслойную х/б ткань срок стерильности составляет 3 суток, а при содержании в камере с бактерицидными облучателями - 7 суток. 1.5 Инфракрасное воздействие Новые методы стерилизации нашли свое отражение в стерилизаторе инфракрасным излучением, предназначенном для стерилизационной обработки металлических медицинских инструментов в стоматологии, микрохирургии, офтальмологии и других областях медицины. Высокая эффективность ИК-стерилизующего воздействия обеспечивает полное уничтожение всех исследованных микроорганизмов. ИК-стерилизатор имеет следующие характеристики: быстрый, в течение 30 секунд, выход на режим 200°С, короткий цикл стерилизационной обработки - от 1 до 10 минут, в зависимости от выбранного режима, наряду с низкой энергоемкостью, несравнимы по эффективности ни с одним из применяемых до настоящего времени методов стерилизации. ИК-стерилизатор прост в эксплуатации, не требует специально обученных операторов, а сам метод относится к экологически чистым технологиям. В отличие от паровой, воздушной или гласперленовой стерилизации, при ИК-стерилизации отсутствует агрессивное воздействие стерилизующего агента (инфракрасного излучения) на режущий инструмент. Недостатки инфракрасной стерилизации: – отсутствие возможности стерилизовать инструменты упакованными; – ограниченная приемлемость из-за повреждающего действия на полимерные материалы (пластмассу, резину и т.д.); – химические средства контроля работы инфракрасных стерилизаторов отсутствуют. 1.6 Стерилизация растворами химических средств Данный метод применяют для стерилизации изделий, материалы которых не являются термоустойчивыми, и применение других официально рекомендуемых методов невозможно. Недостатком данного метода является то, что изделия нельзя стерилизовать в упаковке и по окончании стерилизации их необходимо промыть стерильной жидкостью (водой или 0,9% раствором натрия хлорида), что при нарушении правил асептики может привести к вторичному обсеменению микроорганизмами простерилизованных изделий. Для химических средств применяют стерильные емкости из стекла, термостойких пластмасс, выдерживающих стерилизацию паровым методом, металлов, покрытых эмалью. Температура растворов, за исключением специальных режимов применения перекиси водорода и средства Лизоформин 3000, должна быть не менее 20°С для альдегидсодержащих средств и не менее 18°С для остальных средств. Разъемные изделия стерилизуют в разобранном виде. Во избежание нарушения концентрации стерилизационных растворов, погружаемые в них изделия должны быть сухими. Цикл обработки составляет 240-300 минут, что является существенным недостатком метода. Кроме того, недостатком является высокая стоимость дезинфектантов. Преимущество - нет специального оборудования. Промытые стерильные изделия после удаления жидкости из каналов и полостей используют сразу по назначению или после упаковки в двухслойную стерильную х/б бязь, помещают в стерильную коробку, выложенную стерильной простыней, на срок не более 3 суток. Все работы по стерилизации изделий проводятся в асептических условиях в специальных помещениях, подготавливаемых, как операционный блок (кварцевание, генеральная уборка). Персонал использует стерильную спецодежду, перчатки, очки. Ополаскивание изделий проводится в 2-3 сменах стерильной воды, по 5 минут в каждой. 2. Контроль эффективности стерилизации Контроль эффективности стерилизации осуществляется физическими, химическими и бактериологическими методами. К физическим методам контроля относятся: измерение температуры, давления и времени применения стерилизации. Для проведения химического контроля на протяжении десятилетий применялись химические вещества, имеющие температуру плавления, близкую к температуре стерилизации. Такими веществами были: бензойная кислота - для паровой стерилизации; сахароза, гидрохинон - для контроля воздушной стерилизации. Если происходило расплавление и изменение цвета указанных веществ, то результат стерилизации признавался удовлетворительным. Поскольку применение вышеуказанных индикаторов является недостаточно достоверным, в настоящее время внедрены в практику контроля термических методов стерилизации химические индикаторы, цвет которых изменяется под воздействием температуры, адекватной для конкретного режима, для определенного времени, необходимого для реализации данного режима. По изменению окраски индикаторов судят об основных параметрах стерилизации - температуре и продолжительности стерилизации. С 2002 года в России введен в действие ГОСТ РИСО 11140-1 «Стерилизация медицинской продукции. Химические индикаторы. Общие требования», в котором химические индикаторы распределены на шесть классов: стерилизация медицинский гласперленовый К 1 классу отнесены индикаторы внешнего и внутреннего процесса, которые размещаются на наружной поверхности упаковки с медицинскими изделиями или внутри наборов инструментов и операционного белья. Изменение цвета индикатора указывает на то, что упаковка подверглась процессу стерилизации. Ко 2 классу относят индикаторы, которые не контролируют параметры стерилизации, а предназначенные для применения в специальных тестах, например, на основании таких индикаторов оценивают эффективность работы вакуумного насоса и наличие воздуха в камере парового стерилизатора. К 3 классу относятся индикаторы, при помощи которых определяется один параметр стерилизации, например, минимальная температура. Однако они не дают информации о времени воздействия температуры. К 4 классу относят многопараметровые индикаторы, изменяющие цвет при воздействии нескольких параметров стерилизации. Примером таких индикаторов являются индикаторы паровой и воздушной стерилизации одноразового применения ИКПВС-«Медтест». К 5 классу относят интегрирующие индикаторы, реагирующие на все критические параметры метода стерилизации. К 6 классу относят индикаторы-эмуляторы. Индикаторы откалиброваны по параметрам режимов стерилизации, при которых они применяются. Эти индикаторы реагируют на все критические параметры метода стерилизации. Эмулирующие индикаторы являются наиболее современными. Они четко регистрируют качество стерилизации при правильном соотношении всех параметров - температуры, насыщенного пара, времени. При несоблюдении одного из критических параметров индикатор не срабатывает. Все операции с индикаторами - выемка, оценка результатов - осуществляются персоналом, проводящим стерилизацию. Оценку и учет результатов контроля проводят, оценивая изменения цвета начального состояния термоиндикаторной метки каждого индикатора, сравнивая с цветовой меткой эталона сравнения. Если цвет конечного состояния термоиндикаторной метки всех индикаторов соответствует цветовой метке эталона сравнения, это свидетельствует о соблюдении требуемых значений параметров режимов стерилизации в стерилизационной камере. Допускаются различия в интенсивности глубины окраски термоиндикаторной метки, обусловленные неравномерностью допустимых значений температуры в различных зонах стерилизационной камеры Для проведения бактериологического контроля в настоящее время применяются биотесты, имеющие дозированное количество спор тест-культуры. Существующая методика позволяет оценивать эффективность стерилизации не ранее чем через 48 часов, что не позволяет применять уже простерилизованные изделия до получения результатов бактериологического контроля. Биологический индикатор представляет собой препарат из патогенных спорообразующих микроорганизмов с известной высокой устойчивостью к данному типу стерилизационного процесса. Задачей биологических индикаторов является подтверждение способности стерилизационного процесса убивать устойчивые микробные споры. Это наиболее критичный и достоверный тест стерилизационного процесса. Применяются биологические индикаторы в качестве контроля загрузки: если результат положительный (микробный рост), то использовать данную загрузку нельзя и необходимо отозвать все предыдущие загрузки до последнего отрицательного результата. Для получения достоверного биологического ответа следует использовать только те биологические индикаторы, которые соответствуют международным стандартам ЕК 866 и ISO 11138/11135. При использовании биологических индикаторов возникают определенные трудности - необходимость наличия микробиологической лаборатории, обученного персонала, продолжительность инкубации многократно превышает длительность стерилизации, необходимость карантина простерилизованных изделий до получения результатов. Из-за указанных выше трудностей в применении биологического метода в амбулаторной стоматологической практике обычно используется физический и химический метод контроля эффективности стерилизации. Список использованной литературы Мороз Б. Т., Мироненко О. В. – «Особенности дезинфекции и стерилизации в амбулаторной стоматологии», 2016г. Борисов Л. Б. – «Медицинская микробиология, вирусология и имуннология», 2016 Глухов, А. А. Основы ухода за хирургическими больными. - Москва: ГЭОТАР-Медиа, 2017. - 288 Гостищев, В. К. Общая хирургия: учебник. - 5-е изд., перераб. и доп. - Москва: ГЭОТАР-Медиа, 2016. - 728 с |
