СРС ИММУНКА. Реферат Tolllike рецепторы
 Скачать 293.48 Kb. Скачать 293.48 Kb.
|
|
МИНИСТЕРСТВО ЗДРАВОХРАНЕНИЯ РФ ВОЛГОГРАДСКИЙ ГОСУДАРСТВЕННЫЙ МЕДИЦИНСКИЙ УНИВЕРСИТЕТ КАФЕДРА ИММУНОЛОГИИ И АЛЛЕРГОЛОГИИ РЕФЕРАТ «Toll-like рецепторы» Выполнил: студент 3 курса педиатрического факультета 7 группы Ткаченко Владислав Юрьевич  Проверил ПроверилВолгоград 2021г Содержание 1. Введение 2. Открытие 3. Строение 4. Доказательство значимости 5. Лиганды TLR 6. Механизмы 7. Участие во врожденном и приобретенном иммунитете 8. Противоопухолевая терапия 9. Опухолестимулирующая активность 10. Вывод Введение Toll like рецепторы (TLR) — эволюционно консервативные белковые структуры, рассматриваемые как ключевой компонент врожденного и приобретенного иммунитета у млекопитающих. TLR, опосредующие распознавание молекулярных структур патогенов, экспрессируются на клетках разных типов, инициируя развитие иммунных реакций при связывании с различными лигандами. Несмотря на то, что у ряда организмов идентифицированы функциональные TLR, их биологическая роль и механизмы функционирования до конца не изучены. Толл-подобные рецепторы (TLR) являются главными компонентами системы врожденного иммунитета, которые опосредуют специфическое распознавание эволюционно консервативных молекулярных структур патогенов (PAMP pathogen associated molecular patterns). Толл-подобные рецепторы представлены на клетках разного типа от эпителиальных до иммунокомпетентных. Как известно, при связывании TLR с собственными лигандами происходит активация ряда адаптерных белков и киназ, которые участвуют в индукции ключевых провоспалительных факторов. Итогом такой индукции является развитие как врожденного иммунного ответа в результате усиления экспрессии ряда антиапоптотических белков, провоспалительных цитокинов, антибактериальных белков, так и приобретенного иммунного ответа через созревание дендритных клеток, презентации антигена и т.д. Открытие TLR TLRs впервые выявлены у дрозофилы. Это стало открытием, за которое в 2011 г. авторы Ботлер (США), Хофман (Люксембург) и Стейман (Канада) были удостоены Нобелевской премии. Основная биологическая роль TLRs у дрозофил связана с защитой против инфекций и участием в процессах регенерации. В последующем TLRs выявлены Меджитовым, на клетках млекопитающих было показано, что они имеют общий цитоплазматический домен с интерлейкин 1 рецептором. К настоящему времени TLRs обнаружены у человека. Первые идентифицированные паттерны Распознавание патогенов микробного происхождения является основополагающим компонентом иммунного ответа, включающим воспаление. Этот ответ опосредуется рецепторами особого семейства, узнающими наиболее общие молекулярные компоненты (паттерны, PAMP – Pathogen Associated Molecular Patterns) микробов (вирусов, бактерий, паразитов и т.д.) и получившими название PRR (Pattern Recognition Receptors). После узнавания соответствующего специфического паттерна PRR запускают серию сигнальных каскадов, которые представляют собой первую линию защиты от микробов. Кроме того, инициируемый PRR сигнал запускает созревание дендритных клеток, которые подготавливают вторую линию иммунного ответа на инфекцию, известную как приобретенный иммунитет. Toll-подобные рецепторы были первыми идентифицированными PRRs Строение Toll-like рецепторов Все TLRs имеют сходное строение и представляют собой интегральные трансмембранные гликопротеины, содержащие 2 домена. Поверхностная зона молекулы, ответственная за связывание лиганда, представлена N-концевой областью аминокислотной последовательности из 19—25 повторяющихся участков, обогащенных лейцином. Далее следует переходный участок, отвечающий за прикрепление рецептора к клеточной мембране, обогащенный цистеином. Внутренняя дистальная часть рецептора представлена TIR (Toll/IL- receptor) доменом, получившим свое название из-за одинакового строения этого участка у TLRs и у рецепторов цитокинов семейства IL-1. Этот домен участвует в трансдукции сигнала от активированного рецептора внутрь клетки. Доказательство значимости Toll-like рецепторов Важное значение участия TLRs в деятельности иммунной системы было доказано в экспериментальных работах на нокаут-мышах, имеющих искусственно вызванные мутации генов различных TLRs. Так, мыши, имеющие мутацию гена, кодирующего TLR4, погибали при инфицировании 1—2 колониеобразующими единицами (КОЕ) Salmonela typhimurium, в то время как у нормальных животных гибель происходила при введении более 2000 КОЕ этих бактерий. В других экспериментах была показана высокая восприимчивость TLR4-дефицитных мышей к Escherichia coli, Neisseria meningitides и Candida albicans. Подобные результаты были получены и при изучении роли TLRs в защите от вирусных инфекций. Опубликованы результаты исследований, в которых показано участие TLRs при развитии опухолей. LRs распознают определенные наборы микробных продуктов, что позволяет организму обнаружить большую часть видов патогенов, которыми он может быть инфицирован. В зависимости от локализации TLRs в клетке выделяют рецепторы, расположенные в цитоплазматической мембране (TLR1, TLR2, TLR4, TLR5, TLR6, TLR10 и TLR11) или в мембранах внутриклеточных органелл (TLR3, TLR7, TLR8 и TLR9) — лизосом, эндосом, аппарата Гольджи. Лигандами рецепторов, локализованных на цитоплазматической мембране, являются поверхностные структуры микроорганизмов — липопротеин, липополисахариды, флагеллин, зимозан. Рецепторы, локализованные в мембранах внутриклеточных органелл, распознают молекулы ядерных структур микроорганизмов, но могут быть активированы и поврежденными молекулярными структурами собственного организма. Каждый TLR обнаруживает различные PAMPs вирусного, бактериального и другого происхождения. В настоящее время у человека и мыши идентифицированы 10 и 12 функциональных TLR, соответственно. 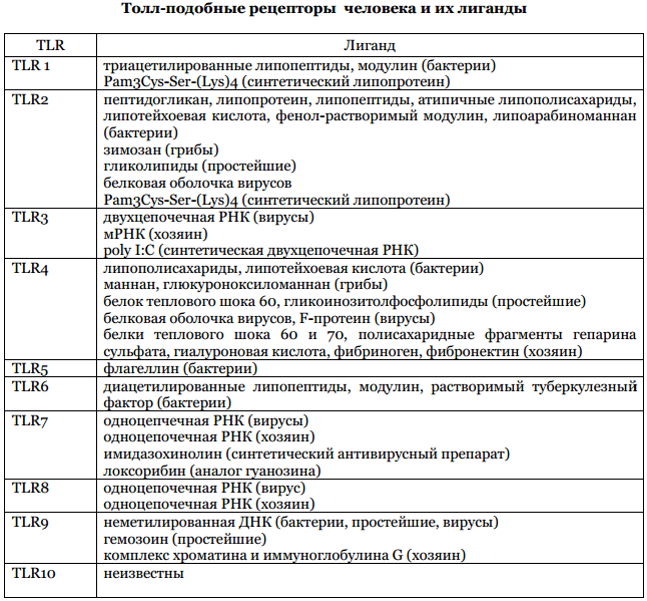 Механизмы Toll-like рецепторовВ состоянии покоя неактивированные TLRs находятся на мембране клеток в мономерной форме. После активации Toll-подобных рецепторов происходит их олигомеризация. Олигомерный рецептор способен связывать несколько внутриклеточных адаптерных белков, которые обеспечивают последующую передачу сигнала. Эти белки имеют участок специфического связывания с активированными Toll-подобными рецепторами, TIR (от англ. Toll-interleukin-1 receptor) домен, который состоит из 3 консервативных участков, участвующих в белок-белковом взаимодействии. Всего существует 5 адаптерных белков с TIR-доменом: MyD88, TIRAP, TRIF, TRAM и SARM. Различные рецепторы имеют свой набор этих адаптерных белков, необходимых для передачи сигнала. Только рецептор TLR4 способен связывать все 5 белков. Изменением конформации TIR-домена, который связывается с адапторной молекулой MyD88 (myeloid differentiation protein 88), необходима для привлечения киназ семейства IRAK (IL-1 receptor associated kinase). После активации IRAK взаимодействует с внутриклеточным фактором TRAF6 (TNF receptor associated factor 6), в результате чего происходит высвобождение ядерного фактора каппа-В (NF-κB) и транслокация его в ядро клетки. Связываясь с промоторными участками генов, ядерный фактор активирует синтез провоспалительных цитокинов, молекул адгезии, костимулирующих молекул с последующей активацией структур адаптивного иммунитета. Известен также механизм MyD88-независимой передачи активационных сигналов от TLRs. Его принципиальным отличием является то, что TIR-домен взаимодействует с адапторной молекулой TRIF (TIRdomain containing adaptor inducing IFNβ) с последующей активацией внутриклеточного фактора IRF3 (interferon regulatory factor 3), индуцирующего экспрессию генов интерферонов α и β (IFNα и IFNβ), являющихся важнейшими молекулами для дифференцировки Т-лимфоцитов. Биологическое значение активации механизмов врожденного иммунитета эндогенными молекулами заключается в том, что иммунная система адекватно реагирует на сигналы иммунной опасности. Подобный механизм обеспечивает своевременное выведение из организма модифицированных эндогенных молекул и поддержание антигенного гомеостаза. Гиперактивацию TLRs можно рассматривать как один из механизмов иммунопатогенеза различных заболеваний, т.к. это приводит к чрезмерному воспалению и повреждению тканей. Участие Toll-like рецепторов во врожденном иммунитете Участие TOLL LIKE Рецепторов во врожденном иммунитете обеспечивается: Инициацией выделения провоспалительных цитокинов, необходимых для физиологического иммунологического ответа при различных воздействиях, среди которых одно из центральных мест занимают различные инфекции; регуляцией активности нейтрофилов; особую роль при этом играют TLR-2 и TLR-4, первый из которых защищает клетки от апоптоза, а второй проявляет себя как важный регулятор выживаемости нейтрофилов; контролем активации, дифференциации и выживаемости В-лимфоцитов, в котором активное участие принимают TLR-2, TLR-4 и TLR-9 (этот путь активации В-лимфоцитов сопровождается усилением выброса кальция, фосфорилированием некоторых киназ, усилением эндоцитоза, синтеза иммуноглобулинов и рассматривается как альтернативный путь активации В-лимфоцитов); обеспечением поддержания врожденного иммунитета кишечника, что связано с экспрессией TLRs эпителиальными клеками его слизистой; участием в функционировании клеток центральной нервной ситемы, большинство которых экспрессируют TLRs (микроглия, нейроны, астроциты, эндотелиальные клетки сосудов мозга), имеются данные о дифференцированном влиянии TLRs на функции микроглии Участие Toll-like рецепторов в приобретенном иммунитете Участие TOLL LIKE Рецепторов в приобретенном иммунитете обусловлено: Активацией CD4- и CD8-T-лимфоцитов; стимуляцией функций различных антиген-распознающих клеток: дендритных, которые экспрессируют TLR-2, TLR-3, TLR-4, TLR-7, TLR-9; активацией макрофагов, тучных клеток, в частности, с участием TLR-9, что особенно выражено при действии генетического материала ДНК-вирусов бактерий, грибов; активным включением в экспансию и функционирование регуляторных клеток — T-reg, которые экспрессируют высокий уровень TLR-4, TLR-5, TLR-7 и TLR-8; регуляции гомеостаза фибробластов, миофибробластов, фибробластоподобных синовиоцитов, эндотелиальных и эпителиальных клеток, в частности, с участием TLR-2, TLR-4, TLR-6; регуляцией клеток нормального эпителия (TLR-2, TLR-3, TLR-4, TLR-5), а также клеток эндотелия; потенцированием приобретенного иммунитета с включением различных механизмов Роль TLR в терапии злокачественных новообразований Благодаря своей способности усиливать специфические и неспецифические иммунные реакции организма агонисты Толл-подобных рецепторов нашли применение не только в терапии инфекционных заболеваний, но также в качестве адъювантов в химиотерапии различных злокачественных новообразований. Однако к настоящему моменту описаны принципиально различные эффекты TLR на опухоли. С одной стороны, показано, что TLR (и их лиганды) могут выступать в роли супрессоров опухолевого роста, с другой стороны, TLR могут стимулировать опухолевую прогрессию и влиять на устойчивость опухолей к химиотерапии. В представленном обзоре обобщены данные о влиянии TLR и их агонистов на рост опухоли, а также проанализированы основные механизмы, лежащие в основе таких различий.……………………………………………… Многие агонисты TLR в настоящее время проходят клинические испытания в качестве противоопухолевых средств. Так, природные и синтетические агонисты TLR7 и 8 показали высокую активность в отношении хронического лимфоцитарного лейкоза и опухолей кожи. Лиганд TLR9 - cpG, способен подавлять рост лимфом, опухолей головного мозга, почек, кожи. А лиганд TLR3 - poly(IC) обладает проапоптотическим действием не только в отношении опухолевых клеток, но и клеток окружения (например, эндотелия). Показано, что агонисты TLR4 - ЛПС грамотрицательных бактерий и ОК-432 (препарат из стрептококков группы А), обладают высокой противоопухолевой активностью при внутриопухолевом введении. Однако при системном введении оба препарата (ЛПС и ОК-432) не обладали способностью блокировать опухолевый рост. В настоящее время препарат ОК-432 проходит вторую стадию клинических испытаний, в качестве средства против колоректальных опухолей. Опухолестимулирующая активность Как известно, хронические инфекции и воспаление являются важнейшими факторами, стимулирующими развитие злокачественных новообразований. В частности, рак желудка может быть связан с хроническим воспалением, вызванным таким патогеном, как Helicobacter pylori, а хроническое воспаление пищеварительного тракта часто ассоциировано с развитием рака толстой кишки. Более того, показано, что применение нестероидных противовоспалительных препаратов может снижать риск развития некоторых типов злокачественных новообразований. TLR служат ключевым звеном системы врожденного иммунитета человека и животных, они участвуют в развитии воспалительных реакций при контакте клеток с различными патогенами. В настоящее время активно изучается роль TLR в развитии и прогрессии опухолей различного происхождения. TLR могут быть вовлечены в процесс развития и стимуляции опухолеобразования посредством нескольких механизмов. Один из важнейших факторов, обусловливающих взаимосвязь хронического воспаления и опухоле-образования - NF-kB. Этот фактор конститутивно активирован более чем в 90% опухолей человека, включая острый и хронический миелоидный лейкоз, рак предстательной железы, множественную миело-му, злокачественную гепатому (рак печени) и т.д. В связи с этим агенты, способные активировать NF-kB, могут непосредственно участвовать в процессе развития и прогрессии опухоли. Как известно, взаимодействие патогенов с TLR на поверхности клетки приводит к активации NF-kB и экспрессии NF-kB-зависимых генов, что и обусловливает участие TLR в стимуляции канцерогенеза. Активация NF-kB приводит к повышению продукции цитокинов IL-1, IL-2, IL-6, IL-10, TNF-a; миграции клеток иммунной системы к месту воспаления в результате повышения продукции хемокинов; «поддержанию» хронического воспаления; повышению продукции антиапоптотических факторов и т.д. Указанные свойства могут обеспечивать выживаемость и прогрессию опухоли за счет подавления апоптоза и цитотоксичности, а также индукции ангиогенеза. В настоящее время известно, что уровень TLR повышен в клетках различных опухолей, и у мышей с нокаутом генов ТLR снижена частота образования индуцируемых опухолей. Более того, повышение экспрессии TLR на поверхности клеток опухоли предстательной железы или опухоли головы и шеи может стимулировать их пролиферацию. Однако способностью стимулировать канцерогенез через взаимодействие с TLR обладают не только различные инфекционные агенты и их структурные компоненты. Как известно, лигандами для TLR служат также DAMP - ядерные и цитоплазматические белки клеток, подвергшихся некрозу. Высвобождаемые из поврежденных клеток DAMP могут распознаваться различными TLR на поверхности иммунных клеток, а последующая активация TLR-зависимых сигналов способна приводить к подавлению противоопухолевого иммунного ответа и, как следствие, к стимуляции прогрессии опухоли. К таким молекулам, обладающим потенциальным опухолестимулирующим действием, относятся: белки теплового шока (HSP60, 70), АТР и мочевая кислота, семейство Са2+-модулирующих белков (S100), белок HMGB1 и нуклеиновые кислоты, из которых наиболее хорошо изучен ДНК-связывающий белок HMGB1. Высвобождаемый в результате повреждения клеток белок HMGB1 активирует иммунную систему через взаимодействие с TLR. На культурах клеток показано, что белок HMGB1 стимулирует рост клеток меланомы, рака молочной железы, толстой кишки, поджелудочной и предстательной железы. HMGB1 способен активировать TLR2 и TLR4 на опухолевых клетках и клетках иммунной системы и, как следствие, индуцировать опухолевую прогрессию и метастазирование. Показано, что в клетках меланомы повышена экспрессия таких DAMP, как белки семейства S100, способные стимулировать рост и самих клеток меланомы, и лимфоцитов периферической крови, действуя как аутокринный фактор роста опухоли. Суммируя описанные эффекты, можно сделать вывод о способности TLR, с одной стороны, прямо или опосредованно участвовать в опухолевой прогрессии, а с другой - повышать устойчивость опухолевых клеток к проапоптотическим воздействиям. Представленные данные показывают, что опухолестимулирующие эффекты TLR и их лигандов имеют сложный механизм, который необходимо изучать более детально. Выводы ТLR входят в состав семейства PRR. Эффекты, связанные с их активацией, выходят за рамки реакций врожденного иммунного ответа. Участие в активации дендритных клеток, регуляции специфических иммунных реакций на уровне Т- и В-клеток, повышение экспрессии IFN и др. обусловливают вовлечение ТLR в формирование эффективного ответа врожденной и адаптивной иммунной системы при попадании в организм различных патогенов или при поддержании тканевого гомеостаза. Опубликованы результаты многочисленных исследований, согласно которым лиганды к TLR могут использоваться в качестве адъювантов для иммунотерапии злокачественных новообразований. Однако известно, что активация ТLR на поверхности опухолевых клеток может приводить к усилению прогрессии опухолей различного происхождения. Такое различие в эффектах зависит, в первую очередь, от типа используемого лиганда. Такое двоякое влияние ТLR говорит о более сложной функциональной роли TLR в биологии опухоли. Понятно, что подобная роль TLR выходит за рамки простой активации фактора NF-kB. Изучать влияние различных лигандов TLR на опухоль необходимо с учетом многих факторов, включая уровень экспрессии TLR; тип ткани, из которой происходит опухоль; микроокружение опухоли и многие другие. Системное исследование функций и роли ТLR может внести существенный вклад в разработку как новых противоопухолевых средств с TLR-зависимым механизмом действия, так и раскрыть другие возможные эффекты влияния системы TLR. Список литературы: 1.Ковальчук, Л. В., Свитич, О. А., Ганковская, Л. В., Мироншиченкова, А. М., & Ганковский, В. А. (2012). Роль Toll-подобных рецепторов в патогенезе инфекционных заболеваний человека. Курский научно-практический вестник «Человек и его здоровье», (2), 147-153. 2. Щебляков, Д. В., Логунов, Д. Ю., Тухватулин, А. И., Шмаров, М. М., Народицкий, Б. С., & Гинцбург, А. Л. (2010). Тoлл-подобные рецепторы (tlr) и их значение в опухолевой прогрессии. Acta Naturae (русскоязычная версия), 2 (3), 28-37. 3. Ковальчук Л.В., Ганковская Л.В., Мешкова Р.Я. Клиническая иммунология и аллергология с основами общей иммунологии. - М.: ГЭОТАР-Медиа, 2011. -234 с 4. Benfey PN, Mitchell-Olds T. From genotype to phenotype: systems biology meets natural variation. Science 2008, 320:495-497 5. Ярилин А.А. Иммунология. - М.: ГЭОТАР-Медиа, 2010. - 562 с. |
