Решение 2RuCl 3 6C 5 h 6( Etoh рр) 3Zn 2Cp 2 Ru2C 5 h 8 3ZnCl 2
 Скачать 83.29 Kb. Скачать 83.29 Kb.
|
|
1. Напишите уравнения следующих химических превращений, не используя вещества, содержащие Ru в качестве реагентов: 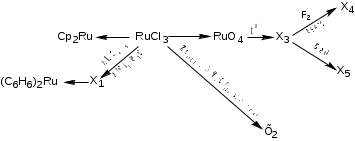 X1, X2, X3, X4-вещества, содержащие Ru (8 баллов) Решение: 2RuCl3+6C5H6(EtOH р-р)+3Zn = 2Cp2Ru+2C5H8+3ZnCl2 3RuCl3+2Al+6C6H6 = 3[(C6H6)2Ru]Cl+2AlCl3 2RuCl3+7Zn(пыль)+6NH4Cl(аммиачный р-р) = [Ru(NH3)6]Cl2+7ZnCl2 RuCl3+KMnO4(H+) = RuO4+MnCl2+KCl RuO4, t°C 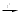 RuO2+O2 RuO2+O2RuO2+2F2  RuOF4 RuOF4RuO2+BaO = BaRuO3 6[(C6H6)2Ru]Cl+Na2S2O4+8KOH = 4(C6H6)2Ru+Na2SO4+K2SO4+6KCl+4H2O X1 – [(C6H6)2Ru]Cl, X2 – [Ru(NH3)6]Cl2, X3 – RuO2, X4 – RuOF4, X5 – BaRuO3. 2. В четырёх пробирках находятся голубые разбавленные растворы Na4[Co(S2O3)3], (Cp2Fe)Cl, [Cu(NH3)4]SO4, [Cr(H2O)6]Cl2 «практически неразличимые» по цвету. Предложите химический способ определения каждого вещества. Напишите уравнения всех предложенных Вами химических реакций. (6 баллов) Решение:
Na4[Co(S2O3)3]+6HCl = CoCl2+4NaCl+3SO2+3S+3H2O (Cp2Fe)Cl+FeCl2 = Cp2Fe + FeCl3 [Cu(NH3)4]SO4+2NaOH+4H2O = Cu(OH)2+Na2SO4+4NH3* H2O [Cr(H2O)6]Cl2+2NaOH = Cr(OH)2+NaCl+6H2O 3. Вещество А серебристо-белый металл, в нормальных условиях не реагирующий с воздухом и водой, но при нагревании с ними может образовывать твёрдое белое вещество B, а также растворяется в щелочах с образованием вещества C. Вещество B используется в изобразительном искусстве как дешёвый и менее качественный аналог титанового соединения. Также вещество B можно получить разложением при 750°C соли D, которую можно получить реакцией вещества A с горячей концентрированной серной кислотой. Тетрафторборат вещества A тоже разлагается при нагревании с образованием вещества E. Вещество A может реагировать с соляной кислотой, при этом получается соль F, которая применяется в производстве огнеупорных материалов, дезодорантов и при деревообработке. При реакции соли G с гидридом натрия в тетрагидрофуране образуется соединение H. Соль G можно получить реакцией, которую в 1849 г провёл Э. Франкланд, пытаясь получить этильный радикал, используя C2H5J и вещество A, однако он получил соль G, и пирофорную жидкость J. При нагревании вещества А с серой получается бинарное соединение K, которое используется в флюоресцентных красках. (10 баллов) Решение:
Вещество A проявляет амфотерный характер, так как растворяется и в щелочах, и в кислотах. Использование в ИЗО в качестве аналога титановых белил, менее качественное, потому что ZnO желтеет или со временем, или при нагревании. Если знать, где применяется хлорид цинка (если внимательно читать «Inorganic chemistry» Хаускрофт), то становится совершенно понятно, что вещество А – цинк, и оставшиеся реакции становятся ясны. Zn+O2  ZnO ZnO Zn(порошок)+H2O(пар) 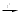 ZnO+H2 ZnO+H2Zn+2NaOH+2H2O = Na2[Zn(OH)4]+H2 ZnSO4 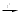 ZnO+SO3 ZnO+SO3Zn+2H2SO4(конц, гор) = ZnSO4+SO2+2H2O Zn(BF4)2 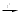 ZnF2+2BF3 ZnF2+2BF3Zn+2HCl = ZnCl2+H2 ZnJ2+2NaH 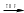 ZnH2+2NaJ ZnH2+2NaJ3C2H5J+3Zn = (C2H5)2Zn+C2H5ZnJ+ZnJ2 Zn+S 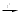 ZnS ZnS4. Минерал состава [U, Ce, Lu]PO4 обработали NaOH и O2. Предложите химический способ разделения указанной смеси и выделения Ce, Lu, U в чистом виде. Напишите уравнения всех предложенных Вами реакций, укажите условия их проведения. (разделение и синтез должны быть осуществлены кратчайшим путем) (10 баллов) Решение: [U, Ce, Lu]PO4+NaOH+O2 = U(OH)4+Ce(OH)3+Lu(OH)3 в осадок+Na3PO4 2Ce(OH)3, 2Lu(OH)3, U(OH)4+8H2SO4 = Ce2(SO4)3+Lu2(SO4)3+U(SO4)2+16H2O Ce2(SO4)3+Lu2(SO4)3+U(SO4)2+NH4OH = Ce2(SO4)3+Lu2(SO4)3+U(OH)4 осадок U(OH)4+ 2C2H2O4 = U(C2O4)2·6H2O U(C2O4)2·6H2O 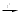 UO2+2CO2+2CO+6H2O UO2+2CO2+2CO+6H2OUO2+2C2Cl4F2 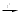 UF4+2CO+2CCl4 UF4+2CO+2CCl4UF4+2Mg 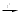 U+2MgF2 U+2MgF2Ce2(SO4)3+Lu2(SO4)3+Na2SO4 = Ce2(SO4)3. Na2SO4·12H2O осадок+Lu2(SO4)3 раствор Ce2(SO4)3. Na2SO4·12H2O+H2SO4(изб) = Ce2(SO4)3раствор+ 2NaHSO4+12H2O Ce2(SO4)3+ C2H2O4 = Ce2(C2O4)3осадок Ce2(C2O4)3 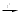 Ce2O3+3CO2+3CO Ce2O3+3CO2+3COCe2O3+6NH4Cl 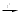 2CeCl3+3H2O+6NH3 2CeCl3+3H2O+6NH32CeCl3+3Ca 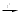 2Ce+3CaCl2 2Ce+3CaCl2Lu2(SO4)3+6HF = 2LuF3 осадок+3H2SO4 LuF3+3Ca 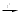 2Lu+3CaF2 2Lu+3CaF2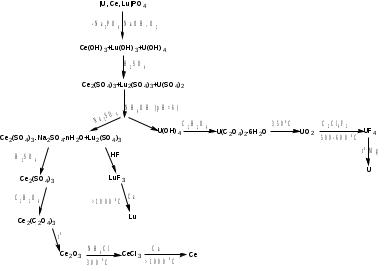 5. Сравните окислительные/восстановительные свойства Fe(II), Rh(II), Ag(II), подтвердите выводы уравнениями реакций. Приведите примеры устойчивых соединений Fe(II) и Ag(II), объясните причины их стабильности. (4 балла) Решение: Fe(II) – проявляет восстановительные свойства; Ag(II) – окислительные; Rh(II) – не обладает окислительно-восстановительными свойствами, реакции преимущественно комлпексообразовательные. [Rh(OCOR)2]2+P(Ph)3 = [Ph3PRh(OCOR)2]2 4AgF2+2H2O = 4AgF+O2+4HF 2FeV2O4+9Cl2 = 4VOCl3+2FeCl3+2O2 4FeNb2O6+14Na2CO3+O2 = 4NaFeO2+8Na3NbO4 + 14СO2 |
