Контрольная работа по физической химии. физ химия1. Решение Работу адиабатического сжатия газа рассчитаем по уравнению
 Скачать 101.82 Kb. Скачать 101.82 Kb.
|
10.2. ФИЗИЧЕСКАЯ ХИМИЯ Контрольная работа № 1 1. (1.1). 10 г. кислорода, взятого при 298 К сжимают адиабатически от 8 л. до 5 л. Определите конечную температуру и изменение внутренней энергии, если Сv=  . .Решение: Работу адиабатического сжатия газа рассчитаем по уравнению: 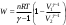 Кислород – двухатомный газ, для которого выражение темплоемкости и коэффициент 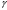 имеют следующий вид: имеют следующий вид: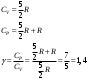 Количество газа выразим через уравнение Менделеева-Клапейрона при V1 = 8 л: 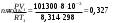 Подставим в выражение: 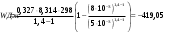 Конечную температуру рассчитаем по уравнению: 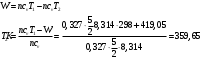 2. (1.1). Вычислить работу расширения при нагревании 2 г воздуха от 0 °С до 1 °С при давлении 1 атм. Плотность воздуха при нормальных условиях 1,29 г/см3. Решение: Так как процесс изобарный, работа рассчитывается по уравнению: 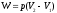 или если дано изменение температуры: 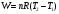 Количество молей воздуха рассчитаем из условия, что при нормальных условиях 1 моль газа занимает объем, равный 22,4 л. Массу воздуха переведем в объем: 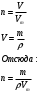 При нагревании на один градус получаем, что работа равна: 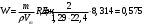 3. (1.1). Вычислить количество тепла, необходимое для нагревания 500 г свинца от 25 °С до 700 °С, если свинец плавится при 600 К и D Нпл=23,25 Дж/г. Ср(тв.)=24,489+8,954.10-3Т (Дж/моль.К), Ср(ж)=36,287-10,280.10-3Т (Дж/моль.К). Решение: Нагревание свинца протекает по трем этапам: 1. Нагревание до температуры плавления: 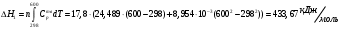 2. Процесс плавления: 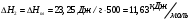 3. Процесс нагревания до 973 К: 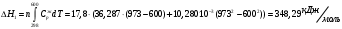 Тепловой эффект равен: 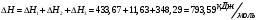 4. (1.2). Тепловые эффекты реакций при 0 °С и постоянном давлении 1 атмосфера: C+O2=CO2 -405.8 кДж CO+1/2O2=CO2 -284.5 кДж H2+1/2O2=H2O(газ)-246,8 кДж Рассчитать при тех же условиях тепловые эффекты следующих реакций: С+Н2О(газ)=СО+Н2+D Н1 2СО=СО2+С+D Н2. Решение: Для реакции С+Н2О(газ)=СО+Н2+D Н1 Составим систему уравнений: 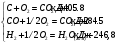 Вычитая из первого уравнения второе и третье, преобразуем систему уравнений к виду: С+Н2О(газ)=СО+Н2+D Н1: 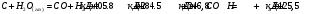 D Н1 = - 125,5 кДж Для реакции 2СО=СО2+С+D Н2 по аналогии: 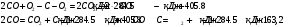 D Н2 = 163,2 кДж 5. (1.3). 1 моль кремния нагревают при 1 атм. и 25 °С до температуры плавления 1412 °С, Ср(тв.)=23,9+2,5.10-3Т (Дж/моль.К), D Hпл=50,5 Дж/моль. Рассчитайте D S процесса. Решение: Изменение энтропии при нагревании рассчитываем по уравнению: 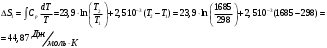 При фазовом переходе, изменение энтропии выражается отношением: 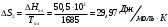 Отсюда, изменение энтропии при нагревании равно: 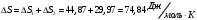 6. (2.1). Запишите равновесное число молей всех веществ и константу равновесия для реакции:
Решение: Концентрация твердого вещества считается постоянной и в уравнении для константы равновесия равны единице. Пусть в результате реакции образуется х молей Cl2 и соответственно 2х H2O, тогда концентрация HCl уменьшится на 4х молей. Константа равновесия будет равна: 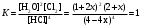 Только один корень имеет положительное значение: х = 1,13 моль. Получаем, что 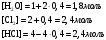 7. (2.2.-2.3). Для реакции 2C(s)+S2=2CS с помощью таблиц стандартных термодинамических величин рассчитайте константу равновесия при температуре 2200 К. Определите состав равновесной газовой фазы при 2200 К, если в исходный момент под общим давлением 1,5 атм. взяли а) стехиометрическую смесь исходных веществ, б) стехиометрическую смесь всех веществ. Как зависит выход реакции от температуры и давления. В каком направлении пойдет эта реакция при тех же температуре и давлении, если в исходный момент при той же температуре и давлении смешали по 1 молю каждого исходного вещества и по 2 моля каждого продукта реакции. Решение: Для расчета энергии Гиббса найдем изменение энтальпии и энтропии реакции с учетом молярных коэффициентов (теплоты образования веществ при 298 К – табличные значения): 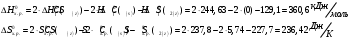 Энергия Гиббса при 2200 К равна: 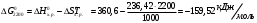 Константа равновесия: 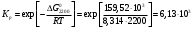 Константу равновесия можно выразить через мольные доли: 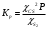 Если взяли: а) стехиометрическую смесь исходных веществ, то начальное количество продукта равно нулю. Пусть образовалось х CS, тогда равновесная концентрация S2 будет равна разности между его начальным количеством и количеством образованного продукта, то есть 1 – х/2. Подставляем в уравнение константы: 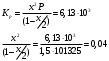 Единственным решением уравнения является корень х = 0,19. Получаем: 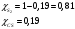 б) стехиометрическую смесь всех веществ, то есть в начальные доли соответствуют 1 молю S2 2 молям CS. Пусть также образовалось х CS, тогда равновесная концентрация S2 будет равна разности между его начальным количеством и количеством образованного продукта, то есть 1/3 – х/2, равновесная для CS равна 2/3 + х: 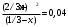 х = 0,26 Получаем: 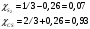 Так как в ходе реакции увеличивается количество молей газа, то повышение давления поспособствует смещению равновесия в обратном направлении с уменьшением равновесного выхода продукта. Реакция эндотермична, то есть протекает с поглощением тепла, значит, при увеличении температуры равновесие смещается в сторону образования продукта реакции. 8. (3.2). Температура кипения жидкого метанола при 200 мм рт.ст. равна 34,7 °С, а при давлении 400 мм рт.ст. – 49,9 °С. Вычислите температуру кипения под давлением 1 атм. Решение: 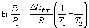 По этому уравнению можно рассчитать энтальпию испарения или возгонки, исходя из значений давления пара при двух разных температурах. Переводим значения давления и температуры в систему СИ – давление в Па, температуру – в К: 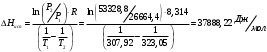 По этому же уравнению рассчитываем температуру кипения при давлении в 1 атм: 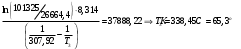 |
