Иммуноглобулин Реферат. Российский университет дружбы народов
 Скачать 0.56 Mb. Скачать 0.56 Mb.
|
|
Федеральное государственное автономное образовательное учреждение высшего образования Росси́йский университе́т дру́жбы наро́дов Медицинский институт Кафедра иммунология и аллергология Иммуноглобулины: структура и функции Механизм взаимодействия антитела с антигеном Иммунный комплекс Преподователь :Левкова Елена Анатольевна Студент: Сафари Ахмад Елтаф Москва -2020 Содержание Введение Определение Строение иммуноглобулинов Классы иммуноглобулинов Функция иммуноглобулинов Виды иммуноглобулинов по характеру действия Механизм взаимодействия антитела с антигеном Иммунные комплексы Заключение Список литератур Введение Иммуноглобулины - основные защитные белки организма, так как они обладают свойствами различных антител. Они содержатся в крови, молозиве и молоке, слюне и других жидкостях. С их количеством и активностью связаны жизнестойкость, физиологическое состояние и продуктивность животных. В работе описаны свойства иммуноглобулинов, как белков, а также способы разделения иммуноглобулинов сельскохозяйственных животных. Представленные данные по характеристике, выделению иммуноглобулинов, могут дать современные представления о защитных белках животных. Первыми из антигенраспознающих молекул были открыты антитела, которые к настоящему времени изучены полнее других молекул этой группы. Свойствами антител обладают белковые молекулы, называемые иммуноглобулинами. Таким образом, термин «иммуноглоубин» отражает химическую структуру молекулы без учета ее специфичности к конкретному антигену, а термин «антитело» определяет функциональные свойства молекулы и учитывает специфичность конкретного иммуноглобулина в отношении антигенов (обычно уточняют, к какому антигену направлены антитела). Антитела были открыты в 1890 г., когда Э. Беринг и С. Китасато установили, что сыворотки кроликов, которым вводили дифтерийный токсин, приобретали способность нейтрализовать этот токсин и оказывать лечебное действие при дифтерийной инфекции. Иммуноглобулины как разновидность белков были первоначально выявлены методом электрофореза во фракциях сывороточных γ- и β-глобулинов. Позже они были очищены методами хроматографии и подвергнуты структурному изучению с помощью ограниченного протеолиза и восстановления дисульфидных связей. Большой вклад в изучение антител внесли исследования гомогенных опухолевых (миеломных) иммуноглобулинов, которые в конечном счете привели к созданию гибридомной технологии, позволившей получать моноклональные антитела заданной специфичности. При помощи гибридом можно получать моноклональные антитела необходимой специфичности. Наконец, в конце 1970-х годов С. Тонегава открыл молекулярные основы формирования разнообразия антигенраспознающей способности антител и описал явление соматической перестройки иммуноглобулиновых генов. Определение Иммуноглобулинами называются белки, которые синтезируются под влиянием антигена и специфически с ним реагируют. При электрофорезе они локализуются в глобулиновых фракциях. Иммуноглобулины состоят из полипептидных цепей. В молекуле иммуноглобулина различают четыре структуры: 1. Первичная – это последовательность определенных аминокислот. Она строится из нуклеотидных триплетов, генетически детерминируется и определяет основные последующие структурные особенности. 2. Вторичная определяется конформацией полипептидных цепей. 3. Третичная определяет характер расположения отдельных участков цепи, создающих пространственную картину. 4. Четвертичная характерна для иммуноглобулинов. Из четырех полипептидных цепей возникает биологически активный комплекс. Цепи попарно имеют одинаковую структуру. Любая молекула иммуноглобулина имеет Y-образную форму и состоит из 2 тяжелых (Н) и 2 легких (L) цепей, связанных между собой дисульфидными мостиками. Каждая молекула ИГ имеет 2 одинаковых антигенсвязывающих фрагмента Fab (англ. Fragment antigen binding) и один Fc-фрагмент (англ. Fragment cristalisable), с помощью которого ИГ комплементарно связываются с Fc-рецепторами клеточной мембраны. Концевые участки легких и тяжелых цепей молекулы ИГ достаточно разнообразны (вариабельны), а отдельные области этих цепей отличаются особенно выраженным разнообразием (гипервариабельностью). Остальные участки молекулы ИГ относительно низменны (константны). В зависимости от строения констатных областей тяжелых цепей ИГ разделяются на классы (5 классов) и подвиды (8 подвидов). Именно эти константные области тяжелых цепей, существенно отличаясь по аминокислотному составу у различных классов ИГ, в конечном итоге определяют особые свойства каждого класса антител: IgM активируют систему комплемента; IgE связывается со специфическими рецепторами на поверхности тучных клеток и базофилов с высвобождением из этих клеток медиаторов аллергии; IgA секретируется в различные жидкости организма, обеспечивая секреторный иммунитет; IgD функционирует в основном в качестве мембранных рецепторов для антигена; IgG проявляет разнообразные виды активности, в том числе способность проникать через плаценту. Молекулы каждого класса ИГ могут существовать в виде свободных антител и в виде молекул, прикрепленных к клеточной мембране (т.е. служить в качестве рецепторов В-лимфоцитов), что обеспечивается структурными различиями концевых участков этих двух разновидностей молекул. Строение иммуноглобулинов. Полипептидные цепи. Молекулы иммуноглобулинов состоят из двух типов полипептидных цепей — тяжелых (H) и легких (L). Так называемый мономерный иммуноглобулин содержит две Н- и две L-цепи, расположенные симметрично и соединенные дисульфидными связями. Единственная дисульфидная связь, соединяющая Н- и L-цепи, локализуется недалеко от С-конца легкой цепи. Н-цепи скрепляются различным числом дисульфидных связей. Легкие цепи содержат 2, а тяжелые — 4–5 гомологичных сегмента — домена. Эти сегменты образованы примерно 110 аминокислотными остатками и имеют сходную пространственную организацию, стабилизированную одной дисульфидной связью, но различные функции. Молекулярная масса L-цепей — 50–60 кДа, Н-цепей — 100–120 кДа, мономера иммуноглобулина — 150–170 кДа. Во всех цепях N-концевой домен участвует в распознавании антигена. При анализе структуры и функций иммуноглобулинов следует различать 2 понятия: гетерогенность и вариабельность. Гетерогенность определяет свойства иммуноглобулинов , обусловленные константой (С) частью молекулы, т.е. теми структурными особенностями, которые позволяют делить всю группу этих белков на классы, подклассы, аллотипы и типы легких цепей. Гетерогенность подразумевает функциональные различия активности разных классов иммуноглобулинов за исключением их свойства специфического взаимодействия с антигеном. Вариабельность – это индивидуальная характеристика иммуноглобулинов, относящихся к одному и тому же классу, подклассу. Она проявляется в специфической антигенсвязующей активности и обусловлена меняющейся от белка к белку последовательностью аминокислотных остатков в N-концевой части молекулы. Два свойства иммуноглобулинов – гетерогенность и вариабельность – определяют функциональны дуализм данной группы белковых молекул. Главную роль при этом играет пространственное соответствие, или комплементарность, антигенраспознающей части молекулы иммуноглобулина с распознаваемым эпитопом. Специфичность иммуноглобулинов определяется первичной структурой антигенраспознающих доменов, называемых вариабельными, или V-доменами (от англ. variable). V-домены тяжелых и легких цепей (VH и VL) участвуют в формировании антигенсвязывающего участка, или активного центра антител. Структура остальных доменов молекулы иммуноглобулина постоянна. Поэтому их называют константными, или С-доменами (от англ. constant). В состав L-цепи входит 1 С-домен (СL), Н-цепей — 3 или 4 С-домена (CH1, CH2 и т.д.). С-домены определяют эффекторные функции иммуноглобулинов, не связанные с распознаванием антигена, а предназначенные для взаимодействия с рецепторами клеток, активации комплемента и т.д., что необходимо для реализации эффекторных функций антител. Выделяют два типа L-цепей — κ и λ, различающиеся строением CL-домена. Соотношение количеств к и λ — видоспецифичный и строго стабильный генетический признак: у человека оно равно 2:1, у мыши — 20:1, у кошки — 1:20. Отклонение от этого соотношения у отдельных особей имеет диагностическое значение, так как является скорее всего признаком опухолевого процесса — В-лейкоза. Функциональных различий между иммуноглобулинами с легкими к -цепями или с легкими λ-цепями до сих пор никто не выявил. Строение СН-доменов обусловливает разделение Н-цепей и молекул иммуноглобулинов на изотипы, или классы, первоначально идентифицированные серологически (т.е. с помощью сывороточных антител к раз-личным изотипам). Выделяют 5 основных изотипов Н-цепей — μ, γ, α, δ и ε. Каждая молекула иммуноглобулина может содержать Н-цепи только одного изотипа. В зависимости от структуры Н-цепей выделяют 5 классов молекул иммуноглобулинов — IgM, IgG, IgA, IgD и IgE (латинские буквы в названии иммуноглоублинов соответствуют греческим в обозначении изотипов Н-цепей). Иммуноглобулины классов IgG и IgA разделяют на подклассы (субтипы), также в зависимости от особенностей Н-цепей. У человека выделяют 4 подкласса IgG — IgG1, IgG2, IgG3, IgG4 (у мышей — IgG1, IgG2a, IgG2b, IgG3) и 2 подкласса IgA — IgA1 и IgA2. Н-цепи этих подклассов иммуноглобулинов обозначают соответствующими греческими буквами с цифрой (γ1, γ2, γ3, γ4, α1, α2). Иммуноглобулины всех классов могут принадлежать к К- и L-типам в зависимости от присутствия в их составе L-цепей κ- или λ-типов соответственно. По первичной структуре С-домены похожи. Это указывает на то, что кодирующие их структурные гены когда-то произошли путем дупликаций из общего предкового гена. По данным электронной микроскопии и рентгеноструктурного анализа кристаллов иммуноглобулинов, цепи сплетены в «косичку». Угол между двумя симметричными антигенсвязывающими центрами молекулы подвижен в диапазоне от 0 до 100° и больше. Антигенсвязывающие участки молекулы способны к ротационному движению. Все это вместе облегчает возможность связывания антигенов обоими активными центрами одновременно. Это существенно: опыт показывает, что в природе устроено так, что «достойный» иммунный ответ развивается лишь в тех случаях, когда (и если) антиген «сшивает» несколько антигенраспознающих рецепторов на поверхности лимфоцита. IgM и IgA формируют полимерные структуры: IgM из 5 «рогаток» формирует пентамер, находящийся в растворе в крови; IgA из двух «рогаток» формирует димер, но не в крови, а в составе экзосекретов на слизистых оболочках. Для полимеризации IgM и IgA включают в свой состав дополнительную полипептидную цепочку с молекулярной массой 15 000 называемую J-цепью (joint-связь). Эта J-цепь связывает терминальные цистеины на С-концах соответственно тяжелых μ- и а-цепей IgM и IgA. Домены иммуноглобулинов представляют собой глобулы, образованные двумя слоями, содержащими несколько β-складок. В С-домене β-слои содержат 4 и 3 β-складки, в V-домене — оба слоя состоят из 4 β-складок. Между слоями есть дисульфидная связь, соединяющая складки В и F и стабилизирующая структуру домена. Аналогичные домены парных полипептидных цепей повернуты на 180° относительно друг друга. Противоположную ориентацию имеют также соответствующие домены Н- и L-цепей. Домены контактируют друг с другом при помощи гидрофобных 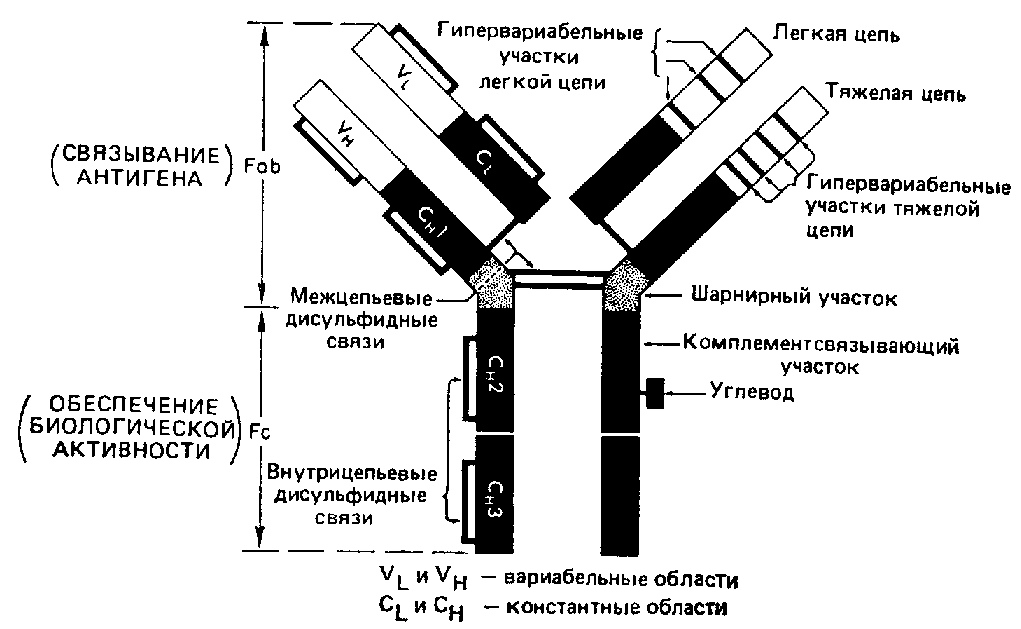 взаимодействий. взаимодействий.На схеме молекулы IgC обозначены цепи и домены, а также гипервариабельные участки вариабельных областей Н- и L-цепей. Классы иммуноглобулинов С помощью физико-химических и иммунологических методов доказано существование 5 классов ИГ у человека и от 3 до 6 у различных видов животных. Иммуноглобулины G, IgG Иммуноглобулины М, IgM Иммуноглобулины А, IgA Иммуноглобулины Е, IgE Иммуноглобулины D, IgD Функция иммуноглобулинов 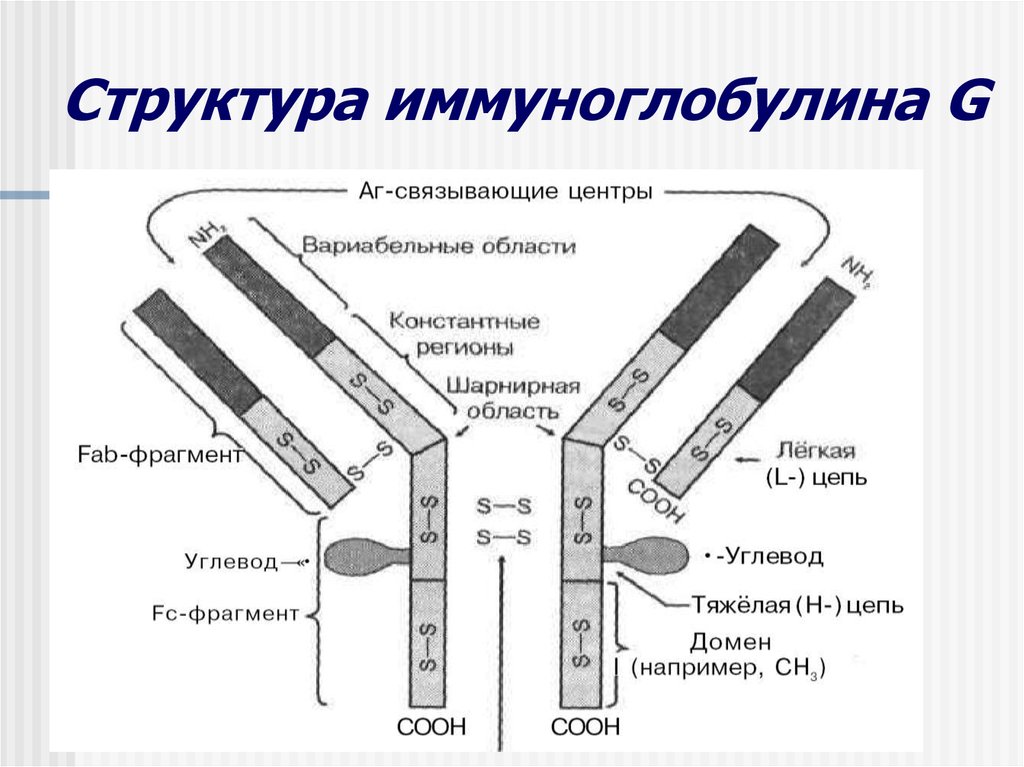 Иммуноглобулины G: Основная роль иммуноглобулина G – повышение сопротивляемости организма к разного рода патогенным микроорганизмам путем образования стойких связей «антиген-антитело». Также IgG обезвреживает некоторые бактериальные токсины, замедляет аллергические реакции, участвует в фагоцитозе (процессе определения антителами вредоносных клеток с их последующим уничтожением). Иммуноглобулины G: Основная роль иммуноглобулина G – повышение сопротивляемости организма к разного рода патогенным микроорганизмам путем образования стойких связей «антиген-антитело». Также IgG обезвреживает некоторые бактериальные токсины, замедляет аллергические реакции, участвует в фагоцитозе (процессе определения антителами вредоносных клеток с их последующим уничтожением).IgG при беременности Особенностью данного класса иммуноглобулинов является способность проникновения через плацентарный барьер и эндотелий (внутреннюю поверхность кровеносных и лимфатических сосудов, а также камер сердца). Этому способствует низкий молекулярный вес IgG. То есть иммуноглобулин G свободно передается от матери к эмбриону, обеспечивая пассивный гуморальный (первичный) иммунитет новорожденного. Благодаря этому в организме ребенка образуются антитела к некоторым заболеваниям, например, к кори. Со временем концентрация «материнских» IgG в крови новорожденного постепенно снижается, а спустя 9 месяцев и вовсе обнуляется. Однако к этому моменту организм ребенка уже начинает вырабатывать собственные иммуноглобулины, поддерживая необходимый уровень иммунной защиты. 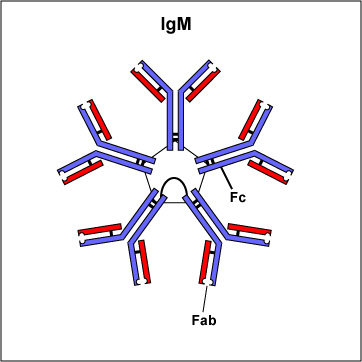 Иммуноглобулины М Иммуноглобулины МИммуноглобулины имеют разное строение и специфику. Иммуноглобулин М является классом антител, которые имеют не только самый большой вес, но и сложное строение. Именно они синтезируются первыми при попадании в организм антигена и максимально нейтрализуют чужеродное вещество. Подобные вещества начинают синтезироваться в организме человека еще в период его формирования в утробе, примерно на 26 неделе. К 9 месяцам уровень иммуноглобулина М в крови нерожденного малыша приближается к норме выработки взрослым организмом. Именно эти антитела создают первичный иммунитет ребенку. Благодаря способности взаимодействовать с полииммуноглобулиновым рецептором иммуноглобулин М попадает в грудное молоко и способствует улучшению иммунитета новорожденного малыша в 1 год его жизни. В результате реакции с полииммуноглобулиновым рецептором иммуноглобулин М насыщает слизистую оболочку кишечника антителами, что создает треть иммунитета в организме. При трансплантации органа в организме пациента активно вырабатывается иммуноглобулин М, который чаще всего не участвует в процессе отторжения, а выполняет защитные функции и способствует быстрейшему заживлению тканей. Иммуноглобулин М показывает при анализе крови на наличие начальной стадии развития инфекции в организме. При выявлении типа инфекции или бактерии уже на 1 этапе заболевания может быть быстро поставлен диагноз и назначено лечение. Основная функция иммуноглобулинов М связана с нейтрализацией в организме вредоносных бактерий и источников инфекций, которые активно связываются и выводятся из организма. Больше всего антитела этой группы активны в создании противоинфекционного иммунитета, что позволяет защитить организм от множества болезней при контакте с источником. В совокупности с иммуноглобулинами других типов иммуноглобулин М является частью сложного человеческого иммунитета, позволяет справляться с тяжелыми нагрузками и защищает организм от заражения. Иммуноглобулины А 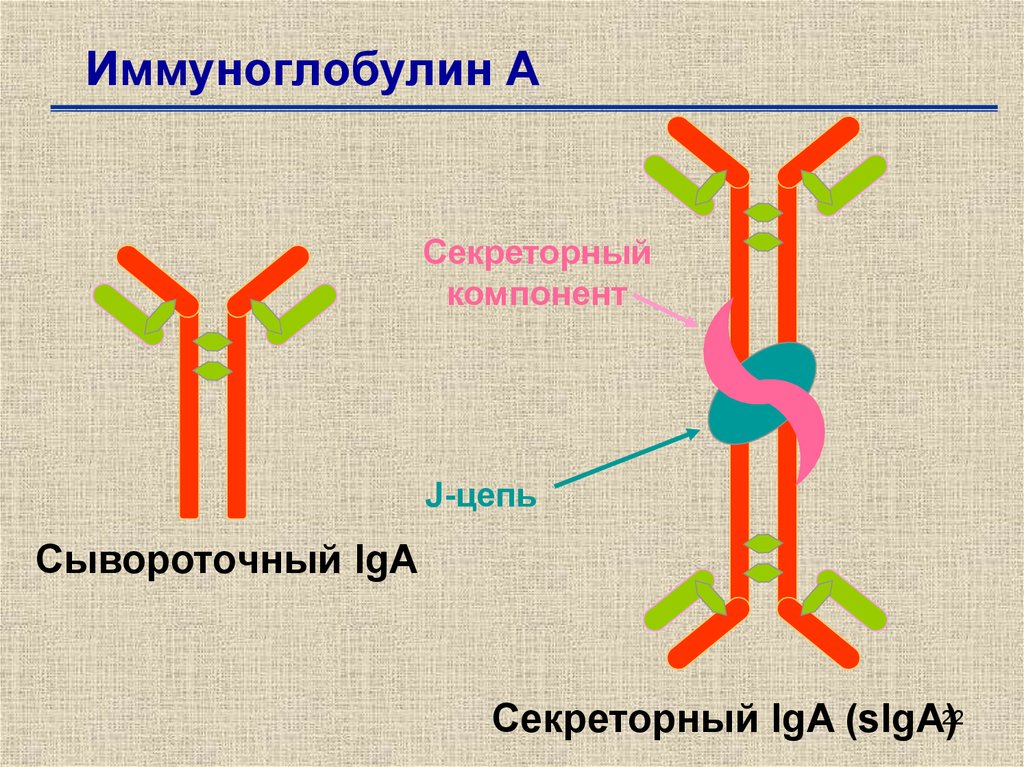 Иммуноглобулин А является показателем гуморального иммунитета. Его определяют для оценки местного иммунитета, течения острых инфекционных процессов, заболеваний почек, печени, хронического воспаления. В Юсуповской больнице для определения уровня иммуноглобулинов А лаборанты используют качественные реагенты. Результаты исследования интерпретируют профессора и врачи высшей категории. Иммунологи проводят терапию, направленную на нормализацию концентрации иммуноглобулинов А. Терапевты применяют эффективные препараты, зарегистрированные в РФ, обладающие минимальной выраженностью побочных эффектов. Иммуноглобулины A – это белки, обеспечивающие местный иммунитет. Они представлены в организме человека двумя фракциями: сывороточной, обеспечивающей местный иммунитет, и секреторной. Секреторная фракция содержится в молоке, респираторного и секретах кишечного тракта, слёзной жидкости и слюне, защищающих вместе с неспецифическими факторами иммунитета защиту слизистых оболочек от вирусов и бактерий. Сывороточный иммуноглобулин A является фракцией гамма-глобулинов. Он составляет 10-15 % от общего количества всех растворимых иммуноглобулинов. В сыворотке крови иммуноглобулин A представлен в основном мономерными молекулами. Основное количество иммуноглобулина A находится не в сыворотке крови, а на поверхности слизистых оболочек. Секреторный иммуноглобулин облегчает транспорт иммуноглобулина A через эпителий. Он защищает молекулы иммуноглобулинов от расщепления ферментами пищеварительного тракта. Основная функция сывороточного иммуноглобулина A – обеспечение местного иммунитета, защита мочеполовых, дыхательных путей и органов пищеварения от возбудителей инфекционных заболеваний. Секреторные антитела обладают выраженным противоадсорбционным действием: препятствуют прикреплению бактерий к поверхности эпителиальных клеток, предотвращают прилипание микроорганизмов, без которого бактериальное повреждение клетки становится невозможным. Также иммуноглобулины А вместе с неспецифическими факторами иммунитета обеспечивают защиту слизистых оболочек от микроорганизмов. Врождённый или приобретенный дефицит иммуноглобулина IgА может приводить к возникновению аллергии, аутоиммунных нарушений, аллергии, повторных инфекций. Иммуноглобулин A не проходит через плацентарный барьер. Его уровень у новорожденных составляет около 1% от концентрации у взрослых. К первому году жизни ребёнка этот показатель составляет 20 % от уровня взрослых. После рождения малыша секреторные иммуноглобулины поступают в его организм с молозивом матери. Они защищают желудочно-кишечный тракт и дыхательные пути ребёнка. Возраст 3 месяца является критическим. В этот период врачи диагностируют врождённую или транзиторную недостаточность местного иммунитета. К пятилетнему возрасту ребёнка уровень иммуноглобулинов А достигает концентрации, характерной для взрослого человека. Норма иммуноглобулина А у детей зависит от их возраста. У детей от 3 до 12 месяцев она составляет 0,02-0,05г/л, от 12 до 16 лет находится в диапазоне 0,6-3,48 г/л. У взрослых людей, старше 20 лет, нормальный уровень иммуноглобулина А варьирует от 0,9 до 4,5 г/л. Иммуноглобулины Е 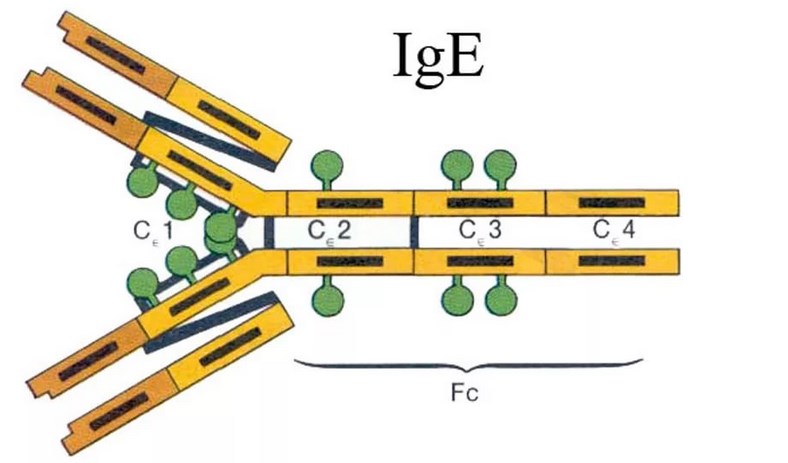 Это антитела, которые специфически взаимодействуют с тучными клетками и базофильными лейкоцитами, содержащими многочисленные гранулы с биологически активными веществами. При их выделении из клетки резко расширяются вены, увеличивается проницаемость сосудистой стенки. Подобную картину врачи наблюдают при аллергических реакциях. Лаборанты Юсуповской больницы исследуют уровень иммуноглобулинов Е у пациентов, страдающих бронхиальной астмой, аллергическим ринитом, крапивницей. Защитные свойства иммуноглобулинов E направлены преимущественно против гельминтов. Высокий иммуноглобулин Е у взрослых бывает при IgE-моноклональной миеломе, паразитарных инвазиях, а также первичных иммунодефицитах (атаксии-телеангиэктазии, синдромах Вискотта-Олдрича, Ди Джорджи Незелофа. Если иммуноглобулин Е понижен у взрослого, врачи Юсуповской больницы проводят комплексное исследование, позволяющее выявить нарушения иммунной системы, иммунодефицитные состояния. Иммуноглобулины D 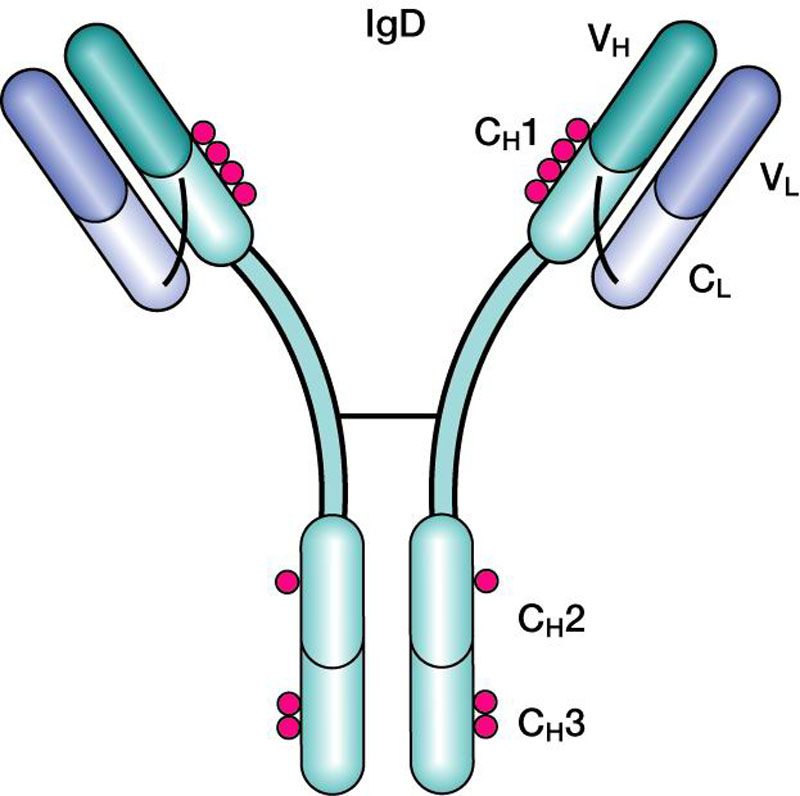 IgD не связывает комплемент, не проходит через плаценту, не обладает тропностью к тканям. По современным данным, IgD может выполнять роль антигенораспознающего рецептора В-лимфоцитов и играть важную роль в процессе их дифференцировки под влиянием антигенной стимуляции. До настоящего времени биологическая функция этого Ig не изучена. Кроме описанных выше характеристик, отличающих молекулы Ig одного класса (изотипа) от другого, есть еще два свойства, которые позволяют отличить молекулы Ig внутри класса: это аллотипические и идиотипические различия. Аллотипические различия Ig обусловлены особенностями строения тех участков его молекул, которыми этот белок одного индивида отличается от Ig такого же класса, но синтезированного другим индивидом такого же вида. Аллотипические маркеры обнаруживаются в тяжелых и легких цепях в их константных областях. Идиотипические различия Ig определяются антигенной специфичностью какого-либо одного Ig, синтезируемого одним клоном лимфоидных клеток определенного индивида. Идиотипические различия обусловлены индивидуальной последовательностью расположения аминокислот в вариабельных участках легких и тяжелых цепей, и. как считается, отражают антигенные свойства активного центра молекулы антитела. Виды иммуноглобулинов по характеру действия. Помимо оценки отдельных классов иммуноглобулинов имеет значение и определение характера действия иммуноглобулинов. При аллергических заболеваниях помимо реагинов выявляют и другие типы антител (преципитины, гемагглютинины, блокирующие). Они могут принимать участие в разных аллергических процессах — бронхиальная астма, пищевая аллергия, лекарственная аллергия, поллинозы. Преципитирующие антитела (чаще иммуноглобулин G), участвующие в аллергических процессах, являются компонентом иммунных комплексов. Последние локализуются, проникая через сосудистую стенку, в бронхиальных альвеолах. Активация комплемента, выделение лейкотаксических факторов ведут к появлению гранулоцитов и макрофагов. Разрушение последних освобождает ферменты и монокины, повреждающие ткань легкого, и формирует ее фиброз. Развивается воспалительная реакция, опосредованная биологически активными веществами. Комплементсвязывающие антитела участвуют в патогенезе таких аллергозов, как реакции типа «обратной» анафилаксии, цитотоксический анафилактический шок, анафилактический шок при бактериальной аллергии, туберкулиновый шок; встречаются они и при поллинозах. Блокирующие аллергические антитела есть в крови выздоравливающих от аллергии. Они относятся к иммуноглобулинам G, термостабильны, не сенсибилизируют кожу, не вызывают образования преципитата. Этот вид антител образуется после проведения специфической гипосенсибилизации. Гемагглютинирующие антитела — антитела, способные специфически реагировать с эритроцитами, соединенными с аллергеном. Окончательно не установлено, обладают ли этим свойством к агглютинации и другие виды антител (реагины или блокирующие). Аллергические антитела специфичны, но к некоторым видам аллергенов специфичность относительна, возможно развитие так называемых перекрестных реакций. Реакции между антигеном (аллергеном) и антителом многообразны и ведут к различным клиническим проявлениям. Механизм взаимодействия антитела с антигеном В процессе взаимодействия с антигеном принимает участие не вся молекула Ig, а лишь ее ограниченный участок — антигенсвязывающий центр, или паратоп,который локализован в Fab-фрагменте молекулы Ig. Co своей стороны, антитело взаимодействует не со всей молекулой антигена сразу, а лишь с ее антигенной детерминантой. Антитела отличает специфичность взаимодействия, т. е. способность связываться со строго определенной антигенной детерминантой. Наиболее доступные для взаимодействия эпитопы располагаются на поверхности молекулы антигена. Связь антигена с антителом осуществляется за счет слабых взаимодействий (ван-дерваальсовы силы, водородные связи, электростатические взаимодействия) в пределах антигенсвязывающего центра. Такая связь отличается неустойчивостью — образовавшийся иммунный комплекс (ИК) может легко диссоциировать на составляющие его компоненты. Поэтому взаимодействие антигена и антитела может быть представлено в виде уравнения: [АГ] + [AT] « [ИК]. Продолжительность существования иммунного комплекса определяется целым рядом факторов. При этом важное значение имеют особенности антитела, антигена и условия, в которых происходит их взаимодействие. К особенностям антитела следует отнести его аффинность и авидность. Аффинность — сила специфического взаимодействия антитела с антигеном (или энергия их связи). Эта характеристика зависит от степени стерического, или пространственного, соответствия (комплементарности) структуры антигенсвязывающего центра и антигенной детерминанты. Чем выше их комплементарность, т. е. чем больше они подходят друг другу, тем больше образуется межмолекулярных связей и тем выше будет устойчивость и продолжительность жизни образовавшегося иммунного комплекса. Структурные несоответствия антигенсвязывающего центра и антигенной детерминанты существенно снижают число образующихся связей и прочность взаимодействия антитела с антигеном. Иммунный комплекс, образованный низкоаффинными антителами, чрезвычайно неустойчив, имеет малую продолжительность существования и быстро распадается на исходные компоненты. Установлено, что в условиях макроорганизма с одной и той же антигенной детерминантой способны одновременно прореагировать и образовать иммунный комплекс около 100 различных клонов антител. Все они будут отличаться структурой антигенсвязывающего центра и аффинностью. Аффинность антител существенно меняется в процессе иммунного ответа в связи с селекцией наиболее специфичных клонов В-лимфоцитов. Наименее аффинными считаются нормальные антитела. По расчетам, общее число различных антигенспецифических клонов В-лимфоцитов достигает 106—107. Под термином «авидность»понимают прочность связывания антитела и антигена. Эта характеристика определяется аффинностью Ig и числом антигенсвязывающих центров. При равной степени аффинности наибольшей авид-ностью обладают антитела класса М, так как они имеют 10 антигенсвязывающих центров. Особенности антигена также влияют на эффективность его взаимодействия с антителом. Так, важное значение имеют стерическая (пространственная) доступность антигенной детерминанты для антигенсвязывающего центра молекулы Ig и число эпитопов в составе молекулы антигена. Эффективность взаимодействия антитела с антигеном существенно зависит от условий, в которых происходит реакция, и прежде всего от рН среды, осмотической плотности, солевого состава и температуры среды. Оптимальными для реакции антиген—антитело являются физиологические условия внутренней среды макроорганизма: близкая к нейтральной реакция среды, присутствие фосфат-, карбонат-, хлорид- и ацетат-ионов, осмолярность физиологического раствора (концентрация раствора 0,15 М), а также температура (36—37 °С). Благодаря уникальной способности специфически связываться с антигенными детерминантами, антитела выполняют в организме ряд важнейших функций, как форма иммунного реагирования и фактор регуляции иммунореактивности. При этом необходимо дифференцировать эффекты специфического, высокоаффинного взаимодействия и неспецифического, низкоаффинного. В результате специфического взаимодействия эпитопа молекулы антигена с паратопом молекулы антитела может образоваться устойчивый иммунный комплекс с продолжительностью жизни, достаточной для проявления эффекторных свойств молекулы иммуноглобулина. Это означает, что благодаря своим уникальным способностям антитела могут оказывать прямое или опосредованное воздействие на молекулы антигена: 1.нейтрализовать или маркировать антиген, 2.вызвать его деструкцию или элиминацию. К прямым эффектам антител относится нейтрализация.Она достигается путем связывания и блокирования паратопом иммуноглобулина активного центра биологически активной молекулы, например, токсина, рецептора, лекарственного препарата и пр. Эффект имеет обратимый характер в случае распада иммунного комплекса и требует подключения других механизмов иммунной защиты (фагоцитоз, лизис). На принципе нейтрализации основан механизм действия антитоксических, противовирусных и многих других лечебных иммунных сывороток. Энзиматическое действие антител также относится к прямым эффектам. Они связаны со стабильной областью V-домена L-цепи. Благодаря реликтовой протеазной или нуклеазной, иммуноглобулины способны вызывать деструкцию молекулы антигена (например, расщепление отдельных пептидов или ДНК). В большинстве случаев взаимодействие антител с антигеном в организме не влечет за собой непосредственно нейтрализацию биологического действия последнего, а также его разрушение или утилизацию. Прочно связываясь с эпиопом, антитела «маркируют» молекулу антигена — обозначают его как мишень для факторов элиминации или деструкции (фагоцитоз, лизис). К непрямым эффектам относятся: • активация комплемента по классическому пути и индукция комплемент-опосредованного лизиса чужеродных клеток; наилучшими свойствами обладает IgM(IgM>IgG3>IgGl); • запуск антителозависимой клеточно-опосредованной цитотоксичности. • опосредование гиперчувствительности немедленного типа, или I типа • индукция иммунного фагоцитоза, приводящая к элиминации любых форм антигена из организма. Клеточно-опосредованные эффекты иммуноглобулинов реализуются благодаря экспрессии на мембране иммунокомпетентных клеток рецепторов к Fc-фрагменту молекулы иммуноглобулина (FcR). Эти рецепторы являются трансмембранными белковыми молекулами и различаются по специфичности и аффинности. FcR всегда специализирован к определенному изотипу тяжелой цепи молекулы Ig. Различают высокоаффинные и низкоаффинные FcR. Первые могут взаимодействовать с интакт-ной молекулой иммуноглобулина, используя ее в дальнейшем как ко-рецепторный фактор (базофилы, тучные клетки); вторые — связываются с молекулой Ig в составе иммунного комплекса. Поэтому FcR называют непрямыми иммунорецепторами. Помимо обладания эффекторными свойства, антитела являются активными регуляторами иммунореактивности. Так, Ig служат антигенспецифическими рецепторами В-лимфоцитов. Благодаря выраженной цито-фильности, они также выполняют функцию специфических ко-рецепторных факторов ба-зофилов и тучных клеток (см. выше). Согласно теории «идиотип-антиидиотипи-ческого взаимодействия», антитела, специфичные к идиотипическим антигенным детерминантам Ig, могут управлять силой антительного иммунного реагирования. Активное специфическое связывание высо-коиммуногенных эпитопов специфическими антителами может блокировать развитие как гуморального, так и клеточного иммунного ответа. Этот эффект используется в клинической практике, например, для профилактики гемолитической болезни новорожденных в результате резус-конфликта. Вместе с тем антитела могут неспецифически взаимодействовать с молекулой антигена за счет неспецифической адсорбции или низкоаффинного связывания. Это позволяет антителам наряду с другими веществами участвовать в опсонизации антигена и таким образом неспецифически ингибировать его биологическое действие. Иммунные комплексы Одной из важнейших биологических функций Ig является связывание антигена и образование иммунного комплекса (ИК), представляющее собой физиологический процесс, перманентно протекающий в организме человека и направленный на поддержание постоянства его внутренней среды. Образование ИК — один из компонентов нормального иммунного ответа. Оно должно заканчиваться нейтрализацией или элиминацией антигена. Однако при определенных условиях ИК могут фиксироваться в сосудах и вызывать воспалительную реакцию. Локализация ИК ' зависит от места их формирования и циркуляции с последующим отложением в тканях; в последнем случае, если процесс приобретает генерализованный характер, это может привести к развитию иммунокомплексной патологии. Формирование, "судьба" и биологическая активность ИК зависят от многих факторов, и, прежде всего, от природы антител и антигена, входящих в состав ИК, а также от их соотношения. Особенности ИК зависят от свойств антител (класс, аффинность, валентность, способность связывать комплемент, скорость синтеза) и антигена (размер, валентность, заряд, растворимость, пространственное распределение и плотность эпитопов — антигенных детерминант). Важной характеристикой ИК является их величина. Установлено, что ИК, образованные при избытке антител, хотя и способны связывать комплемент, однако имеют большие размеры, нерастворимы, быстро фагоцитируются, обладают ограниченной патогенностью. Наибольшим патологическим потенциалом обладают растворимые ИК средних размеров, сформированные при некотором избытке антигена, способные активировать комплемент. В развитии иммунокомплексной патологии большое значение имеют также степень выраженности антигенемии и длительность персис- тенции антигена. Если продолжительность циркуляции последнего в организме невелика, то даже при условии образования иммунных комплексов поражение тканей и клинические проявления будут транзи- торными. Напротив, если антиген длительное время циркулирует в организме (хроническая инфекция, аутоантиген), то поддерживаются условия для продолжительного формирования ИК и поражения тканей-мишеней. Способность активировать систему комплемента и взаимодействовать с рецепторами к Fc-фрагменту, расположенными на мембране различных клеток, является важнейшей способностью ИК, определяющей их роль в развитии воспаления и регуляции функциональной активности иммунной системы. Роль комплемента в' развитии иммунокомплексного процесса двояка. С одной стороны, активация иммунными комплексами системы комплемента сопровождается описанными выше биологическими изменениями и является ведущим фактором развития иммунного воспаления. С другой стороны, комплемент способен растворять ИК, приводить даже к исчезновению комплексов, отложившихся в тканях. Возможно, это объясняется тем, что при включении СЗЬ в решетку ИК не только изменяются первичные связи антигена и антитела, но может происходить ее перестройка путем разрыва неспецифических межмолекулярных связей за счет конкурентного связывания СЗЬ, обладающего большим сродством к тем Fc- или Fab-детерминантам IgG, ко- * торые формируют эти связи. ИК, взаимодействуя с клеточными рецепторами, способны активировать разнообразные клетки: Т-, В-лимфоциты, моноциты, макрофагоциты, гранулоциты (нейтрофильные, эозинофильные и базофиль- ные), тромбоциты, эритроциты, имеющие на мембране рецепторы к Fc-фрагменту IgG. Кроме того, В-лимфоциты, моноциты, макрофагоциты и нейтрофильные гранулоциты имеют также рецептор к СЗ. Заключение Что касается иммуноглобулинов сельскохозяйственных животных, то, к сожалению, многие вопросы выделения, идентификации и количественного определения этих защитных белков остаются еще слабо разработанными. Главный защитный белок сельскохозяйственных животных IgG. Причем он существует в виде двух подклассов: G1 и G2 , которые различаются аминокислотным составом, электрофоретической подвижностью, антигенным и биологическим свойствам. Однако выделение из сыворотки крови чистых препаратов IgG1 - очень сложная, и следовательно, не до конца решенная проблема. Поэтому большинство литературных данных по этому вопросу касается IgG и лишь немногие IgG1 и IgG2 . IgM один из высокомолекулярных и сложноорганизованных белков сыворотки крови, состоящий из 5 субъединиц, соединенных лабильными дисульфиными связями. Этим и объясняется трудность его выделения и изучения. Хотя существуют несколько современных методических приемов, помогающих его выделению, ни один из них в отдельности не обеспечивает получения чистого IgМ. Поэтому необходимо использовать комбинированные методы, основанные на особенностях его физико-химических свойств. Так, до сих пор остается сложной задачей приготовление высокоочищенного IgМ, пригодного для изучения его структурных особенностей и аминокислотного состава, антигенных свойств, а также получение к нему моноспецифических иммунных сывороток. По-видимому, этим и объясняется отсутствие работ по изучению пептидной структуры и аминокислотного состава IgМ у различных видов животных. Относительно мало работ, выполненных с помощью моноспецифических иммунных сывороток к IgM у животных, особенно у лошадей и овец. Список литературы 1. Басова Е.Н., Стефани Д.В. Некоторые особенности выделения миеломных IgG человека различных субклассов и их распределение по аллотипам, субклассам и типам легких цепей// Журн. микробиолог. - 1977. - №5. - С. 77-81. 2. Басова Е.Н., Стефани Д.В., Казанцева Л.З. Иссчледования субклассов IgG человека. Сооб.II. Уровни отдельных субклассов IgG в парных сыворотках крови жителей северного села - изолята// Журн. микробиолог. - 1979. - №7. - С. 35-39. 3. Бернет Ф. Клеточная Иммунология. - М.: Мир, 1971. - 549 с. 4. Edelman J.M. Antibody structure and molecular immunology//Nobel lecture. Dec. 12 1972; Stocholm, 1973. - p. 147-170 5. Heimer R., Clark L.C., Mourer P.H. Immunoglobulins of sheep//Arch. Biochem. Biophys. - 1969 - v.131. - p. 9-17. 6. Kehoe J.M., Tomosi T.B., Ellous F., Capra J. Identification of J-chain in a homogeneous canine IgA immunoglobulin//J. Immunol - 1972 - v.109 - p.59-64. 7. Menta P.D., Reichin M. Comparative studies of vertebrate immunoglobulins//J. Immunol - 1972 - v.109 - p.1272-1277. 8. Ж.Ж.Жумашев, М.Б.Бабаев, Ш.С.Алимжанова, М.А.Туганбекова. Иммуноглобулины животных. Алматы. 1994. |
