Кислоты. Кислоты_в_ссвете_теории_электролитической_диссоциации_2. Самостоятельная работа ii. Лабораторный опыт Ознакомление с коллекцией кислот Физические свойства кислот Жидкости
 Скачать 330.69 Kb. Скачать 330.69 Kb.
|
|
Кислоты в свете теории электролитической диссоциации I. Повторение основных вопросов электролитической диссоциации Тестовая работа  Самостоятельная работа  II. Лабораторный опыт 6. Ознакомление с коллекцией кислот Физические свойства кислот Жидкости: H2SO4 HNO3 и др. Твердые: H3PO4 H2SiO3, борная и многие органические (например лимонная) Газообразные: HCl H2S и др. Классификацию кислот  Кислоты – это электролиты, при диссоциации которых образуются катионы водорода и анионы кислотных остатков. HCl = H++Cl- H3РO4 = 3H++PO43- Химические свойства кислот (условия взаимодействия см. в учебнике 180-187)  !!! Обратите внимание на продукты взаимодействия азотной кислоты и концентрированной серной кислот с металлами.  Запомните: Азотная кислота и концентрированная серная кислота взаимодействуют с металлами стоящими в электрохимическом ряду напряжений металлов как до, так и после водорода, не образуя при этом водород. 5. Для органических кислот характерна реакция этерификации (взаимодействие со спиртами с образованием сложного эфира и воды) 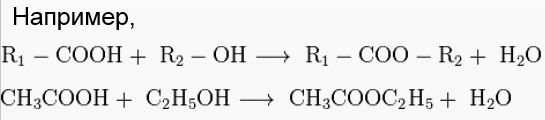 III. Практическая часть урока 1. Классификация кислот Соотнесите: Тип кислот: Формула вещества: Кислородсодержащие а) H2SiO3 бескислородные б) HCOOH одноосновные в) H2SO4 двухосновные г) HBr сильные д) HNO3 слабые Ответ: 1) 2) 3) 4) 5) 6) 2. Химические свойства органических и неорганических кислот. 1)Допишите возможные уравнения реакций в молекулярном виде. Для двух первых реакций в каждом задании составьте полные и сокращённые уравнения реакций. HCl + NaOH = CH3COOH + NaOH = HCl + Cu(OH)2 = CH3COOH + Cu(OH)2 = 2) Взаимодействие кислот с металлами. HCl + Zn = CH3COOH + Mg = HCl + Cu = CH3COOH + Cu = 3) Взаимодействие кислот с оксидами. HCl + CaO = CH3COOH + CaO = HCl + CuO = CH3COOH + CuO = HCl + CO2 = CH3COOH + CO2 = 4) Взаимодействие кислот с солями. HCl + CaCO3 = CH3COOH + CaCO3 = HCl + Na2SO4 = CH3COOH + Na2SO4 = 5) Реакция этерификации. CH3COOH + CH3OH = H2SO4 + CH3OH = 3. Определить вероятность протекания реакций разб. H2SO4 с веществами (выписать № вещества, способного взаимодействовать с разб.H2SO4): Pb Ag Ba PbO Ag2O BaO Pb(OH)2 Ba(OH)2 H3PO4 Na2SO3 CH3COONa Д\З: § 22 №5(а), №7 (письменно) |
