Раздел долгосрочного плана:
|
Школа:
|
Дата:
|
ФИО учителя:
|
Класс:9
|
Количество присутствующих:
|
отсутствующих:
|
Тема урока
|
Серная кислота и ее соли
|
Цели обучения, которые достигаются на данном уроке (ссылка на учебную программу)
|
9.2.1.38 исследовать физические и химические свойств раствора серной кислоты и ее солей
|
Цели урока
|
Знать физические и химические свойства серной кислоты и ее солей.
Знать области применения серной кислоты. Технику безопасности при обращении с серной кислотой.
Уметь составлять уравнения химических реакций характерные для серной кислоты с точки зрения окислительно- восстановитных процессов.
|
Критерии успеха
|
Знают физические и химические свойства серной кислоты и ее солей.
Знать области применения серной кислоты. Технику безопасности при обращении с серной кислотой.
Умеют составлять уравнения химических реакций характерные для серной кислоты с точки зрения окислительно- восстановитных процессов.
|
Языковые цели
|
Ученики могут:
– используя специальную лексику задавать и отвечать на вопросы относительно содержания кислорода в составе атмосферного воздуха и земной коре
– объяснять круговорот кислорода в природе
Предметная лексика и терминология:
Структурная формула серной кислоты. Ступенчатая диссоциация серной кислоты. Физические свойства серной кислоты. Химические реакции характерные для серной кислоты. Область применения серной кислоты
.Серия полезных фраз для диалога/письма
Серная кислота
2. Агрессивная, водоотнимающая.
3. Испаряется, окисляется, прожигает.
4. Серная кислота «хлеб» химической промышленности.
5. «Купоросное масло»
|
Привитие ценностей
|
Уважение при групповой работе
Открытость при оценивании работы учащихся
Труд и творчество
Обучение на протяжении всей жизни
|
Межпредметные
связи
|
межпредметная интеграция на уроке реализуется при разных видах деятельности на уроке
География: распространение кислорода на Земле.
Физика: плотность кислорода.
Биология: элемент кислород как важная составная часть органических веществ
|
Предварительныезнания
|
|
Ход урока
|
Запланированные этапы урока
|
Запланированная деятельность на уроке
|
Ресурсы
|
Начало урока
0-2 мин
3-6 мин
18-19 мин
20-30 мин
31-37 мин
|
Создание коллаборативной среды
Разминка «Дерево»Учащиеся представляют себя деревьями, их руки это ветви,их ноги это корни, их тела это стволы деревьев,показывают свою реакцию на воздействие внешних факторов окружающей среды.
Стадия вызова Мозговой штурм
1). Какое строение имеет атом серы, его валентность возможности и степень окисления.
2). В виде чего и где встречается сера в природе.
3).Каковы физические св-ва серы?
4). Записать уравнения реакций хим.свойств серы:
S+O2=
Cu+S=
H2+S=
H2S+Pb(NO3)2=
Na2S+Pb(NO3)2=
5. Какие аллотропные видоизменения имеет сера? Зарисуйте виды молекул,
5). Расскажите о свойствах SO2 и SO3 .
7) работа по карточкам
.*S→SO2 → SO3 → H2SO4 → MgSO4 →Mg(OH)
Структурная формула и молекула серной кислоты
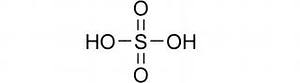
Физические свойства серной кислоты.
Безводная серная кислота - это бесцветная маслянистая жидкость без запаха,
смешивается с водой в любых отношениях,
t пл. =10,30 С, t кип = 2960С, плотность=1, 84 г/см3. Обладает сильным водоотнимающим действием.
Химические свойства разбавленной серной кислоты
Взаимодействует :
с оксидами металлов
Н2SO4+MeO→MeSO4+H2O
( образуется соль и вода)
с основаниями
Н2SO4+Me(OН)n→MeSO4+H2O
( образуется соль и вода)
с солями
Н2SO4+MeR(р)→MeSO4 (р)+HR
( образование осадка или выделение газа)
разбавленная и концентрированная
Серные кислоты ведут себя по- разному по отношению к металлам
Разбавленная серная кислота ведет себя, как сильная кислота. активные
металлы, стоящие в ряду напряжений левее водорода
Li, К, Ca, Na, Mg, Al, Mn, Zn, Fe, Co, Ni, Sn, Pb, H2, Cu,Hg, Ag, Au
вытесняют водород из разбавленной серной кислоты. Мы видим пузырьки водорода при добавлении разбавленной серной кислоты в пробирку с цинком.
H2SO4 + Zn = Zn SO4 + H2 ↑
Медь стоит в ряду напряжений после водорода – поэтому разбавленная серная кислота не действует на медь.
Качественная реакция на сульфат-ион
BaCl2+ Na2SO4= BaSO4↓+ 2NaCl
BaCl2+ Н2SO4= BaSO4↓+ 2НCl
1.Какие соединения образует сера?
2.Что такое сероводородная вода? От чего она мутнеет?
3.Может ли сероводород проявлять окислительные свойства? Почему?
4.Химические свойства сернистого газа?
5.Какие химические свойства проявляет оксид серы (VI)?
|
презентация
Презентация
Листы оценивания
Приложение 1
смайлики
презентация
Конфеты трех видов
Приложение 2
ноутбуки,
маркеры,
постеры
листы
оценивания групп
|
Конец урока
38-40 мин
|
В конце урока учащиеся проводят рефлексию
Ну, что ж коллеги – корреспонденты , пришла пора подвести итоги. Сдаем трудовые книжки. А вам необходимо подписать свои статьи в газету, для этого заполните анкету
На уроке я работал активно / пассивно
Своей работой на уроке ядоволен / не доволен
Урок для меня показался коротким / длиннымполезным / бесполезным
За урок я не устал / устал
Материал урока мне был понятен / не понятен интересен / скучен
Домашнее задание мне кажется интересным / не интересным легким / трудным
7.Мое настроение стало лучше / стало хуже
Домашнее задание просмотреть презентационные слайды
Выберите задание по одному из уровней сложности
|
стикеры
|
Дифференциация – каким образом Вы планируете оказать больше поддержки? Какие задачи Вы планируете поставить перед более способными учащимися?
|
Оценивание – как Вы планируете проверить уровень усвоения материала учащимися?
|
Здоровье и соблюдение техники безопасности
|
Все учащиеся смогут:
Знать свойства кислорода и озона;
Использовать полученные знания для того, чтобы исследовать его свойства на примерах.
Большинство учащихся сможет:проводить сравнение кислорода и озона,уметь записывать уравнения реакций, характеризующие свойства кислорода; знать об озоне-как аллотропной модификации
Некоторые учащиеся смогут:
записывать уравнения реакций, о модификации кислорода,характеризующиеи прогнозировать продукты реакций
|
В течение урока проводилось оценивание учащихся, ,взаимооценивание по критериям оценивания,взаимооценивание работ групп
|
Для создания коллаборативной среды в начале урока проводилась разминка
ИКТ использовалось для показа презентационных слайдов при объяснении темы, при проверке знаний, выполнении заданий при индивидуальной, парной и групповой работе.
|
Рефлексия по уроку
|
Используйте данный раздел для размышлений об уроке. Ответьте на самые важные вопросы о Вашем уроке из левой колонки.
|
Считаю, что цели урока были достигнуты и выполнимы, учащиеся углубили навыки работы с компьютерами (в поисках информации, творческие и исследовательские навыки, учитывались индивидуальные особенности учащихся, задания составлены с учетом уровня сложности (А(средний), В(творческий), С (креативный).Учащиеся были активны на уроке. Работа по дифференциации имела свои положительные результаты, и эту работу я буду продолжать в дальнейшем с целью проследить прогресс учащихся в знаниях с учетом выбора заданий разного уровня сложности.С целью активизации познавательной активности учащихся по типу обучения являющихся аудиторными и визуальными обучаемыми, и развития навыков критического мышления и введения терминологии, использовались интересные задания.Урок проводился в виде игры.
Во время урока проводилось оценивание знаний учащихся с учетом критериев оценивания.
Там-менеджмент мной был выдержан. Отклонений от плана не было, студенты показали активность на каждом этапе урока.
|
Общая оценка
Какие два аспекта урока прошли хорошо (подумайте как о преподавании, так и об обучении)?
1:
2:
Что могло бы способствовать улучшению урока (подумайте как о преподавании, так и об обучении)?
1:
2:
Что я выявил(а) за время урока о классе или достижениях/трудностях отдельных учеников, на что необходимо обратить внимание на последующих уроках?
|
 Скачать 27.03 Kb.
Скачать 27.03 Kb.