спос выраж конц. Способы выражения концентрации растворов
 Скачать 31.88 Kb. Скачать 31.88 Kb.
|
|
Способы выражения концентрации растворов Важнейшей характеристикой всякого раствора является концентрация. Концентрацией называется содержание растворенного вещества в единице массы или объема раствора или растворителя. В химии используется несколько различных способов выражения концентрации. Кратко рассмотрим наиболее часто употребляемые. 1. Массовая доля (процентная концентрация) (ω) отношение массы растворенного вещества к общей массе раствора (выражается в процентах или в долях единицы):  , , mр-ра = V , где V – объем раствора (мл); плотность раствора (г/мл). Например: имеется раствор какого-либо вещества с массовой долей 5 %. Это значит, что 5 % от общей массы раствора приходится на растворенное вещество, и 95 % на растворитель. Массовая доля вещества составляет 0,05. 2. Мольная доля (χ) отношение количества вещества одного растворенного компонента раствора к общему количеству всех компонентов.  ; ;  . . Она также может быть выражена в процентах. χi безразмерные величины, для которых 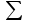 χi = χ1 + χ2 + ….χi = 1. χi = χ1 + χ2 + ….χi = 1.Мольную долю растворенного вещества в растворе с известной массовой долей легко определить: χ1 = 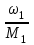 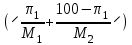 , где (100 ω1) массовая доля воды. , где (100 ω1) массовая доля воды. Например, для 8%-го раствора Na2SO4 (М = 142 г/моль): Например, для 8%-го раствора Na2SO4 (М = 142 г/моль):χ1 = 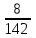 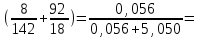 0,011 = 1,1 %. 0,011 = 1,1 %.3. Молярная концентрация или молярность (СМ) число молей растворенного вещества в 1 литре раствора (моль/л). Единицу измерения этой концентрации заменяют для кратности буквой М. СМ= n/V = m/M∙V 4. Молярная концентрация эквивалентов или эквивалентная концентрация (СЭК) количество (моль) эквивалентов растворенного вещества в 1 л раствора (моль экв/л). Единицу измерения этой концентрации заменяют для кратности буквой н. (с точкой) по старому названию этой концентрации – нормальность Сэкв (Х) = n (1/Z X) / V (смеси) Фактор эквивалентности (fэкв )– число, обозначающее, какая доля реальной частицы веществ Х (например, молекулы вещества X) эквивалентна одному иону водорода (в данной кислотно-основной реакции) или одному электрону (в данной окислительно-восстановнтельной реакции) Фактор эквивалентности fэкв (Х) рассчитывают на основании стехиометрии (соотношении участвующих частиц) в конкретном химическом процессе: fэкв (Х) = 1/Zx где Zx.— число замещенных или присоединенных ионов водорода (для кислотно-основных реакций) или число отданных или принятых электронов (для окислительно-восстановительных реакций); Х — химическая формула вещества. Эквивалент вещества Х –реальная или условная частица, которая в данной кислотно-основной реакции эквивалентна одному нону водорода или в данной окислительно-восстановительной реакции – одному электрону. Связь С1/z и С : С1/Z (Х) = Z · С (Х) для одной и той же массы вещества или объема вещества молярная концентрация эквивалента (эквивалентных частиц) больше, чем молярная концентрация в Z раз. 5. Титр (Т) масса растворенного вещества в 1 мл раствора (г/мл).  . . Зная эквивалентную концентрацию раствора, титр можно рассчитать по формуле 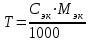 . . Моляльность (Сm) количество (моль) растворенного вещества в одном килограмме чистого растворителя (моль/кг). Сm = n/mр-ля =m/M∙mр-ля |
