|
|
срс 2. мурзагалиева анель бт18-50р цитген.чел_жив. Срс 2 Молекулярные механизмы регуляции клеточного цикла
Казахский национальный университет им. Аль-фараби
Факультет: биологии и биотехнологии

СРС 2
Молекулярные механизмы регуляции клеточного цикла
Кафедра: молекулярной биологии и генетики
Дисциплина: цитогенетика человека и животных
Подготовила:
Мурзагалиева Анель БТ 18-50Р
Проверила:
Колумбаева С.Ж.
Алматы, 2021 г.
Содержание:
Введение
Клеточный цикл и продолжительность его стадий у разных организмов.
1.1. Клеточный цикл бактериальных клеток
1.2. Клеточный цикл высших дрожжей
1.3. Клеточный цикл растений
1.4. Клеточный цикл млекопитающих
Циклины и циклинзависимые киназы.
Роль сверочных точек «чекпойнтов» в клеточном цикле.
Роль белка р53 в клеточном цикле.
Заключение
Использованная литература
Введение
Регуляция клеточного цикла включает в себя многочисленные сигнальные пути, которые определяют, будут ли клетки пролиферировать, оставаться в покое, останавливаться или претерпевать апоптоз. Изучение клеточного цикла было одной из самых быстро развивающихся областей современной биологии. Большая часть того, что мы знаем о регуляции клеточного цикла, получена благодаря продукции условных мутантов цикла клеточного деления, созданных в 1970-х годах Леландом Хартвеллом в Saccharomyces cerevisiae и Полом Нерсом в Schizosaccharomyces pombe. Развитие клеточного цикла хорошо охарактеризовано у дрожжей и высших эукариот. Регуляция клеточного цикла у растений и особенно у зеленых водорослей изучена хуже. Зеленые водоросли часто разделяют модификацию классического клеточного цикла, называемую множественным делением. Цикл множественного деления клеток характеризуется продолжительной фазой роста, во время которой клетка несколько раз удваивает свой объем. Затем он проходит несколько раундов репликации ДНК и делений ядра либо во время фазы роста, либо после его завершения. Материнские клетки обычно делятся на четыре, восемь или более дочерних клеток. Понимание механизмов регуляции клеточного цикла за последние несколько лет продвинулось очень быстро, и регуляторы клеточного цикла приобрели широкое значение при раке. Ниже будет сначала просуммированы основные достижения в понимании контроля механизмов клеточного цикла.
1.Клеточный цикл и продолжительность его стадий у разных организмов.
Думаю будет разумно начать наш обзор именно с бактериального клеточного цикла. Бактериальный клеточный цикл традиционно делится на три стадии: период между делением («рождение» клетки) и началом репликации хромосомы (известный как период B); период, необходимый для репликации (известный как период C); и время между концом репликации и завершением деления (известное как период D) (рис.ниже).
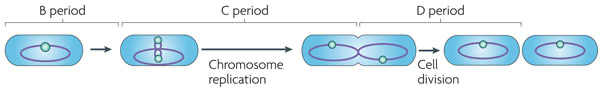
В кишечном организме Escherichia coli и спореобразователе Bacillus subtilis репликация ДНК начинается с одного ориджина (oriC) на одной кольцевой хромосоме. Репликация происходит двунаправленно по окружности хромосомы, заканчиваясь в области, противоположной oriC. Во время репликации хромосома остается в конденсированной, высокоупорядоченной структуре, известной как нуклеоид. Деление инициируется ближе к концу сегрегации хромосом путем образования цитокинетического кольца в месте зарождающегося деления. Тубулиноподобный белок FtsZ служит основой для сборки этого кольца и необходим для задействования аппарата деления. Доступность питательных веществ и скорость роста потенциально могут повлиять на любой из вышеперечисленных шагов.
Наше понимание бактериального клеточного цикла в различных условиях роста во многом основано на ранних физиологических исследованиях B. subtilis и E. coli. Эти исследования показали, что при постоянной температуре время удвоения массы уменьшается в ответ на увеличение доступности питательных веществ; однако как период C, так и период D остаются практически постоянными. В экспериментальных условиях короткий клеточный цикл (около 20 ч) имеют многие линии клеточных культур. У большинства активно делящихся клеток длительность периода между митозами составляет примерно 10—24 ч.
Теперь рассмотрим высших дрожжей. Как и в любой другой эукариотической клетке, клеточный цикл дрожжей включает группу процессов, обеспечивающих генерацию новых «дочерних» клеток посредством дублирования и разделения генетической информации и клеточных компонентов из «материнской» клетки. Прогрессирование клеточного цикла в основном контролируется семейством белков, называемых циклин-зависимыми киназами (или CDK), и, как следует из их названия, их взаимодействием с белками, которые осцилляторно экспрессируются во время клеточного цикла, называемыми циклинами. Клеточный цикл состоит из 4 различных фаз: G1, S, G2 и M. В фазе G1 клетки готовятся к дублированию, достигая порога «структур», размера или органелл, необходимых для поддержки разделения. Во время фазы S генетическая информация дублируется. В фазе G2 клетки готовятся к разделению. Наконец, во время фазы M исходная ячейка делится на 2 ячейки (рис.ниже).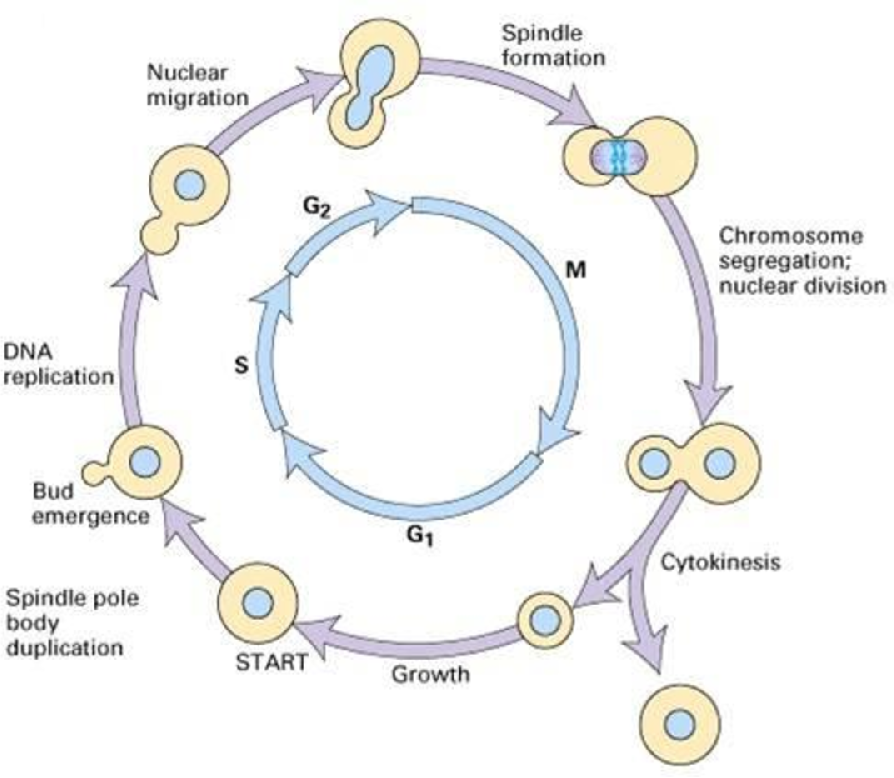
Клеточный цикл почкующихся дрожжей стал отличительной проблемой молекулярной системной биологии по ряду причин. (1) Цикл репликации ДНК, митоза и деления клеток имеет решающее значение для всех аспектов биологического роста, развития и воспроизводства. (2) Гены и пути контроля клеточного цикла кажутся очень похожими у всех эукариот, включая млекопитающих. (3) Бутонирующие дрожжи исключительно хороши для генетического анализа контроля клеточного цикла, поскольку они могут размножаться как гаплоидные клетки, а их генетический состав можно легко изменить стандартными методами молекулярной генетики. По этой причине многое известно о молекулярном механизме, регулирующем процессы цикла почкующихся дрожжевых клеток. (4) Механизм очень сложен, и его свойства не могут быть надежно разработаны с помощью одних только интуитивных рассуждений. (5) Были построены комплексные математические модели клеточного цикла почкующихся дрожжей, которые были протестированы на широком диапазоне.
Стоит также затронуть и клеточный цикл растений. Основными компонентами клеточного цикла растений являются G1 (постмитотическая интерфаза), S-фаза (фаза синтеза ДНК), G2 (премитотическая интерфаза) и митоз / цитокинез. Пролиферирующие клетки фосфорегулируются циклин-зависимыми протеинкиназами (CDK). Циклины растений D-типа являются сенсорами перехода G0 в G1, а также важны для G2 / M. В G1 / S фактор транскрипции S-фазы, E2F, высвобождается из ингибирующего белка ретинобластомы. Отрицательная регуляция событий G1 осуществляется посредством KRP (Kip-родственные белки). Гены S-фазы растений аналогичны генам животных, но время экспрессии может быть различным (например, CDC6 в начале S-фазы), а функциональные доказательства ограничены. В G2 / M CDK A-типа и уникальные CDK B-типа, когда они связаны с циклинами A, B и D, приводят клетки к делению; они негативно регулируются ICK1 / 2 и, возможно, также киназой WEE1. У Arabidopsis предполагаемый CDC25 не имеет регуляторного домена. Митоз зависит от правильной временной активности CDK, киназ Aurora и комплекса промотирования анафазы; Активность CDK-циклина B за пределами метафазы катастрофична. Эндоредупликация (повторная репликация ДНК в отсутствие митоза) характеризуется экспрессией E2F и подавлением митотических циклинов. Некоторые данные о размере ячейки подтверждают, в то время как другие опровергают идею о том, что размер ячейки влияет на развитие.
Рассмотрим теперь клеточный цикл млекопитающих. В эукариотических клетках или клетках с ядром стадии клеточного цикла делятся на две основные фазы: интерфазу и митотическую (М) фазу. Во время интерфазы клетка растет и копирует свою ДНК. Во время митотической (M) фазы клетка разделяет свою ДНК на два набора и делит свою цитоплазму, образуя две новые клетки. Подготовка к разделению происходит в три этапа:
G1 фаза. В течении этой фазы, также называемой фазой первого разрыва, клетка физически становится больше, копирует органеллы и создает молекулярные строительные блоки, которые потребуются на более поздних.
S-фаза. В S-фазе клетка синтезирует полную копию ДНК в своем ядре. Он также дублирует структуру, организующую микротрубочки, называемую центросомой. Центросомы помогают разделить ДНК во время фазы M.
Во время второй фазы перерыва, или фазы G2, клетка больше растет, производит белки и органеллы и начинает реорганизовывать свое содержимое, готовясь к митозу. Эта фаза заканчивается, когда начинается митоз.
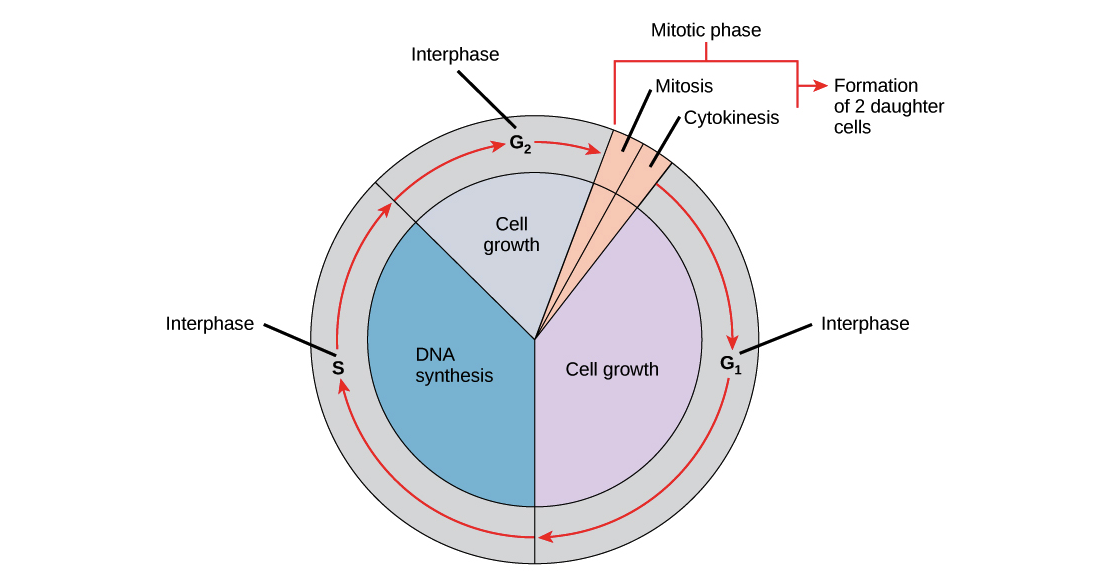
Фазы G1, S и G2 вместе известны как межфазные. Префикс является промежуточным между, отражая, что интерфаза имеет место между одной митотической (M) фазой и следующей.
Во время митотической (M) фазы клетка делит скопированную ДНК и цитоплазму, образуя две новые клетки. M-фаза включает два различных процесса, связанных с делением: митоз и цитокинез.
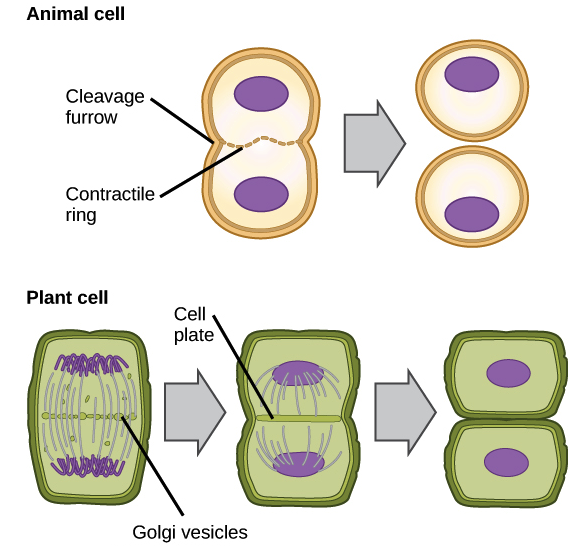
В митозе ядерная ДНК клетки конденсируется в видимые хромосомы и разделяется митотическим веретеном, специализированной структурой, состоящей из микротрубочек. Митоз проходит в четыре стадии: профаза (иногда делится на раннюю профазу и прометафазу), метафаза, анафаза и телофаза. Подробнее об этих этапах вы можете узнать из видео о митозе. При цитокинезе цитоплазма клетки делится на две части, образуя две новые клетки. Цитокинез обычно начинается сразу после окончания митоза с небольшим перекрытием. Важно отметить, что цитокинез в клетках животных и растений протекает по-разному.
У животных деление клеток происходит, когда полоса цитоскелетных волокон, называемая сократительным кольцом, сжимается внутрь и сжимает клетку надвое, этот процесс называется сократительным цитокинезом. Вмятина, образовавшаяся при сжатии кольца внутрь, называется бороздой спайности. Клетки животных можно защемить пополам, потому что они относительно мягкие и мягкие. Клетки растений намного жестче, чем клетки животных; они окружены жесткой клеточной стенкой и имеют высокое внутреннее давление. Из-за этого растительные клетки делятся на две части, создавая новую структуру посередине клетки. Эта структура, известная как клеточная пластинка, состоит из компонентов плазматической мембраны и клеточной стенки, доставленных в везикулах, и разделяет клетку на две части.
Разным клеткам требуется разное время для завершения клеточного цикла. Типичной человеческой клетке может потребоваться около 24 часов для деления, но быстро меняющиеся клетки млекопитающих, такие как те, что выстилают кишечник, могут завершать цикл каждые 9-10 часов, когда они выращиваются в культуре. Различные типы клеток также по-разному распределяют свое время между фазами клеточного цикла. Например, у ранних эмбрионов лягушки клетки почти не проводят времени в G1 и G2, а вместо этого быстро переключаются между фазами S и M, что приводит к делению одной большой клетки, зиготы, на множество более мелких клеток.
2. Циклины и циклинзависимые киназы.
Циклины представляют собой субъединицы циклинзависимых киназ (CDK), которые служат регуляторными регуляторами развития клеточного цикла и способствуют продвижению фазы G1 в фазу S. Циклины обнаружены в каждой клетке у всех эукариот. Учитывая долгую историю и частую дупликацию генов, семейство циклинов довольно велико: на сегодняшний день идентифицировано 30 членов. Различные циклины функционируют в разных фазах клеточного цикла вместе с ассоциированными с ними CDK, и разные подтипы демонстрируют специфические паттерны тканевого распределения в многоклеточных организмах. Тем не менее, белки являются высококонсервативными, о чем свидетельствует тот факт, что циклины человека могут заменять дрожжевые циклины с образованием функциональных комплексов циклин-CDK.
Циклин A, член-основатель семейства циклиновых белков, начинает накапливаться в клетках в конце фазы G1, достигает пика в середине фазы G2 и полностью исчезает в начале митоза. У млекопитающих два гена кодируют несколько разные формы циклина A: CCNA1 или циклин A1, который экспрессируется почти исключительно в зародышевых клетках, и CCNA2 или циклин A2, который экспрессируется повсеместно. Cyclin A взаимодействует с CDK2 в поздних фазах G1 и S и с CDK1 (cdc2) в поздних фазах S и G2. Как и в случае с большинством всех циклинов, ассоциация циклина А с его партнерскими CDK вызывает конформационное изменение киназ, чтобы обеспечить каталитическую активность и помочь направить предпочтение субстрата.
Другие циклины демонстрируют другой паттерн экспрессии клеточного цикла и образуют комплекс с разными CDK. Например, циклины D-типа присутствуют на протяжении всего клеточного цикла в клетках, которые активно делятся и исчезают только тогда, когда клетки временно выходят из клеточного цикла во время покоя или постоянно во время старения. Циклины E-типа, с другой стороны, экспрессируются в течение узкого промежутка времени от середины G1 до середины S фазы. Циклины B-типа, также называемые митотическими циклинами, в значительной степени накапливаются только в фазе G2, достигая своего пика в середине митоза, прежде чем внезапно исчезнуть перед цитокинезом.
Ключом к механизму того, как циклины осуществляют контроль клеточного цикла, является их тщательно рассчитанное по времени и последовательное накопление и деградация. Хотя активация / репрессия транскрипции играет роль, большая часть этого жесткого временного контроля экспрессии белка достигается за счет регуляции стабильности белков циклинов. Циклины представляют собой явно нестабильные белки, часто демонстрирующие скорость оборота, которая является одной из самых высоких среди всех известных классов белков. Накопление достигается только за счет временной стабилизации белков, эффекта, который легко обратим, и механизм которого индивидуален для каждого циклина. Таким образом, неудивительно, что большая часть новаторских работ по убиквитин-опосредованному протеолизу была проведена при изучении очень быстрого и строго регулируемого разрушения дрожжевых циклинов во время клеточного цикла.
В то же время многие циклины выполняют функции, полностью независимые от клеточного цикла. Например, хотя циклин C имеет существенную идентичность последовательности с другими циклинами и был идентифицирован в том же скрининге, который идентифицировал циклины D и E, он не колеблется в течение клеточного цикла. Поскольку не все циклины колеблются в клеточном цикле и не все, по-видимому, связываются с партнером CDK, распознавание и наименование членов суперсемейства циклинов теперь основано на сходстве последовательностей. Характерная структура циклина находится в циклиновом боксе, большом домене, состоящем примерно из 100 аминокислот, который формирует характерную складку из пяти альфа-спиралей. Все циклины имеют один или два бокса циклина, но этот домен также находится в других белках, таких как pRb и TFIIB. Бокс циклина является ключом к двум наиболее важным характеристикам циклинов в отношении контроля клеточного цикла: связыванию с CDK и быстрому обороту циклинов за счет убиквитин-опосредованного протеолиза.

Циклинзависимые киназы (ЦЗК или CDK) представляют собой протеинкиназы, для которых требуется отдельная субъединица - циклин, которая обеспечивает домены, необходимые для ферментативной активности. Циклинзависимые киназы играют важную роль в контроле клеточного деления и модулируют транскрипцию в ответ на несколько внеклеточных и внутриклеточных сигналов.
Эволюционное распространение семейства ЦЗК у млекопитающих привело к разделению на три подсемейства, связанных с клеточным циклом (Cdk1, Cdk4 и Cdk5) и пять транскрипционных подсемейств (Cdk7, Cdk8, Cdk9, Cdk11 и Cdk20). В отличие от прототипной киназы Cdc28 почкующихся дрожжей, большинство этих киназ связывают один или несколько циклинов, что согласуется с функциональной специализацией во время эволюции. Циклинзависимые киназы являются ключевыми регуляторными ферментами, участвующими в пролиферации клеток посредством регулирования контрольных точек клеточного цикла и событий транскрипции в ответ на внеклеточные и внутриклеточные сигналы. Неудивительно, что дерегуляция этого семейства белков является признаком нескольких заболеваний, включая рак, и целевое ингибирование определенных членов с помощью лекарств дало очень обнадеживающие результаты в клинических испытаниях.
Рассмотрим генную организацию циклинов и циклинзависимых киназ. Основываясь на последовательности киназного домена, CDK принадлежат к группе киназ CMGC (названной в честь инициалов некоторых членов), наряду с митоген-активированными протеинкиназами (MAPK), гликоген-синтазной киназой-3 бета (Gsk3β), членами группы семейство тирозин-регулируемых киназ с двойной специфичностью (DYRK) и CDK-подобных киназ. В родственных киназах, таких как MAPKs, субстратная специфичность обеспечивается сайтами стыковки, отделенными от каталитического сайта, тогда как CDK характеризуются зависимостью от отдельных белковых субъединиц, которые обеспечивают дополнительные последовательности, необходимые для ферментативной активности. Чтобы облегчить номенклатуру и анализ CDKs, белки, принадлежащие к этому семейству, недавно были переименованы в Cdk1 через Cdk20.
CDKs были впервые обнаружены в ходе генетических и биохимических исследований на модельных организмах, таких как дрожжи и лягушки. Эта работа установила важность CDK в обеспечении переходов через клеточный цикл. Кроме того, эти исследования показали, что каталитическая субъединица, CDK, должна ассоциироваться с регуляторной субъединицей, циклином, уровни белка которого регулируются во время клеточного цикла (это колебание дало этим регуляторам название циклин). После этих пионерских исследований, проведенных в 1980-х, важность CDKs, действующих как основное семейство эукариотических протеинкиназ, участвующих в интеграции внеклеточных и внутриклеточных сигналов для модуляции транскрипции генов и деления клеток, была четко установлена.
3. Роль сверочных точек «чекпойнтов» в клеточном цикле.

Контрольные точки клеточного цикла - это механизмы наблюдения, которые контролируют порядок, целостность и точность основных событий клеточного цикла. К ним относятся рост клеток до подходящего размера, репликация и целостность хромосом, а также их точное разделение при митозе. Многие из этих механизмов имеют древнее происхождение и очень консервативны, и, следовательно, в значительной степени основаны на исследованиях на простых организмах, таких как дрожжи. Другие эволюционировали в высших организмах и контролируют альтернативные судьбы клеток, оказывая значительное влияние на подавление опухолей. Здесь мы рассматриваем эти различные пути контрольных точек и последствия их дисфункции на судьбу клеток. Был достигнут огромный прогресс в молекулярном изучении различных путей контрольных точек клеточного цикла.
Контроль размера ячейки
Контрольная точка G1 - это основная точка принятия решения для ячейки, то есть основная точка, в которой она должна выбрать, делиться или нет. Как только ячейка проходит контрольную точку G1 и входит в S-фазу, она становится необратимо привязанной к делению. То есть, исключая непредвиденные проблемы, такие как повреждение ДНК или ошибки репликации, клетка, которая проходит контрольную точку G1, продолжит остаток клеточного цикла и произведет две дочерние клетки.
Чтобы сохранить размер клетки и гарантировать, что каждая дочерняя клетка наделена соответствующим количеством генетического и биосинтетического материала, клетки должны в среднем точно удвоить свое содержание перед делением. Контроль размера клетки имеет решающее значение для регулирования распределения питательных веществ в клетке, а также для регулирования размера и функции органов в многоклеточных организмах. Существование контрольных точек размера клетки было предложено для того, чтобы клетки могли координировать размер клетки с развитием клеточного цикла. Контрольные точки размера ячеек наблюдались в G1 и G2. Ранние доказательства этих контрольных точек были получены из наблюдений, что размер новых дочерних клеток после митоза влияет на развитие клеточного цикла: большие дочерние клетки ускоряют прохождение через G1 и / или G2, а маленькие дочерние клетки задерживают выход из этих фаз роста. Однако разные виды и типы клеток сильно различаются по расположению этих контрольных точек в пределах клеточного цикла и, следовательно, по тому, как на клеточный цикл влияет изменение размера клеток.
Один из предложенных механизмов контроля размера клеток - мониторинг трансляции белка. Эта гипотеза также предлагает объяснение того, как размер клетки и клеточный цикл реагируют на статус питания. Другой механизм, с помощью которого клетки могут координировать размер клетки с развитием клеточного цикла, - это мониторинг геометрии клетки. Хотя был предложен ряд объяснений координации клеточного цикла и размера клетки, возможно, что любое их количество одновременно функционирует в клетке. Однако остается неясным, как все они интегрированы.
Реакция на повреждение ДНК
Чтобы убедиться, что деление клетки проходит гладко (производит здоровые дочерние клетки с полной неповрежденной ДНК), клетка имеет дополнительную контрольную точку перед фазой M, называемую контрольной точкой G2. На этом этапе клетка проверяет: целостность ДНК и репликацию ДНК.

На протяжении всей интерфазы повреждение ДНК вызывает остановку клеточного цикла, что дает время для срабатывания путей репарации до перехода к последующим фазам клеточного цикла. Источник повреждения ДНК может быть внутренним, например, промежуточными продуктами метаболизма, истощением теломер, сверхэкспрессией онкогена и ошибками репликации ДНК. Несмотря на то, что существует множество специфических для поражения ответов на репарацию ДНК, различные поражения в геномной ДНК активируют общие пути контрольных точек, цель которых - поддерживать цитокинзависимую киназу в неактивном состоянии до тех пор, пока поражение не будет удалено. Вообще говоря, контрольные точки повреждения ДНК можно разделить на те, которые контролируются супрессором опухоли и фактором транскрипции p53, и те, которые в конечном итоге находятся под контролем киназы контрольной точки Chk1.
Мониторинг репликации ДНК
Фаза S отмечает особенно уязвимое время для клеток, чтобы справиться с повреждением ДНК. Повреждения должны не только восстанавливаться, как в клетках G1 и G2, но они также действуют как физическое препятствие для репликативных полимераз. Репликация ДНК инициируется в определенных сайтах, источниках репликации. Они эпигенетически определены рядом белков, которые гарантируют, что они активируются (начинают репликацию) один раз и только один раз за клеточный цикл. Активация начала репликации контролируется фосфорилированием двух белков, Cdt1 и Cdc6, которое катализируется как CDK, так и Dbf4-зависимой протеинкиназой (DDK) Cdc7. Такое фосфорилирование не только инициирует репликацию, но также приводит к деградации этих белков, и, следовательно, ориджин не может обновляться. Когда полимераза и связанные с ней белки (реплисома) сталкиваются с блокадой прогрессирования, обязательно, чтобы реплисома оставалась стабильно связанной с реплицирующейся хроматидой, чтобы репликация могла возобновиться после снятия блокады. Такие блокады могут быть модифицированными dNTP, базовыми сайтами, комплексами белок-ДНК или результатом истощения dNTP. Эта стабилизация реплисом является функцией контрольной точки внутри S-фазы.
Контрольная точка митотического веретена
Расщепление сестринских хроматид в анафазе находится под механическим контролем митотического веретена. Веретено состоит из микротрубочек и нескольких моторных белков как на центросомных концах, так и на концах кинетохор, плюс дополнительные моторы, которые обеспечивают силу между перекрывающимися микротрубочками, которые не прикрепляются к кинетохорам. Существенно, что прикрепление веретена происходит двунаправленным образом, так что сестринские хроматиды находятся под напряжением в метафазе и прикрепляются к обоим полюсам веретена. Как только все кинетохоры прикреплены и выровнены на метафазной пластинке, может продолжаться анафаза, чему способствует активность большой убиквитинлигазы E3, известной как комплекс, стимулирующий анафазу, или циклосома (APC / C). Эта лигаза нацелена на ряд белков, но наиболее важными являются митотические циклины, которые отменяют активность CDK, и секурин, деградация которого позволяет высвобождать сепаразу и расщеплять комплексы когезина на кинетохорах. Активность APC контролируется двумя вспомогательными белками: Cdc20, который функционирует вплоть до метафазы-анафазы, и Cdh1, который продолжает облегчать APC-опосредованное убиквитинирование, как только начинается деградация циклина и сепаразы. Как только сцепление сестринских хроматид высвобождается, натяжение веретена и ассоциированные моторные белки позволяют сестринским хроматидам раздвигаться и образовывать идентичные дочерние ядра.
Функция контрольной точки веретена предотвращает активацию APC Cdc20 в условиях, когда кинетохоры не заняты микротрубочками веретена или прикреплены, но не находятся под напряжением (например, когда они прикреплены к тому же полюсу, известному как merotelic прикрепление). В этих условиях белок контрольной точки веретена Mad2 (Mitotic Arrest Deficient) ингибирует активность Cdc20 как в контексте Cdc20 на неприсоединенных кинетохорах, где он образует комплекс контрольной точки митоза, так и на APC-связанных молекулах. Cdc20 также регулируется киназой митотической контрольной точки Bub1 у дрожжей (почкование не ингибируется беномилом) и ее двоюродным братом Bub1R у млекопитающих. Как Cdc2 неактивен, так и APC, и, следовательно, клетки не могут войти в анафазу.
Контрольная точка веретена включает ряд других белков, список которых растет с эволюционной сложностью. Кроме того, формирование веретена, а также обнаружение и коррекция дефектов веретена находятся под контролем киназ Polo, Aurora и NIMA-related (Nek). В этом отношении контрольная точка веретена разделяет ту же основную предпосылку, что и те, которые контролируют целостность ДНК, рассмотренную выше - предотвращают переход клеточного цикла, в то время как другие эффекторы исправляют дефект, изменяющий геном. Однако митотическая контрольная точка уникальна тем, что она функционирует для поддержания активности CDK, тогда как те, которые функционируют в интерфазе, стремятся поддерживать неактивность CDK.
4. Роль белка р53 в клеточном цикле.
Р53 представляет собой фактор транскрипции, который в высокой степени индуцируется многими стрессовыми сигналами, такими как повреждение ДНК, активация онкогенов и недостаток питательных веществ. Остановка клеточного цикла и апоптоз - наиболее важные результаты активации p53. Многие исследования показали, что функции клеточного цикла p53 и апоптоза важны для предотвращения развития опухоли. p53 также регулирует многие клеточные процессы, включая метаболизм, антиоксидантный ответ и восстановление ДНК. Новые данные свидетельствуют о том, что эта неканоническая активность p53 может также иметь сильные противоопухолевые эффекты в определенном контексте. Этот обзор фокусируется на функциях p53 остановки клеточного цикла и апоптоза, их роли в супрессии опухолей и регуляции решения клеточной судьбы после активации p53.
Остановка клеточного цикла и апоптоз - наиболее заметные биологические результаты активации p53 в культуре клеток и в экспериментах на животных. Основополагающее открытие p53 как ингибитора опосредованной онкогеном трансформации в формировании очагов, вероятно, является результатом его остановки клеточного цикла или активности апоптоза. ДНК-связывающий домен p53 млекопитающих обладает предельной термостабильностью, что облегчает идентификацию чувствительных к температуре мутантов и обеспечивает мощный инструмент для контроля функции p53.
Учитывая способность p53 вызывать как остановку клеточного цикла, так и гибель клеток, регуляция решения клеточного цикла является предметом многочисленных исследований. Это тема, имеющая большое клиническое значение, поскольку р53-опосредованный апоптоз в нормальных тканях участвует в токсичности химиотерапии, ишемии и нейродегенеративных заболеваниях, таких как болезнь Альцгеймера и Паркинсона. Индукция р53-опосредованного апоптоза в опухолевых клетках считается желательным результатом лечения рака, тогда как индукция остановки клеточного цикла может мешать лекарствам, нацеленным на митоз, и снижать эффективность лекарств, повреждающих ДНК.
Функции и роль белка р53
Остановка клеточного цикла с помощью p53 в основном опосредуется активацией транскрипции p21 / WAF1. p53 связывается с двумя сайтами на 2,4 т.п.н. и 1,4 т.п.н. выше промотора p21. 5'-сайт на промоторе p21 является одним из самых сильных проанализированных сайтов связывания p53 с константой диссоциации 5 нм. МРНК p21 сильно индуцируется после активации p53 и является первым геном-мишенью p53, выделенным с использованием метода беспристрастной субтрактивной гибридизации.
Активация p53 также останавливает клетки в фазах G2 / M. Хотя p21 может также ингибировать cyclin B / Cdc2, чтобы ингибировать прогрессию клеточного цикла посредством митоза, другие гены-мишени p53, такие как 14-3-3σ, могут участвовать в блокировании перехода G2 / M. Репрессия p53 промотора cdc25C также способствует аресту G2 / M после повреждения ДНК. Недавние исследования показывают, что индукция микроРНК mir34a вносит вклад в остановку роста с помощью p53, предположительно за счет подавления транскрипции множественных генов-мишеней. Однако нокаут семейства генов mir34 у мышей не влияет на p53-опосредованный арест и апоптоз, указывая тем самым, что функция mir34 in vivo ограничена или избыточна.
p53 также имеет функцию постмитотической контрольной точки, критическую для предотвращения повторной репликации ДНК, когда митотическое веретено нарушено. Обработка нормальных фибробластов мыши препаратами, дестабилизирующими митотическое веретено, такими как нокодазол и колцемид, заставляет их выходить из митоза и останавливаться на фазе G1 с содержанием ДНК 4N. Напротив, p53-дефицитные клетки часто инициируют новые раунды репликации ДНК, когда деление клеток блокируется ядом веретена, производя полиплоидные клетки с 8N и выше комплементарной ДНК. Как и ожидалось, p21 также является критическим медиатором этой постмитотической функции контрольной точки p53 и необходим для сохранения стабильности хромосом. Отсутствие p53 увеличивает нестабильность хромосом, что было обнаружено по быстрому накоплению анеуплоидных клеток при культивировании фибробластов от p53-нулевых мышей in vitro. Хотя отсутствие p53 как такового недостаточно, чтобы вызвать анеуплоидию in vivo, клетки без p53 склонны к накоплению аномальных хромосом после активации онкогена
Остановка клеточного цикла, вызванная повреждением ДНК, обратима после репарации ДНК и подавления р53. Напротив, чрезмерное деление фибробластов человека приводит к опосредованному р53 необратимому аресту, называемому репликативным старением. Частично это происходит из-за хронической активации p53, запускаемой эрозией теломер и передачей сигналов повреждения ДНК. Стареющие клетки обладают уникальными особенностями, такими как большой размер клеток, активная аутофагия, высокая лизосомальная активность SA-β-gal и секреция провоспалительных цитокинов. Повреждающая ДНК обработка опухолевых клеток или активация онкогенов в нормальных фибробластах также вызывает остановку клеточного цикла с признаками, аналогичными репликативному старению, которое называется преждевременным старением. Способность p53 вызывать остановку клеточного цикла является критической для старения, потому что нокаут p21 предотвращает индукцию старения с помощью p53. Повреждение ДНК также вызывает преждевременное старение опухолевых клеток, которое может задерживаться в течение нескольких недель после удаления повреждающего ДНК лекарственного средства. Несмотря на общее мнение, что старение необратимо, инактивация p53 может вызывать повторный вход в клеточный цикл стареющих клеток. Следовательно, старение - это уникальное состояние остановки клеточного цикла, которое очень стабильно, но не является полностью необратимым.
Способность р53 вызывать остановку клеточного цикла и апоптоз обладает значительным противоопухолевым потенциалом, который можно использовать для лечения рака. Однако остановка клеточного цикла с помощью p53 может также препятствовать лечению лекарствами, направленными на митоз, что может способствовать отсутствию общей корреляции между статусом мутации p53 и ответом на лечение рака. Важно отметить, что р53-опосредованный апоптоз и потенциальная токсичность для нормальных органов требуют значительного внимания, поскольку конкретные ингибиторы MDM2 проходят клинические испытания. Для будущего успеха терапии, нацеленной на p53, потребуется лучшее понимание того, как регулируются апоптоз p53 и функции клеточного цикла, развитие способности выборочно манипулировать этими ответами и определение подмножеств опухолей, которые с наибольшей вероятностью будут реагировать на активацию p53 апоптозом или старение.
Изучение механизмов подавления опухоли p53 подтвердило важную роль остановки клеточного цикла и апоптоза в предотвращении прогрессирования опухоли и индукции регрессии установленных опухолей, но также предположило, что неканонические функции p53 в метаболизме и антиоксидантном ответе достаточны для ингибирования спонтанного инициирования опухоли. . Следовательно, будет важно дополнительно изучить механизмы такой «нетоксичной» активности p53 и можно ли фармакологически имитировать эффекты с целью профилактики или лечения рака.
Заключение
Клеточный цикл - важнейший процесс роста организма. Клеточный цикл - это фундаментальный процесс, посредством которого клетка созревает, синтезирует ДНК и делится с образованием дочерних клеток. Все многоклеточные организмы используют деление клеток для роста, поддержания и восстановления клеток и тканей. Одноклеточные организмы используют этот процесс для размножения.
Клеточный цикл - это репликация и воспроизведение клеток у эукариот или прокариот. Для прокариот клеточный цикл, называемый бинарным делением, позволяет им жить, делясь на две новые дочерние клетки. Что касается эукариот, рассмотрите такое животное, как кошка: если кошка получит серьезную травму, ей потребуется клеточный цикл для репликации клеток, чтобы заменить те, которые были повреждены в результате травмы, и, следовательно, нуждается в клеточном цикле для самовосстановления. Зиготы также зависят от клеточного цикла, чтобы сформировать множество клеток, чтобы в конце своего процесса произвести детский организм. Растениям необходим клеточный цикл, чтобы расти и обеспечивать жизнь всем организмам на Земле. и поэтому клеточный цикл очень важен для организмов, поскольку если бы его не было, или если бы он внезапно остановился, жизнь полностью прекратилась бы.
Клеточный цикл влияет на нашу повседневную жизнь. Большинство видов рака являются результатом неправильного клеточного деления, возникающего из-за отклонений в регуляции нормального клеточного цикла. Биология стволовых клеток и регуляция роста органов также включают обширное изучение клеточного цикла. Поэтому на сегодняшний день, огромное значение в изучении рака и других различных заболеваниях, которые мы рассматривали выше, это изучение клеточного цикла и его составляющих.
Использованная литература
Клеточный цикл и продолжительность его стадий у разных организмов
https://pubmed.ncbi.nlm.nih.gov/11355576/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2887316/
https://www.alga.cz/en/a-85-molecular-mechanisms-of-cell-cycle-regulation-.html
https://pubmed.ncbi.nlm.nih.gov/11355576/
https://microbialcell.com/researcharticles/live-fast-die-soon-cell-cycle-progression-and-lifespan-in-yeast-cells/
https://link.springer.com/referenceworkentry/10.1007%2F978-1-4419-9863-7_16
https://pubmed.ncbi.nlm.nih.gov/17388890/
https://www.khanacademy.org/science/ap-biology/cell-communication-and-cell-cycle/cell-cycle/a/cell-cycle-phases
Циклины и циклинзависимые киназы
The Cell Cycle and Cancer. In Medical Cell Biology (Third Edition), 2008
Functional Cell Biology. N.H. Lents, J.J. Baldassare, in Encyclopedia of Cell Biology, 2016
https://genomebiology.biomedcentral.com/articles/10.1186/gb4184
https://www.sciencedirect.com/topics/agricultural-and-biological-sciences/cyclins
Роль сверочных точек «чекпойнтов» в клеточном цикле.
https://www.sciencedirect.com/topics/biochemistry-genetics-and-molecular-biology/cell-cycle-checkpoint
https://www.ptglab.com/products/featured-products/cell-cycle-and-checkpoint-controls/
https://www.khanacademy.org/science/ap-biology/cell-communication-and-cell-cycle/regulation-of-cell-cycle/a/cell-cycle-checkpoints-article
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4990352/
Роль белка р53 в клеточном цикле.
https://pubmed.ncbi.nlm.nih.gov/8880867/
https://www.sciencedirect.com/science/article/abs/pii/S0344033896800884
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4772082/
Beausejour CM, Krtolica A, Galimi F, Narita M, Lowe SW, Yaswen P, Campisi J. 2003. Reversal of human cellular senescence: Roles of the p53 and p16 pathways. EMBO J 22: 4212–4222.
|
|
|
 Скачать 1.58 Mb.
Скачать 1.58 Mb.










