Шпора по общей химии. Строение Атома. Орбиталь область пространства, где наиболее вероятно нахождение электрона. Главное квантовое число (n)
 Скачать 92.5 Kb. Скачать 92.5 Kb.
|
|
Строение Атома. Орбиталь – область пространства, где наиболее вероятно нахождение электрона. Главное квантовое число (n) – характеризует энергетический уровень. Определяет энергию и размеры электронных орбиталей. Орбитальное квантовое число (l) – определяет форму атомной орбитали. Характеризует энергетические подуровни в электронной оболочке атома. (s – 0; p – 1; d – 2; f – 3). Квантовые числа- нужны для того чтобы определяет местоположение электронное окно ядерного пространства. Магнитное квантовое число (m) – характеризует ориентацию орбитали в пространстве. (от –l до +l) Спиновое квантовое число (s) – спин электрона. (+1/2 - ; -1/2 - )Энергитический уровень- уровень, если группа орбиталей имеет одинаковое значение главного квантового числа n. Электронная конфигурация-pfgbcm hfcghtltktybz ‘ktrnhjyjd d fnjvt/ Принцип минимальной энергии. Электроны в основном состоянии заполняют орбитали в порядке повышения уровня энергии орбиталей.Правило В. Клечковского. Увеличение энергии и соответственно заполнение орбиталей происходит в порядке возрастания суммы квантовых чисел n+l, а при равной сумме в порядке возрастания числа n. (1s 2s 3p 4s 3d 4p 5s 4d 5p 6s 5d 4f 6p 7s 6d 5f )Принцип запрета Паули. В атоме не может быть двух электронов , обладающих одинаковым набором квантовых чисел. Правило Гунда. Заполнение орбитали одной подоболочки в основном состоянии атома начинается одиночными электронами с одинаковыми спинами. Энергия ионизации(I1). Энергия необходимая для удаления одного моля электронов от одного моля атомов какого-либо элемента называется первой энергией ионизации I1.[кДж/моль, эВ]. Характеризует восстановительную способность элемента. Первая энергия определяется электронным строением элементов и её изменение имеет периодический характер. Наименьшее значение имеют щелочные элементы находящиеся в начале периода, наибольшее – благородные газы, находящиеся в конце периода. По группе сверху вниз – уменьшается, что обусловлено увеличением размеров атомов и расстояния внешних подоболочек от ядра. Сродство к электрону(Eср). Энергетический эффект присоденения моля электронов к молю нейтральных атомов. Eср выражается в кДж/моль или в эВ. Наибольшие значения имеют галогены, кислород, сера, наименьшие и даже отрицательные значения её – элементы с электронной конфигурацией s2 (He, Be, Mg, Zn) ,с полностью или наполовину заполненными p-подоболочками (Ne, Ar, Kr, N, P, As). Электроотрицательность(ЭО). Способность атомов в соединениях притягивать к себе электроны. Возрастает по периоду, убывает по группам у элементов I, II, V, VI и VII главных подгрупп, III, IV и V – побочных подгрупп, имеет сложную зависимость у элементов III главной подгруппы(минимум у Al), возрастает с увеличением номера периода у элементов VII – VIII побочных подгрупп. Наименьшие значения s-элементы I подгруппы, наибольшие значения – p-элементы VI и VII групп.Электроотрицательность= Основное(устоичивие) состояние атома-такое состояние,которое характеризуется минимальной энергией.Поэтому электроны заполняют орбитали в порядке увеличения их энергии. Теория Бора: 1электроны могут двигаться по стационарным орбитам. 2 При переходе с одной орбиты на другую. Атомный радиус: Атомный радиус не имеет строго определенной гранулы. Атомный радиус- орбитальный радиус не имеет теоритических расчетов, расстояние от ядра до наиболее удаленный от него max электронной плотности. Эффективный радиус- это Химическая связь. Химическая связь- различные виды взаимодествия обуславливающие устойчивость существующих двух или много атомных соединений.Основные черты химической связи: 1снижение общей энергией с-иы по сравнению с энергией суммарных энергией изолированных частиц из которой эта с-ма состоит. 2Перераспределение электронной плотности химической связи. Основные виды химической связи: 1Ковалентная,2Ионная3Металическая4Водородная5Вондервальские взаимодействия.Энергия связи(Eсв). Кол-во энергии, выделяющейся при образовании химической связи, называется энергией химической связи[кДж/моль]. Для многоатомных соединений принимают среднее её значение. Чем больше Eсв тем устойчивее молекула.Длина связи(lсв). Расстояние между ядрами в соединении. Чем больше длина связи – тем меньше энергия связи.Ковалентный угол-угол между вообр. Прямыми,соединяющие центры ядер Кратность связи-число электронных пар, по средствам которых осуществляется между атомами в молекуле. Вид взаимодействия, обуславливающий устойчивое существование многоатомных соединений: молекул, ионов, кристаллических и иных веществ.Ионная. Электростатическое взаимодействие отрицательно и положительно заряженных ионов в химическом соединении. Возникает в случае большой разности ЭО атомов. Не обладает направленностью и насыщеностью. Ковалентная. Связь образованная за счет обобществленной пары электронов, поставляемых по одному от каждого атома. Обладает направленностью и насыщенностью. Если связь образована двумя одинаковыми атомами, то она неполярная. Если один из атомов притягивает электроны сильнее другого, то связь полярная. Мерой полярности служит электрический момент диполя.Полярная- возникает тогда когда соединение у атомов разная электроотрицательность. Неполярная- если,ковалентная связь образуется из атома с одинаковой электроотрицательностью. Эл.плотность- смещена в сторону более электроотр. Атома. Металлическая. Водородная. образованная положительно поляризованным водородом молекулы A-H и отрицательным атомом B другой или той-же молекулы. Межмолекулярная- связь между молекулами. Внутримолекулярная- связь внутри молек. Энерг.водорода связи электроотриц. И с уменьшением размера атома. Степень окисления- положит. Или отрицательное число,которое присваивает степень окисления. 1в простом веществе=0 2в ионном соединение степень окисления равна заряду данного иона.3ковалентных соединениях степень окисления всегда будет равна 14 в щелочных металлов степень окисления=+1(1группа)щелочная +2(2группа) 5В мол.алг.сумма всех степень окисления =0. Комплексные соединения-соединения сложные с ковалентной связью образ по донорно акцепторному механизму. Комплексы бывают:1анионые 2 катионные 3 нейтральные. Комплекс:1внутренняя сфера(то,что в квадратных скобках)2внешняя сфера(то,что за квадратными скобками) K Комплекс образоват.- атом или ион имеющий вакантн.орбиталь.Чаще всего компл. Образ. Dэлементы 6,7,1,2, группы Лиганды-атомы ионы или молекулы они координир.около комплексов образов. Одномолекулярные лиганды- лиганды одного типа молекул ионов. Разноименные лиганды- лиганды 2-х типов молекул и ионов. К-во лигандов- координационное число скординированых вокруг компл.образователей. Внешняя сфера- компенсирует заряд внутри атомные комплексы-комплексы у которых внутренняя сфера имеет отрицат.заряд.Нейтральные компл- комплексы у которого внешняя сфера отсутствует,внутренняя сфера имеет нейтр.заряд или нуливой Гибридизация- смещение Эл.оболочки происходит от орбит. с близкик Ионная связь- электростатичность взаимодествие + и – ионов в соедин.возник при большей разнице в электроотрц.и возм.между 1 и 2 группой и галогенами.Т.к. ионная связь не имеет сферич.х-ра не имеет направленности и ненаправленности. Метод валентных связей. А) химическая связь между двумя атомами возникает как результат перекрытия АО с образованием электронных пар. Б) атомы вступающие в химическую связь, обмениваются между собой электронами, которые образуют связывающие пары. Энергия обмена электронами между атомами(энергия притяжения атомов) вносит основной вклад в энергию химической связи. Дополнительный вклад в энергию связи дают кулоновские силы взаимодействия частиц.В) в соответствии с принципом Паули химическая связь образуется лишь при взаимодействии электронов с разными спинами.Г)характеристики химической связи(энергия, длина, полярность) определяются типом перекрывающихся АО. Метод валентных связей. Ковалентная связь направлена в сторону максимального перекрывания АО реагирующих атомов. Валентность. Способность атома присоединять или замещать определённое число других атомов с образованием химических связей. При переходе в возбуждённое состояние, один из спаренных электронов переходит в свободную орбиталь той же оболочки. Порядок и энергия связи. Порядок связи n=(Nсв-Nр)/2. Nсв – число e на связывающих молекулярных орбиталях, Nр – число e на разрыхляющих молекулярных орбиталях. Если Nсв = Nр, то n=0 и молекула не образуется. С увеличением n в однотипных молекулах растёт энергия связи. В отличии от метода АО, в методе МО допускается, что связь может быть образована одним электроном. Термодинамика. Энтальпия(теплота) образования(H). Тепловой эффект образования 1 моль вещества из простых веществ, устойчивых при 298Ки давлении 100кПа. Энтальпия простых веществ при н.у. принята равной нулю. Энергия- общая колич. Мера движения и взаим. Всех видов материй. Теплота(Q)-размерность ДЖ или количественная мера харатич.колории движ.частиц.данной с-мы или тела. Работа(А)-количественная мера направлен.движением частиц мера энерг.перед.с-мы и другой по действием сил. Параметри состояния- величины позвол. Состояния с-мы их можно непосредственно изменить:1экстенсивные пропорцион. Экстенсив. Кол-во вещества.2Интенсивные не зависим.от кол-ва вещества.Внутренняя энергия- все виды энерг. С-мы,энергия частиц молекул, кроме кинетич. И потенциальной с-мы энергии как целого. Если системе сообщ.определенное количество тепла тела могут обмен энергии и кол-ом теплоты и работы при этом энергитический уровень не исчезает не появ.неоткуда. Тепловой эффект- изменение энергии с-мы при протекании хим. Процесса,с-ма не совершает никакой другой работы,кроме работы расширения.Закон Гесса. Тепловой эффект реакции зависит от природы и состояния исходных вещест и конечных продуктов, но не зависит от пути реакции, т.е. от числа и характера промежуточных стадий. Энтальпия химической реакции равна сумме энтальпий образования продуктов реакции за вычетом суммы энтальпий образования исходных веществ с учётом стехиометрических коэффициентов.Т.к. энтальпия реакции возникает вследствие разрушения одних связей и образования других, то по известным значениям энергий, можно определить энтальпию, и наоборот. Q=[Cc+(mCв)] T Cc – теплоёмкость сосуда калориметра. Cв – удельная теплоёмкость реагирующей смеси и или воды m – масса реагирующей смеси или воды. Энтропия. Мера неупорядоченности состояния системы. W – число микросостояний системы, термодинамическая вероятность. S = RlnW. В отличии от других термодинамических функций, можно определить не только изменение, но и абсолютное значение. При абсолютном нуле энтропия идеального кристалла равна нулю(третий закон термодинамики). Энтропия растёт по мере повышения температуры. Второй закон термодинамики для изолированных систем. В изолированных системах самопроизвольно идут только такие процессы, которые сопровождаются увеличением энтропии. Энергия Гиббса. – критерий самопроизвольного протекания реакции.(для изобарно-изотермических процессов). G = H - TS G = Gкон - Gнач G = - RTlnKравн G = -zFE G = S, - удельная поверхностная энергия. Если G<0 то реакция может протекать самопроизвольно. Константа химического равновесия(только газы). Константа равновесия-атом произведений равн.концентрации продукта в степени хим.коэффициентов к произвольной степени стихий Пример: 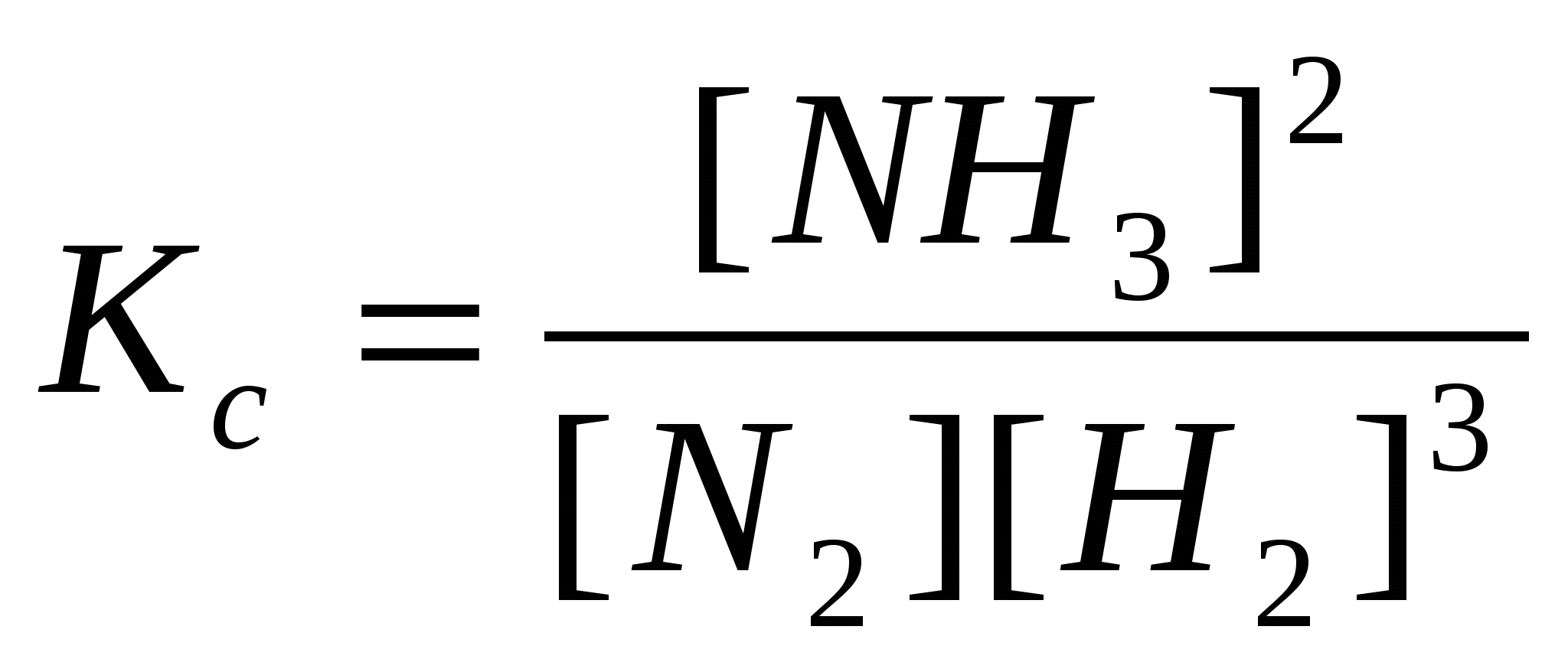 Kравн = [L]l[M]m/[D]d[B]b Кр=Кравн(RT) Kр = exp(-H/(RT)+ S/R) Принцип Ле Шателье. Если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие. Химическая кинетика. Х.К-изучает механизм реакций и скорость Скорость химической реакции равна изменению количества вещества в единицу времени в единице реакционного пространства. Гомогенная реакция протекает в одной фазе. Гетерогенные реакции протекают на границе раздела фаз. [моль*м-3/с] не учитывая газы. Vср = -Dc/Dt Vмг = dc/dt Vпр=Kпр*[A]a[B]b Vобр=Kобр*[С]с[В]d Порядок реакции. Суммы порядков реакции по реагентам. K = lnc/t Правило Ван-Гоффа. V2 = V1T/ 10 Уравнение Аррениуса. K = K0e(-Ea/RT), K – константа скорости реакции, K0 – предэкспотенциальный множитель, e – это e. Ea – энергия активации. Если при изменении температуры, концентрация реагентов остаётся постоянной то: V = V0exp[-Ea/(RT)] Ea/(2,3RT)=lgk/(1/T) Энергия активации. Энергия необходимая для перехода вещества в состояние активированного комплекса. Молекулярность реакции. Число молекул реагента, принимающих участие в простейшей (элементарной) стадии, называется её молекулярностью. Фотохимические реакции. E = h=hc/ Идеальным раствором называют раствор, в котором не происходит химической реакции между компонентами, а силы межмолекулярного взаимодействия между компонентами одинаковы. Закон Рауля. Температура кипения раствора выше температуры кипения растворителя. Tкип=KэCm Температура кристализации раствора ниже температуры кристализации чистого растворителя. Tзам=KкCm Осмотическое давление. V=nRT =nRT/V =cRT - осмотическое давление. С – молярная концентрация раствора. Активность. a=с - коэффициент активности. Закон распределения. При постоянной температуре соотношение равновесных концентраций между несмешивающимися жидкостями(фазами) является величиной постоянной, независит от ближнего кол-ва компонентов. Kрас=CA/CB CA и CB –молярные концентрации вещества в жидкостях. Kрас – коэффициент распределения. Степень диссоциации(). Отношение числа молекул, диссоциированных на ионы, к обьщему числу молекул растворённого электролита. Катализ Катализ- распространенное явление,при котором изменен.скорость реакции при ведении малых количеств посторон.в-в. Катализатор- в-ва которые ускоряют. Ингиторы- в-ва которые замежляют. Ферменты-биокатализатор. Закон Генри. Растворимость газов в жидкости пропорциональна их парциальному давлению над жидкостью. _______ = n+mm+nn-m pH=-lg aH+ Буферные растворы. Растворы, pH которых относительно мало меняется при добавлении в них небольших количеств кислоты или основания. Произведение растворимости(ПР). Произведение активности ионов электролита, содержащегося в его насыщенном растворе при данной температуре, есть величина постоянная. ПР=(nCрАm+)n(mCрBn-)m Гидролизом солей называют реакции обмена между водой и растворёнными в ней солями. Степень гидролиза . Сгидр концентрация гидролизованных молекул. С – исходная концентрация растворённых молекул. = Сгидр/С Законы Фарадея.
F=96500Кл(А*с) E=-[G/(nF)] n – число молей эквивалентов. i=I/S Плотность тока. = 0+(0.059/n)*lnCM m = MэIt/ |
