Структура и функции нуклеиновых кислот
 Скачать 1.58 Mb. Скачать 1.58 Mb.
|
|
СТРУКТУРА И ФУНКЦИИ НУКЛЕИНОВЫХ КИСЛОТ История открытия и изучения нуклеиновых кислот. Нуклеиновые кислоты – это биополимеры, состоящие из нуклеотидов и выполняющие функцию хранения, передачи и реализации генетической информации. Впервые обнаружены Фридрихом Мишером в 1869 г. в клетках, богатых ядерным материалом. Ниже приведены основные события из истории изучения нуклеиновых кислот. 1944 – О. Эйвери, К. Мак-Леод, М. Мак-Карти доказали роль ДНК как носителя генетической информации.
Химическая природа нуклеиновых кислот. Различия между ДНК и РНК. Н  уклеиновые кислоты (ДНК и РНК) относятся к сложным высокомолекулярным соединениям, состоят из небольшого числа индивидуальных химических компонентов более простого строения. Так, при полном гидролизе нуклеиновых кислот (нагревание в присутствии хлорной кислоты) в гидролизате обнаруживают пуриновые и пиримидиновые основания, углеводы (рибоза и дезоксирибоза) и фосфорную кислоту. уклеиновые кислоты (ДНК и РНК) относятся к сложным высокомолекулярным соединениям, состоят из небольшого числа индивидуальных химических компонентов более простого строения. Так, при полном гидролизе нуклеиновых кислот (нагревание в присутствии хлорной кислоты) в гидролизате обнаруживают пуриновые и пиримидиновые основания, углеводы (рибоза и дезоксирибоза) и фосфорную кислоту. В молекуле ДНК углевод представлен дезоксирибозой, а в молекуле РНК – рибозой, отсюда их названия: дезоксирибонуклеиновая (ДНК) и рибонуклеиновая (РНК) кислоты. Кроме того, они содержат фосфорную кислоту, по два пуриновых и по два пиримидиновых основания; различия только в пиримидиновых основаниях: в ДНК содержится тимин, а в РНК – урацил. В составе ДНК и РНК открыты так называемые минорные (экзотические) азотистые основания (строение некоторых из них приводится далее). Углеводы (рибоза и дезоксирибоза) в молекулах ДНК и РНК находятся в β-D-рибофуранозной форме: 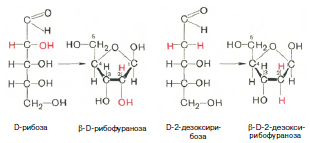 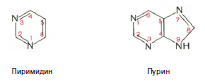 В составе некоторых фаговых ДНК обнаружена молекула глюкозы, которая соединяется гликозидной связью с 5-оксиметилцитозином. Основу структуры пуриновых и пиримидиновых оснований составляют два ароматических гетероциклических соединения – пиримидин и пурин. Молекула пурина состоит из двух конденсированных колец: пиримидина и имидазола. 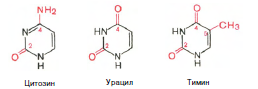 В составе нуклеиновых кислот встречаются три главных пиримидиновых основания: цитозин, урацил и тимин. В составе нуклеиновых кислот встречаются три главных пиримидиновых основания: цитозин, урацил и тимин. Помимо главных пиримидиновых оснований, в составе нуклеиновых кислот открыты минорные пиримидиновые основания, 5-метил- и 5-оксиметилцитозин, дигидроурацил, псевдоурацил, 1-метилурацил, оротовая кислота, 5-карбоксиурацил, 4-тиоурацил и др. Забегая несколько вперед, укажем, что только для тРНК список минорных оснований приближается к 50. На долю минорных оснований приходится до 10% всех нуклеотидов тРНК, что имеет, очевидно, важный физиологический смысл (защита молекулы РНК от действия гидролитических ферментов). Структурные формулы ряда минорных пиримидиновых оснований представлены в форме нуклеозидов – соединений с углеводным компонентом: 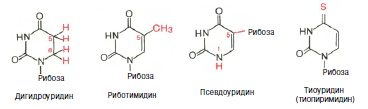 Два пуриновых основания, постоянно встречающихся в гидролизатах нуклеиновых кислот, имеют следующее строение: 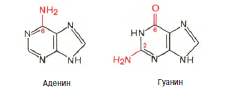 К минорным нуклеозидам пуринового ряда, обнаруживаемым в составе ДНК и РНК, относятся инозин, N6-метиладенозин, N2-метилгуанозин, ксантин, гипоксантин, 7-метилгуанозин и др. 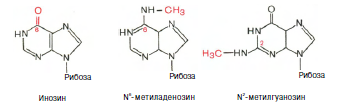 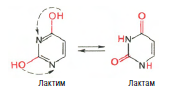 Одним из важных свойств свободных азотистых оснований (содержащих оксигруппы) является возможность их существования в двух таутомерных формах, в частности лактим- и лактамной формах, в зависимости от значения рН среды: при рН 7,0 они представлены в лактамной форме, при снижении величины рН – в лактимной форме. Таутомерные превращения можно представить на примере урацила. Оказалось, что в составе природных нуклеиновых кислот все оксипроизводные пуринов и пиримидинов находятся в лактамной форме. О 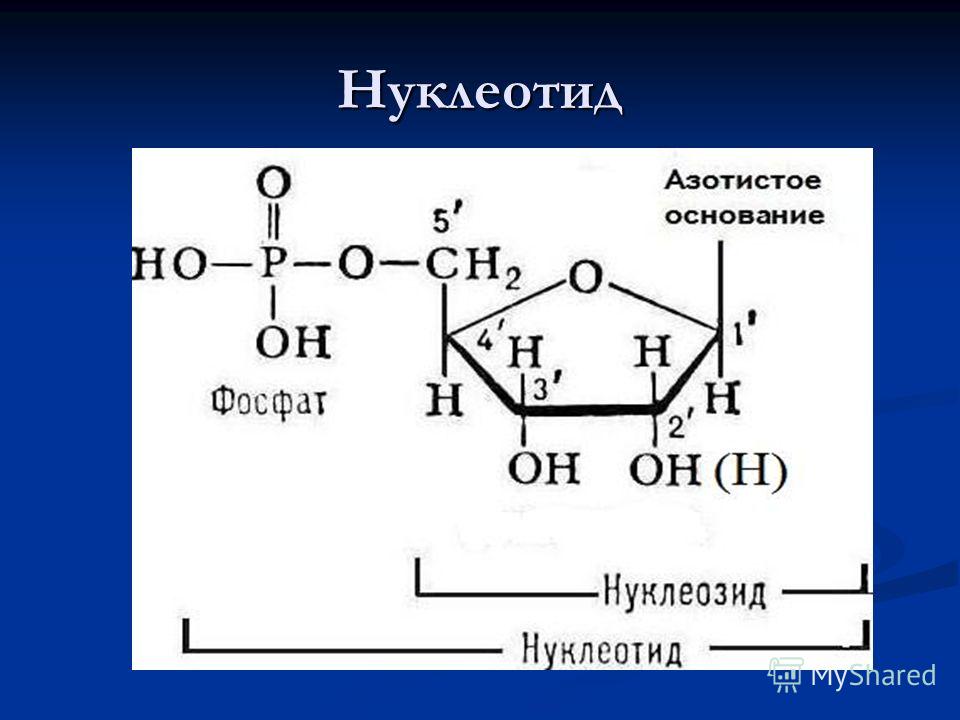 локализации и количественном содержании нуклеиновых кислот в клетках получены определенные данные. Доказано, что количественное содержание ДНК в клетках одного и того же организма отличается локализации и количественном содержании нуклеиновых кислот в клетках получены определенные данные. Доказано, что количественное содержание ДНК в клетках одного и того же организма отличаетсяудивительным постоянством и исчисляется несколькими пикограммами, однако в клетках разных видов живых организмов имеются существенные количественные различия в содержании ДНК. Хорошо известно также, что ДНК преимущественно сосредоточена в ядре, а в митохондриях и хлоропластах содержится только небольшой процент клеточной ДНК. О количестве РНК нет точных данных, поскольку содержание ее в разных клетках в значительной степени определяется интенсивностью синтеза белка. На долю РНК приходится около 5–10% от общей массы клетки. Современная классификация различных типов клеточной РНК основывается на данных топографии, функции и молекулярной массы. Выделяют три главных вида РНК: матричную (информационную) – мРНК, которая составляет 2–3% от всей клеточной РНК; рибосомную – рРНК, составляющую 80–85% и транспортную – тРНК, которой около 16%. Эти 3 вида различаются нуклеотидным составом и функциями (табл. 3.1). 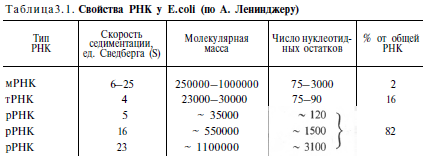 Матричная РНК (мРНК) синтезируется в ядре на матрице ДНК, затем поступает в рибосому, выполняя матричную функцию при синтезе белка (см. главу 14). По предположению акад. А.С. Спирина, часто мРНК при поступлении из ядра в цитоплазму образует со специфическими РНК-связывающими белками комплексы – так называемые информосомы, способные к обратимой диссоциации. Информосомы рассматриваются как транспортная форма мРНК, способствующая образованию полирибосом в цитоплазме. Транспортные РНК (тРНК) имеют небольшую молекулярную Матричная РНК (мРНК) синтезируется в ядре на матрице ДНК, затем поступает в рибосому, выполняя матричную функцию при синтезе белка (см. главу 14). По предположению акад. А.С. Спирина, часто мРНК при поступлении из ядра в цитоплазму образует со специфическими РНК-связывающими белками комплексы – так называемые информосомы, способные к обратимой диссоциации. Информосомы рассматриваются как транспортная форма мРНК, способствующая образованию полирибосом в цитоплазме. Транспортные РНК (тРНК) имеют небольшую молекулярнуюмассу и содержатся в растворимой фракции цитоплазмы, выполняя функцию переноса аминокислот к месту белкового синтеза – рибосоме. Рибосомные РНК (рРНК), как видно из данных табл. 3.1, имеют разную и значи- тельно большую молекулярную массу. Они локализуются в двух субчастицах рибосом 50S и 30S у Е.coli и 60S и 40S в клетках животных(табл. 3.2). Субчастица 60S содержит три разных рРНК (5S, 5,8S и 28S рРНК), в то время как субчастица 40S – одну молекулу 18S рPHK. Детально роль рРНК в белковом синтезе пока не выяснена (см. главы 13, 14). Биологическая роль нуклеиновых кислот заключается в хранении, реализации и передаче генетической информации. Возможно, что нуклеиновые кислоты обеспечивают различные виды биологической памяти – иммунологическую, нейрологическую и т. д., а также играют существенную роль в регуляции биосинтетических процессов. 3. ДНК, виды, локализация в клетке, биологические функции. Первичная и вторичная структура ДНК. ДНК имеет первичную, вторичную и третичную структуры. Локализация в клетке: 99% находятся в хромосомах. Функция: Содержит наследственную информацию о строении белка. П 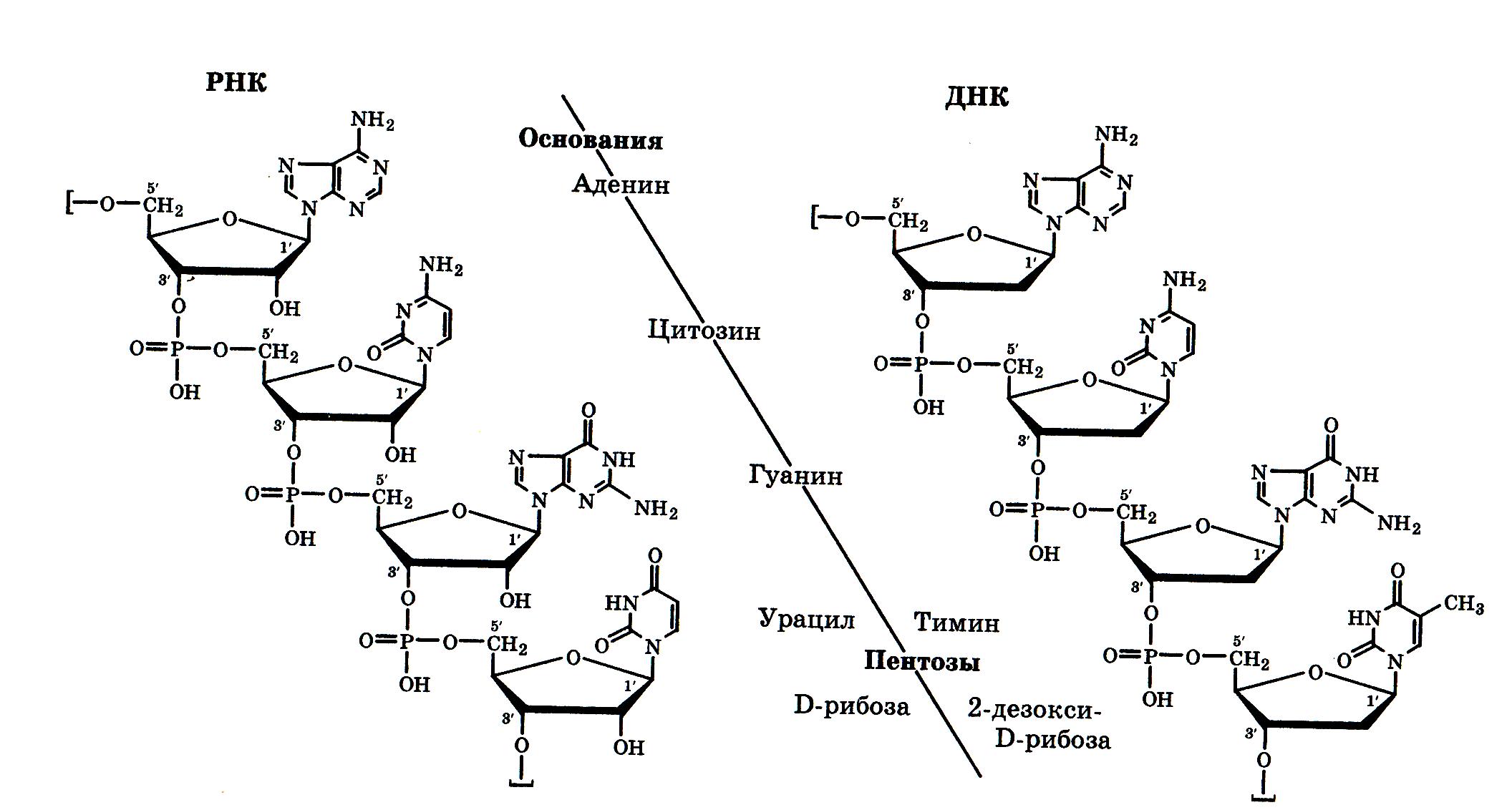 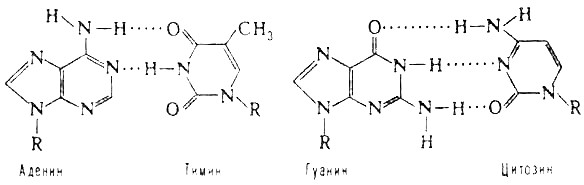 ервичная структура ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи. Сокращенно эту последовательность записывают с помощью однобуквенного кода от 5 к 3 концу, например 5-А-Г-Ц-Т-Т-А-Ц-А-3. Первичная структура строго специфична и индивидуальна для каждой природной ДНК и представляет кодовую форму записи биологической информации (генетический код). Впервые доказательство генетической роли ДНК получено в 1944 г. Освальдом Эйвери с сотрудниками в опытах по трансформации, осуществленных на бактериях. Содержание нуклеотидов в ДНК, подчиняется закономерностям, выявленным Эрвином Чаргафом (1949): суммарное количество пуриновых основа-ний равно сумме пиримидиновых, причем количество А равно количеству Т, а количество Г – количеству Ц. Эти закономерности определяются особенностями вторичной структуры ДНК. ервичная структура ДНК – порядок чередования дезоксирибонуклеозидмонофосфатов (дНМФ) в полинуклеотидной цепи. Сокращенно эту последовательность записывают с помощью однобуквенного кода от 5 к 3 концу, например 5-А-Г-Ц-Т-Т-А-Ц-А-3. Первичная структура строго специфична и индивидуальна для каждой природной ДНК и представляет кодовую форму записи биологической информации (генетический код). Впервые доказательство генетической роли ДНК получено в 1944 г. Освальдом Эйвери с сотрудниками в опытах по трансформации, осуществленных на бактериях. Содержание нуклеотидов в ДНК, подчиняется закономерностям, выявленным Эрвином Чаргафом (1949): суммарное количество пуриновых основа-ний равно сумме пиримидиновых, причем количество А равно количеству Т, а количество Г – количеству Ц. Эти закономерности определяются особенностями вторичной структуры ДНК.В 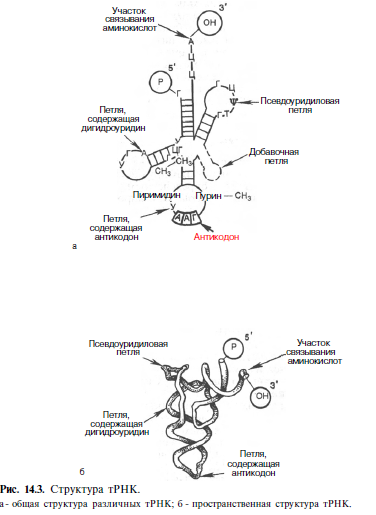 торичная структура ДНК представляет собой спираль, состоящую из двух антипараллельных полинуклеотидных цепей, закрученных относительно друг друга и вокруг общей оси. Все основания цепей ДНК расположены стопкой внутри двойной спирали, а пентозофосфатный остов – снаружи. Полинуклеотидные цепи удерживаются друг относительно друга за счет водородных связей между комплементарными основаниями. Дополнительная стабилизация спирали происходит за счет гидрофобных взаимодействий, возникающих между азотистыми основаниями в стопке. Выяснение вторичной структуры ДНК (Д.Уотсон, Ф.Крик, 1953) стало одним из величайших открытий в естествознании, так как позволило раскрыть механизм передачи наследственной информации в ряду поколений. торичная структура ДНК представляет собой спираль, состоящую из двух антипараллельных полинуклеотидных цепей, закрученных относительно друг друга и вокруг общей оси. Все основания цепей ДНК расположены стопкой внутри двойной спирали, а пентозофосфатный остов – снаружи. Полинуклеотидные цепи удерживаются друг относительно друга за счет водородных связей между комплементарными основаниями. Дополнительная стабилизация спирали происходит за счет гидрофобных взаимодействий, возникающих между азотистыми основаниями в стопке. Выяснение вторичной структуры ДНК (Д.Уотсон, Ф.Крик, 1953) стало одним из величайших открытий в естествознании, так как позволило раскрыть механизм передачи наследственной информации в ряду поколений.4. РНК, виды, локализация в клетке, биологические функции. Особенности структурной организации РНК: первичная и вторичная структуры. Функции: Кодирует информацию с участка ДНК и переносит ее к месту сборки белка, переносит аминокислоту к месту сборки белка. Первичная структура нуклеиновых кислот – это нуклеотидный состав и определенная последовательность нуклеотидных звеньев в полимерной цепи. Вторичная структура РНК. Молекула рибонуклеиновой кислоты построена из одной полинуклеотидной цепи. Отдельные участки цепи РНК образуют спирализованные петли - "шпильки", за счёт водородных связей между комплементарными азотистыми основаниями A-U и G-C. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или даже одноцепочечные петли, не вписывающиеся в двойную спираль. Наличие спирализованных участков характерно для всех типов РНК. Молекула РНК построена из одной полинуклеотидной цепи. Отдельные участки цепи образуют спирализованные петли – шпильки, за счет водородных связей между комплементарными азотистыми основаниями. Участки цепи РНК в таких спиральных структурах антипараллельны, но не всегда полностью комплементарны, в них встречаются неспаренные нуклеотидные остатки или одноцепочечные петли. Наличие вторичной структуры в виде спирализованных участков характерно для всех типов РНК. При взаимодействии спирализованных элементов вторичной структуры возникает упорядоченная третичная структура. Так, возможно образование дополнительных водородных связей между нуклеотидными остатками, достаточно удаленными друг от друга, или связей между ОН-группами остатков рибозы и основаниями. Третичная структура РНК стабилизирована ионами двухвалентных металлов (Mg2+). Содержащиеся в клетке РНК различаются размером, составом, функциями и локализацией. В цитоплазме содержится стабильная РНК нескольких видов: транспортная (тРНК), матричная (мРНК), рибосомальная (рРНК). В ядре локализована ядерная РНК, основная часть которой представлена предшественниками цитоплазматических РНК. Первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5- и 3-концов. Так, на 5-конце присутствует модифицированный нуклеотид 7-метилгуанозин-5-трифосфат (кэп). Этот сайт распознается рибосомой. На 3-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков (полиА). Эта последовательность обеспечивает стабильность мРНК, препятствуя еѐ гидролизу. На долю мРНК приходится до 2% от всех РНК. Пространственную структуру любых тРНК описывают универсальной моделью «клеверного листа». В состав тРНК входят минорные основания, которые поддерживают определенную третичную структуру молекулы и делают ее устойчивой к действию нуклеаз цитоплазмы. 3- и 5-концы полинуклеотидной цепи спарены и образуют акцептирующий стебель, он завершается на 3-конце последовательностью ЦЦА. Противостоит акцептирующему стеблю антикодоновая петля, которая содержит в своей средней части антикодон, комплементарный кодону данной аминокислоты в мРНК. Каждая тРНК имеет свой специфический антикодон. Псевдоуридиловая петля осуществляет взаимодействие тРНК с рибосомой, дигидроуридиловая петля участвует во взаимодействии с аминоацил-тРНК-синтетазой. Функции добавочной петли мало исследованы, предполагается, что с еѐ помощью уравнивается длина разных молекул тРНК. На долю тРНК приходится 15-16% от всех РНК. 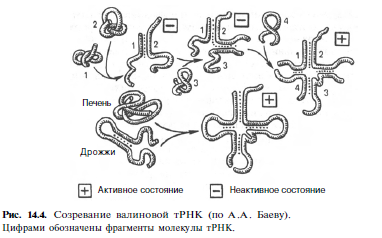 Больше всего (80-82%) в клетке содержится рибосомальной РНК. Различают 5S, 5.8S, 18S и 28S рРНК. Они имеют многочисленные спирализованные участки и образуют комплексы с белками – рибосомы. Рибосомы эукариотических клеток имеют константу седиментации 80S, состоят из двух субъединиц. Малая 40S-субъединица содержит 18S РНК и 33 белка, большая 60S-субъединица содержит 28S, 5S и 5.8S РНК, а также 50 белков. рРНК имеют V-образную или Y-образную форму. Они образуют каркас, к которому прикрепляются белки, создавая плотно упакованный рибонуклеопротеин. Вторичная структура создается за счет коротких двухспиральных шпилек. Примерно треть молекулы представлена одно-тяжевыми участками, с которыми преимущественно связаны белки рибосом. Основная роль РНК – непосредственное участие в биосинтезе белка. Известны три вида клеточных РНК, которые отличаются по местоположению в клетке, составу, размерам и свойствам, определяющим их специфическую роль в образовании белковых макромолекул: - информационные (матричные) РНК передают закодированную в ДНК информацию о структуре белка от ядра клетки к рибосомам, где и осуществляется синтез белка; первичная структура всех мРНК, независимо от уникальности их кодирующей последовательности, имеет одинаковое строение 5'- и З'-концов. Так, на 5'- конце присутствует модифицированный нуклеотид 7-метилгуанозин-5'-трифосфат (кэп). Несколько десятков нуклеотидов отделяют кэп от инициирующего кодона, обычно это триплет -AUG-. За кодирующим участком следует один из терминирующих кодонов -UGA-, -UUA-, -UAG-. На 3'-конце большинства мРНК присутствует последовательность нуклеотидов из 100-200 аденозинмонофосфатных остатков. - транспортные РНК собирают аминокислоты в цитоплазме клетки и переносят их в рибосому; молекулы РНК этого типа "узнают" по соответствующим участкам цепи информационной РНК, какие аминокислоты должны участвовать в синтезе белка. Пространственную структуру любых тРНК, независимо от различий в последовательности нук-леотидов, описывают универсальной моделью "клеверного листа". В каждой молекуле тРНК есть участки цепи, не участвующие в образовании водородных связей между нуклеотидными остатками. К ним, в частности, относят участок, ответственный за связывание с аминокислотой на 3'-конце молекулы и антикодон - специфический триплет нуклеотидов, взаимодействующий комплементарно с кодоном мРНК. - рибосомные РНК обеспечивают синтез белка определенного строения, считывая информацию с информационной (матричной) РНК. рРНК образуют комплексы с белками, которые называют рибосомами. Каждая рибосома состоит из двух субъединиц - малой (40S) и большой (60S). Субъединицы рибосом различаются не только набором рРНК, но и количеством и структурой белков. 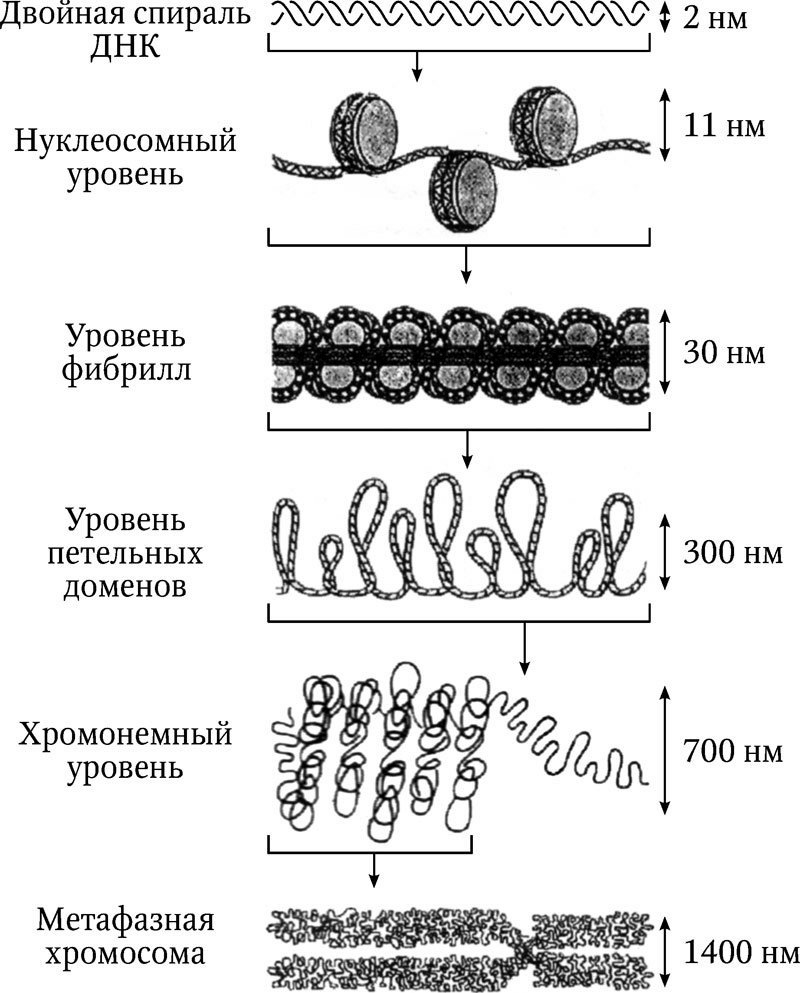 5. Роль белков в структурной организации нуклеиновых кислот. Нуклеопротеины. Структура хромосом. Строение рибосом эукариот. Информосома. Нуклеопротеины - это сложные белки, содержащие в качестве небольшой части нуклеиновые кислоты (до 65%). НП состоят из 2-х частей: белковой (содержит гистоны и протамины, которые являясь основными белками, придают основные свойства) и простетической, представленной НК, сообщающими кислотные свойства. Взаимодействие между этими частями по ион-ионному механизму. Все НП по составу НК можно разделить на 2 группы: рибонуклеопротеины (РНП) и дезоксирибонуклеопротеины (ДНП). Состав НК: НК - высокомолекулярные органические вещества, полинуклеотиды. Мономерами являются мононуклеотиды. Каждый мононуклеотид состоит из: углевода, азотистого основания и фосфорной кислоты. Так, РНК содержит -D-рибофуранозу (рибозу), одно из 4-х возможных азотистых оснований (А, Г, Ц или У) и остаток фосфорной кислоты. ДНК содержит -D-дезоксирибофуранозу (дезоксирибозу), одно из 4-х возможных азотистых оснований (А, Г, Ц или Т) и остаток фосфорной кислоты. Структура хромосом Хромосомы эукариот имеют сложное строение. Основу хромосомы составляет линейная (не замкнутая в кольцо) макромолекула дезоксирибонуклеиновой кислоты (ДНК) значительной длины (например, в молекулах ДНК хромосом человека насчитывается от 50 до 245 миллионов пар азотистых оснований). В растянутом виде длина хромосомы человека может достигать 5 см. Помимо неё, в состав хромосомы входят пять специализированных белков: H1, H2A, H2B, H3 и H4 (так называемые гистоны) и ряд негистоновых белков. Последовательность аминокислот гистонов высококонсервативна и практически не различается в самых разных группах организмов. В интерфазе хроматин не конденсирован, но и в это время его нити представляют собой комплекс из ДНК и белков. Макромолекула ДНК обвивает октомеры (структуры, состоящую из восьми белковых глобул) гистоновых белков H2A, H2B, H3 и H4, образуя структуры, названные нуклеосомами. В целом вся конструкция несколько напоминает бусы. Последовательность из таких нуклеосом, соединённых белком H1, называется нуклеофиламентом (nucleofilament), или нуклеосомной нитью, диаметром около 10 нм. В ранней интерфазе (фаза G1) основу каждой из будущих хромосом составляет одна молекула ДНК. В фазе синтеза (S) молекулы ДНК вступают в процесс репликации и удваиваются. В поздней интерфазе (фаза G2) основа каждой из хромосом состоит из двух идентичных молекул ДНК, образовавшихся в результате репликации и соединённых между собой в районе центромерной последовательности. Перед началом деления клеточного ядра хромосома, представленная на этот момент цепочкой нуклеосом, начинает спирализовываться, или упаковываться, образуя при помощи белка H1 более толстую хроматиновую нить, или хроматиду, (chromatin fiber) диаметром 30 нм. В результате дальнейшей спирализации диаметр хроматиды достигает ко времени метафазы 700 нм. Значительная толщина хромосомы (диаметр 1400 нм) на стадии метафазы позволяет, наконец, увидеть её в световой микроскоп. Конденсированная хромосома имеет вид буквы X (часто с неравными плечами), поскольку две хроматиды, возникшие в результате репликации, по-прежнему соединены между собой в районе центромеры Основную массу хроматина составляют белки гистоны. Гистоны являются компонентом нуклеосом, — надмолекулярных структур, участвующих в упаковке хромосом. Нуклеосомы располагаются довольно регулярно, так что образующаяся структура напоминает бусы. Нуклеосома состоит из белков четырех типов: H2A, H2B, H3 и H4. В одну нуклеосому входят по два белка каждого типа — всего восемь белков. Гистон H1, более крупный, чем другие гистоны, связывается с ДНК в месте ее входа на нуклеосому. Нить ДНК с нуклеосомами образует нерегулярную соленоид-подобную структуру толщиной около 30 нанометров, так называемую 30 нм фибриллу. Дальнейшая упаковка этой фибриллы может иметь различную плотность. Если хроматин упакован плотно его называют конденсированным или гетерохроматином, он хорошо видим под микроскопом. ДНК, находящаяся в гетерохроматине не транскрибируется, обычно это состояние характерно для незначащих или молчащих участков. В интерфазе гетерохроматин обычно располагается по периферии ядра (пристеночный гетерохроматин). Полная конденсация хромосом происходит перед делением клетки. Если хроматин упакован неплотно, его называют эу- или интерхроматином. Этот вид хроматина гораздо менее плотный при наблюдении под микроскопом и обычно характеризуется наличием транскрипционной активности. Плотность упаковки хроматина во многом определяется модификациями гистонов: ацетилированием ифосфорилированием. Строение рибосомы эукариот Рибосома (от «РНК» и soma – тело) – клеточный немембранный органоид, осуществляющий трансляцию (считывание кода мРНК и синтез полипептидов). Молекула белка рождается в цитоплазме клетки на свободных рибосомах или на цистернах транспортно-накопительной системы. Специальные белки шапероны, укладывают растущую цепочку в ажурную конструкцию. Затем, если нужно, белок достраивают. Различают 2 основных типа рибосом – прокариотные и эукариотные. В митохондриях и хлоропластах также имеются рибосомы, которые близки к рибосомам прокариот. Рибосомы эукариот расположены на мембранах эндоплазматической сети (гранулярная ЭС) и в цитоплазме. Прикрепленные к мембранам рибосомы синтезируют белок «на экспорт», а свободные рибосомы – для нужд самой клетки. 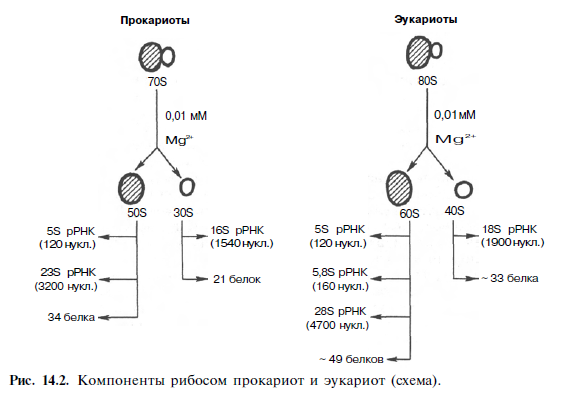 Рибосомы состоят из двух различных субчастиц, каждая из которых построена из рибосомной РНК и многих белков. Рибосомы и их субчастицы обычно классифицируют не по массам, а в соответствии с коэффициентами седиментации. Так. коэффициент седиментации полной эукариотической рибосомы составляет около 80 единиц Сведберга (80S), а коэффициент седиментации ее субчастиц составляет 40S и 60S. Меньшая 40S-субчастица состоит из одной молекулы 18S-рРНК и 30-40 белковых молекул. Большая 60S-субчастица содержит три типа рРНК с коэффициентами седиментации 5S, 5,8S и 28S и 40-50 белков (например, рибосомы гепатоцитов крысы включают 49 белков). В присутствии мРНК (mRNA) субчастицы объединяются с образованием полной рибосомы, масса которой примерно в 650 раз больше массы молекулы гемоглобина. Рибосомы имеют диаметр 20-200 нм и их можно видеть в электронный микроскоп. Структурная организация рибосом полностью не выяснена. Однако известно, что молекулы мРНК проходит через щель около характерной структуры в виде «рога» на малой субчастице, причем эта щель ориентирована как раз в промежуток между двумя субчастицами. тРНК также связываются вблизи этого участка. Для сравнения на схеме в том же масштабе показана молекула тРНК. В клетках эукариот рибосомы формируются в ядрышке, где на ДНК синтезируется р-РНК, к которой затем присоединяются белки. Субчастицы рибосомы выходят из ядра в цитоплазму, и здесь завершается формирование полноценных рибосом. В цитоплазме рибосомы свободно находятся в цитоплазматическом матриксе (гиалоплазме) или прикрепляются к внешним мембранам ядра и эндоплазматической сети. Свободные рибосомы синтезируют белки для внутренних нужд клетки. Рибосомы на мембранах образуют комплексы – полирибосомы, которые синтезируют белки, поступающие через эндоплазматическую сеть в аппарат Гольджи и затем секретируемые клеткой. Количество рибосом в клетке зависит от интенсивности биосинтеза белка – их больше в клетках активно растущих тканей (меристем растений, зародышей и т. п.). В хлоропластах и митохондриях есть свои собственные мелкие рибосомы, они обеспечивают этим органоидам автономный (независимый от ядра) биосинтез белков. Каждая рибосома состоит из двух субчастиц - большой и малой. Рибосомы состоят из примерно равных (по массе) количеств РНК и белка (т.е. представляют собой рибонуклеопротеиновые частицы). Входящая в их состав РНК, называемая рибосомной РНК (рРНК), синтезируется в ядрышке. Вместе те и другие образуют сложную трехмерную структуру, обладающую способностью к самосборке. Во время синтеза белка на рибосомах аминокислоты, из которых строится полипептидная цепь, последовательно одна за другой присоединяются к растущей цепи. Рибосома служит местом связывания для молекул, участвующих в синтезе, т. е. таким местом, где эти молекулы могут занять по отношению друг к другу совершенно определенное положение. В синтезе участвуют: матричная РНК (мРНК), несущая генетические инструкции от ядра клетки, транспортная РНК (тРНК), доставляющая к рибосоме требуемые аминокислоты, растущая полипептидная цепь, а также ряд факторов, ответственные за инициацию, элонгацию и терминацию цепи. В эукариотических клетках отчетливо видны две популяции рибосом - свободные рибосомы и рибосомы, присоединенные к эндоплазматическому ретикулуму. Строение тех и других идентично, но часть рибосом связана с эндоплазматическим ретикулоумом через белки, которые они синтезируют. Такие белки обычно секретируются. Примером белка, синтезируемого свободными рибосомами, может служить гемоглобин, образующийся в молодых эритроцитах. В процессе синтеза белка рибосома перемещается вдоль нитевидной молекулы мРНК. Процесс идет более эффективно, когда вдоль мРНК перемещается не одна рибосома, а одновременно много рибосом, напоминающих в этом случае бусины на нитке. Такие цепи рибосом называются полирибосомами или полисомами. На эндоплазматическом ретикулуме полисомы обнаруживаются в виде характерных завитков. Рибосомный синтез белка-многоэтапный процесс. Первая стадия (инициация) начинается с присоединения матричной РНК (мРНК) к малой рибосомной субчастице, не связанной с большой субчастицей. Характерно, что для начала процесса необходима именно диссоциированная рибосома. К образовавшемуся т. наз. инициаторному комплексу присоединяется большая рибосомная субчастица. В стадии инициации участвуют спец. инициирующий кодон (см. Генетический код), инициаторная транспортная РНК (тРНК) и специфич. белки (т. наз. факторы инициации). Пройдя стадию инициации, рибосома переходит к последоват. считыванию кодонов мРНК по направлению от 5'- к 3'-концу, что сопровождается синтезом полипептидной цепи белка, кодируемого этой мРНК В этом процессе рибосома функционирует как циклически работающая мол. машина. Рабочий цикл рибосомы при элонгации состоит из трех тактов: 1) кодонзависимого связывания аминоацил-тРНК (поставляет аминокислоты в рибосому), 2) транспептидации-переноса С-конца растущего пептида на аминоацил-тРНК, т.е. удлинения строящейся белковой цепи на одно звено, 3) транслокации-перемещения матрицы (мРНК) и пептидил-тРНК относительно рибосомы и переход рибосомы в исходное состояние, когда она может воспринять след. аминоацил-тРНК. Когда рибосома достигнет специального терминирующего кодона мРНК, синтез полипептида прекращается. При участии специфич. белков (т. наз. факторов терминации) синтезир. полипептид освобождается из рибосомы. После терминации рибосома может повторить весь цикл с др. цепью мРНК или др. кодирующей последовательностью той же цепи. В клетках с интенсивной секрецией белка и развитым эндоплазматич. ретикулумом значит. часть цитоплазматической рибосомы прикреплена к его мембране на поверхности, обращенной к цитоплазме. Эти рибосомы синтезируют полипептиды, которые непосредственно транспортируются через мембрану для дальнейшей секреции. Синтез полипептидов для внутриклеточных нужд происходит в основном на свободных (не связанных с мембраной) рибосомах цитоплазмы. При этом транслирующие рибосомы не равномерно диспергированы в цитоплазме, а собраны в группы. Такие агрегаты рибосом представляют собой структуры, где мРНК ассоциирована со многими рибосомами, находящимися в процессе трансляции; эти структуры получили назв. полирибосом или полисом. При интенсивном синтезе белка расстояние между рибосомами вдоль цепи мРНК в полирибосоме может быть предельно коротким, т.е. рибосомы находятся почти вплотную друг к другу. Рибосомы, входящие в полирибосомы, работают независимо и каждая из них синтезирует полную полипептидную цепь. 6. Биосинтез пуриновых нуклеотидов: реакции биосинтеза фосфорибозиламина, происхождение атомов пуринового ядра. П 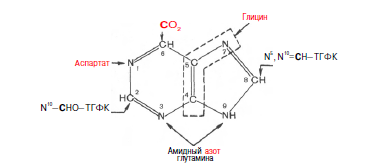 уриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, в дальнейшем практически не используются, поэтому их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Впервые работами Дж. Бьюкенена, Дж. Гринберга экспериментально доказано включение ряда меченых атомов, в частности 15N- и 14С-глицина, 15N-аспартата, 15N-глутамина и др., в пуриновое кольцо мочевой кислоты. Скармливая птицам эти и другие меченые соединения, Дж. Бьюкенен анализировал места включения метки в пуриновое кольцо; полученные данные были в дальнейшем уточнены и подтверждены рядом других исследователей. уриновые основания, образующиеся в процессе переваривания нуклеиновых кислот в кишечнике, в дальнейшем практически не используются, поэтому их синтез осуществляется из низкомолекулярных предшественников, продуктов обмена углеводов и белков. Впервые работами Дж. Бьюкенена, Дж. Гринберга экспериментально доказано включение ряда меченых атомов, в частности 15N- и 14С-глицина, 15N-аспартата, 15N-глутамина и др., в пуриновое кольцо мочевой кислоты. Скармливая птицам эти и другие меченые соединения, Дж. Бьюкенен анализировал места включения метки в пуриновое кольцо; полученные данные были в дальнейшем уточнены и подтверждены рядом других исследователей.Результаты этих исследований можно представить в виде схемы: Из схемы видно, что 4-й и 5-й атомы углерода и 7-й атом азота в ядре имеют своим источником глицин. Два атома азота (N-3 и N-9) происходят из амидной группы глутамина, один атом азота (N-1) – из азота аспарагиновой кислоты; углеродный атом (С-2) происходит из углерода N10-фор- мил-ТГФК, атом углерода в 8-м положении – из N5,N10-метенил-ТГФК и, наконец, углерод С-6 имеет своим источником СО2. 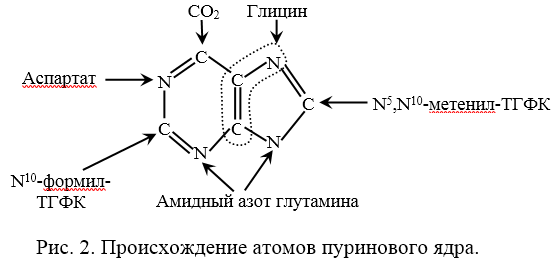 В настоящее время благодаря исследованиям Дж. Бьюкенена, Дж. Гринберга, А. Корнберга и сотр. полностью расшифрована последовательность включения перечисленных веществ в пуриновое кольцо, установлена природа всех промежуточных соединений и ферментных систем, катализи- рующих химические реакции синтеза. Интересным оказался факт почти полного совпадения путей синтеза пуриновых оснований в печени животных и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует, однако, отметить, что конечным результатом синтеза оказалось не свободное пуриновое основание, а рибонуклеотид – инозиновая кислота (ИМФ), из которой далее синтезируются АМФ и ГМФ. На схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов. В настоящее время благодаря исследованиям Дж. Бьюкенена, Дж. Гринберга, А. Корнберга и сотр. полностью расшифрована последовательность включения перечисленных веществ в пуриновое кольцо, установлена природа всех промежуточных соединений и ферментных систем, катализи- рующих химические реакции синтеза. Интересным оказался факт почти полного совпадения путей синтеза пуриновых оснований в печени животных и у микроорганизмов, в частности у Е. coli и Neurospora crassa. Следует, однако, отметить, что конечным результатом синтеза оказалось не свободное пуриновое основание, а рибонуклеотид – инозиновая кислота (ИМФ), из которой далее синтезируются АМФ и ГМФ. На схеме представлена последовательность всех 11 химических реакций этого синтеза с указанием ферментных систем, коферментов, источников энергии и других известных к настоящему времени кофакторов.Как видно из приведенной схемы, синтез инозиновой кислоты начинается с D-рибозо-5-фосфата, который, как известно, является продуктом пентозофосфатного цикла и на который переносится в необычной реакции пирофосфатная группа АТФ. Образовавшийся 5-фосфорибозил-1-пирофосфат (ФРПФ) взаимодействует с глутамином, являющимся донором NH2-группы, в результате чего образуется β-5-фосфорибозиламин, причем в процессе реакции наряду с освобождением пирофосфата и свободной глутаминовой кислоты происходит изменение его конфигурации (из α- в β-). Таким образом, данная стадия становится ключевой реакцией в синтезе пуринов. 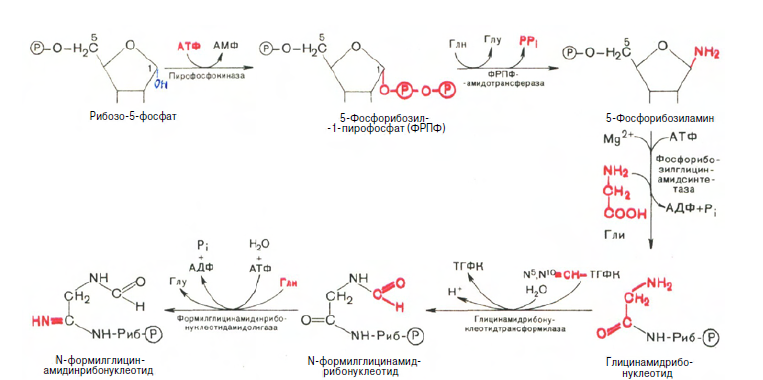 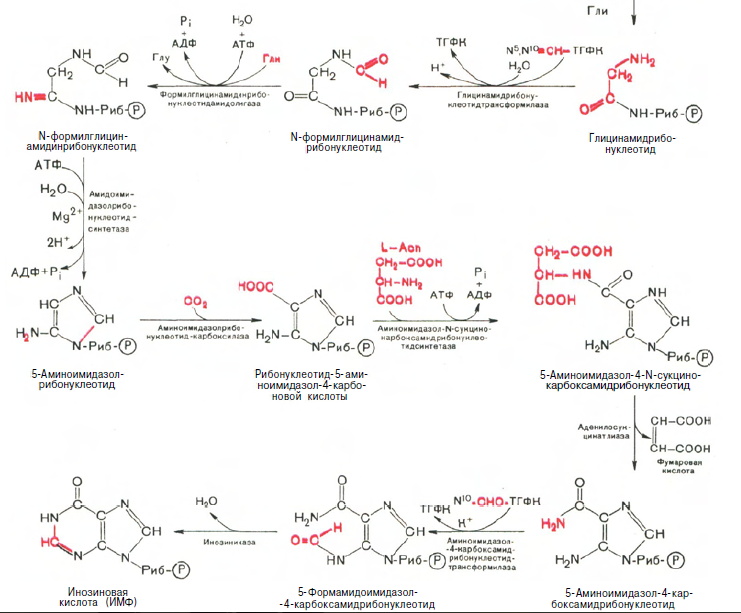 На следующей стадии присоединяется вся молекула глицина к свободной NH2-группе β-5-фосфорибозил-амина (реакция нуждается в доставке энергии АТФ) с образованием глицинамидрибонуклеотида. Затем, на следующей стадии, цепь удлиняется за счет присоединения формильной группы из N5,N10-метенил-ТГФК с образованием формилглицинамидрибонуклеотида. На формильную группу последнего переносится далее амидная группа глутамина и синтезируется формилглицинамидинрибонуклеотид (реакция также идет с потреблением энергии АТФ). На следующей стадии замыкается пятичленное имидазольное кольцо и образуется 5-аминоимидазолрибонуклеотид, который способен акцептировать СО2 с образованием рибонуклеотида 5-аминоимидазол-4-карбоновой кислоты В последующем двухступенчатом процессе, в котором участвуют аспарагиновая кислота и АТФ, образуется 5-аминоимидазол-4-карбоксамидрибонуклеотид и освобождается фумаровая кислота. В этих реакциях азот аспарагиновой кислоты включается в 1-е положение будущего пуринового ядра. Последний углеродный атом пиримидинового остатка кольца пурина вводится в виде формильного остатка (источник N10-формил-ТГФК), который присоединяется к 5-NH2-группе. После этого отщепляется молекула воды и второе кольцо замыкается. В результате образуется первый пуриновый нуклеотид – инозиновая кислота (ИМФ), которая является предшественником пуриновых нуклеотидов в составе нуклеиновых кислот. Фосфорибозилпирофосфат служит донором фосфорибозильных трупа в ходе биосинтеза нуклеотидов ( разд. Аминогликозид далее подвергается внутримолекулярной окислительно-восстановительной реакции, известной под названием перегруппировки Амадори. В ходе этой перегруппировки атом сахара С-1 восстанавливается, тогда как атом С-2 окисляется, переходя в карбонильную группу. Образуется продукт с разомкнутой цепью.  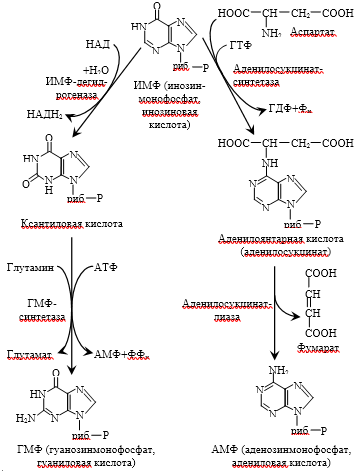 7. Инозиновая кислота как предшественник адениловой и гуаниловой кислот. Регуляция биосинтеза пуриновых нуклеотидов. 7. Инозиновая кислота как предшественник адениловой и гуаниловой кислот. Регуляция биосинтеза пуриновых нуклеотидов.Инозиновая кислота или инозин монофосфат (ИМФ) — нуклеотид, являющийся монофосфатом соответствующего рибонуклеозида гипоксантина. Инозиновая кислота играет важную роль в метаболизме. Биологически важными производными инозиновой кислоты являются пуриновые нуклеотиды, входящие в состав нуклеиновых кислот, а также АТФ, который служит для сохранения химической энергии в клетках. В пищевой промышленности соли инозиновой кислоты используются как усилители вкуса (пищевая добавка E630). Первая специфическая реакция образования пуриновых нуклеотидов - перенос амидной группы Глн на ФРДФ с образованием 5-фосфорибозил-1 -амина Эту реакцию катализирует фермент амидофосфорибозилтрансфераза. При этом формируется β-N-гликозидная связь. Затем к аминогруппе 5-фосфорибозил-1-амина присоединяются остаток глицина, N5,N10-метенил-Н4-фолата ещё одна амидная группа глутамина, диоксид углерода, аминогруппа аспартата и формильный остаток N10-формил Н4-фолата. Результатом этой десятистадийной серии реакций является образование первого пуринового нуклеотида - инозин-5'-монофосфата (ИМФ), на синтез которого затрачивается не менее шести молекул АТФ. В отличие от прокариотов, у которых каждую стадию этого процесса катализирует отдельный фермент, у эукариотов за счёт слияния генов возникли полифункциональные ферменты, каждый из которых катализирует несколько реакций. В синтезе пуриновых нуклеотидов de novo это реакции 3,4 и 6, 7-8 и 10-11 соответственно. Образование конечных продуктов синтеза помогает поддерживать в клетках баланс адениловых и гуаниловых нуклеотидов. Печень - основное место образования пури-новых нуклеотидов, откуда они могут поступать в ткани, не способные к их синтезу: эритроциты, ПЯЛ и частично мозг. В образовании нуклеиновых кислот, некоторых коферментов и во многих синтетических процессах нуклеотиды используются в виде ди-и трифосфатов, синтез которых катализируют ферменты класса трансфераз. АМФ и ГМФ превращаются в нуклеозиддифосфаты (НДФ) с помощью специфичных к азотистому основанию нуклеозидмонофосфаткиназ (НМФ-киназ) и АТФ. Так, аденилаткиназа катализирует реакцию: АМФ + АТФ → 2 АДФ, 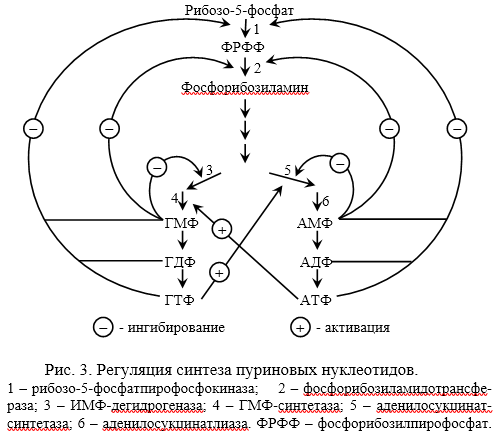 а гуанилаткиназа: а гуанилаткиназа:ГМФ + АТФ → ГДФ + АДФ. Аденилаткиназа особенно активна в печени и мышцах, где высок уровень энергоёмких процессов. Функция этого фермента заключается в том, чтобы поддерживать в тканях равновесие фонда адениловых нуклеотидов: АМФ, АДФ и АТФ. Взаимопревращения нуклеозиддифосфатов и нуклеозидтрифосфатов осуществляет нуклеозид-дифосфаткиназа. Этот фермент в отличие от НМФ-киназ обладает широкой субстратной специфичностью и, в частности, может катализировать реакцию: ГДФ + АТФ → ГТФ + АДФ. Превращение АДФ в АТФ происходит, в основном, за счёт окислительного фосфорилирования или в реакциях субстратного фосфорилирования гликолиза или цитратного цикла. Регуляция синтеза пуриновых нуклеотидов Лимитирующей стадией в синтезе пуриновых нуклеотидов является реакция, катализируемая фосфорибозиламидо-трансферазой. Фермент ингибируется конечными продуктами синтеза – АМФ и ГМФ. Кроме того, АМФ и ГМФ ингибируют свою собственную продукцию путем ингибирования, соответственно, аденилосукцинатсинтетазы и ИМФ-дегидрогеназы. Активность рибозо-5-фосфатпирофосфокиназы (ФРФФ-синтетазы) также ингибируется пуриновыми (и пиримидиновыми) нуклеотидами. Регуляторные эффекты пуриновых нуклеотидов на их синтез представлены на рис. 3.  |
