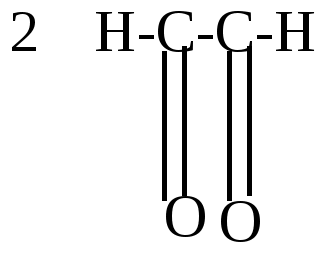Лекции, часть 2. T комнатная температура
 Скачать 498 Kb. Скачать 498 Kb.
|
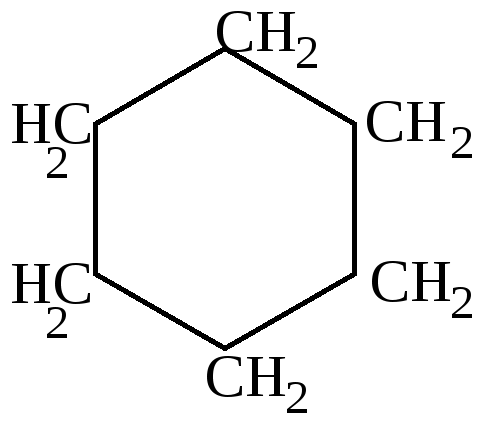
Как видно из приведенных цифровых данных, изомеризация при обычной температуре приводит к преимущественному образованию наиболее стойких шестичленных циклов. 2.Изомеризация при химических реакциях. а) превращения йодпроизводных, работы Марковникова и Зелинского
наблюдается сужение цикла б) превращение спиртов, работы Демьянова и Кижнера
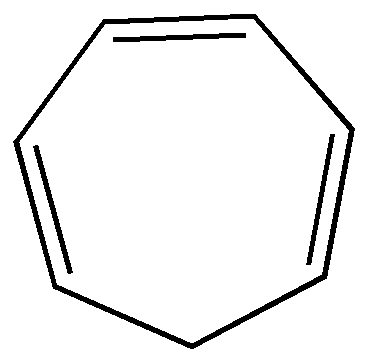
В большинстве таких превращений образуются соединения с менее напряженными циклами. Циклические ненасыщенные углеводороды
Способы получения 1.Отщепление галогеноводорода от галогенопроизводных циклоалканов
2.Дегидратация циклоалканолов
3.Крекинг и пиролиз циклопарафинов (см. свойства последних) 4.Диеновый синтез – применяется для получения соединений ряда циклогексена 5.Реакция полимеризации непредельных углеводородов
Химические свойства Проявляют типичные свойства непредельных углеводородов. Могут присоединять за счет разрыва двойных связей галогены, галогеноводороды, водород, серную кислоту и т.д. Быстро окисляются по двойной связи, что приводит к разрыву кольца, могут полимеризоваться. Наличие двойных связей в циклах обнаруживается с помощью качественных реакций (обесцвечивание бромной воды и разбавленного раствора KMnO4). Отличительные реакции 1.Реакция необратимого катализа Зелинского Характерна для ненасыщенных циклических соединений с шестичленным кольцом. При нагревании последних в присутствии платины происходит перераспределение водорода, при этом часть молекул превращается в бензол, часть – в циклогексан.
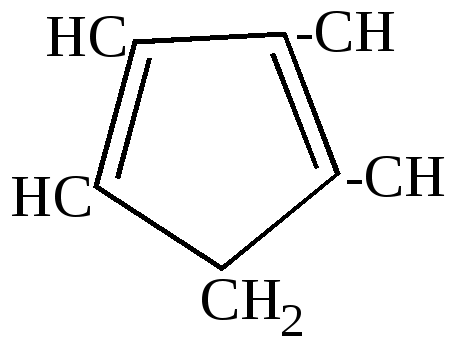
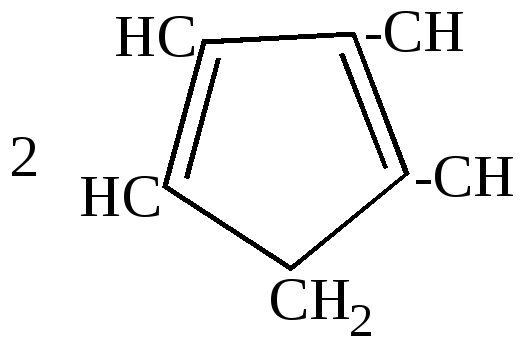
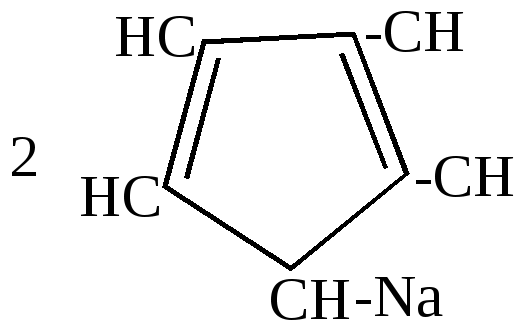
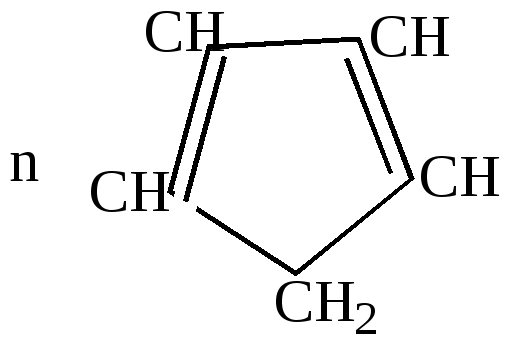
Эта реакция разработана Зелинским и названа им реакцией необратимого катализа, так как она никогда не идет в обратном направлении. 2.Отличительные особенности химических свойств циклопентадиена. а) большая подвижность атома водорода в метиленовой группе, благодаря чему он может вступать в реакцию замещения водорода металлом:
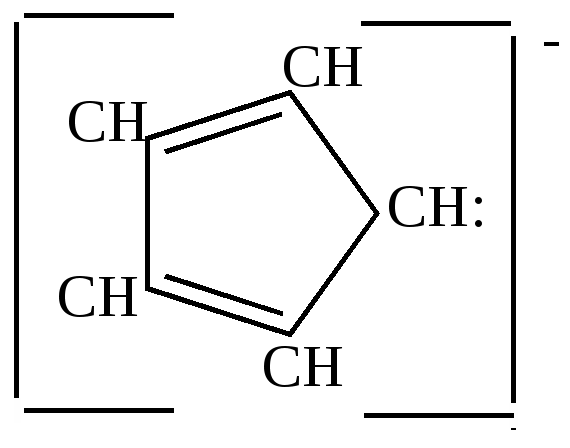
циклопентадиенил-натрий Связь углерода с металлом в этом соединении близка ионной. 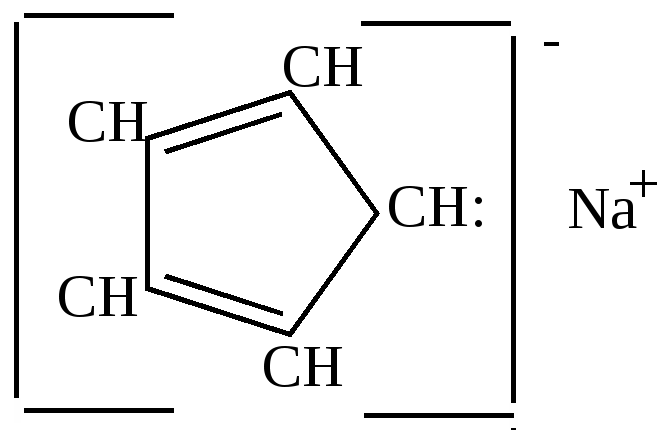 Остающаяся у углерода неподеленная пара электронов вступает в сопряжение с
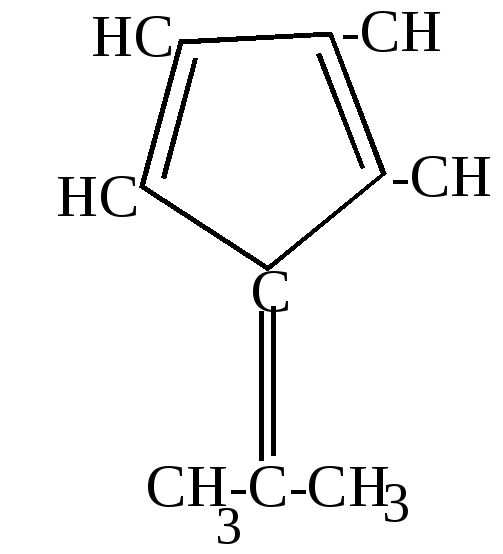
Такие металлорганические соединения циклопентадиен образует со многими металлами: Fe, Ni, Zn и др. Соединения с многовалентными металлами имеют строение бутерброда, в котором ион металла расположен между плоскими кольцами циклопентадиенил-анионов. Подобные соединения получили название ферроценов или сэндвич-соединений.  Металл в этих соединениях образует со всеми атомами углерода равноценные частично-ионные связи. б) конденсация с альдегидами и кетонами. Циклопентадиен вступает с альдегидами и кетонами в реакцию конденсации по типу кротоновой, играя роль метиленовой компоненты.
1.Реакции присоединения по концам цепи сопряжения.
2.Реакции полимеризации
полициклопентадиенангидрид 3.Реакции диенового синтеза.
Аналогичными с пентадиеном свойствами обладает бициклический углеводород – инден, который также находит применение в получении ферроценов, в получении полимерных соединений (инден – кумаровые смолы), применяемых в качестве мягчителей резиновых смесей. 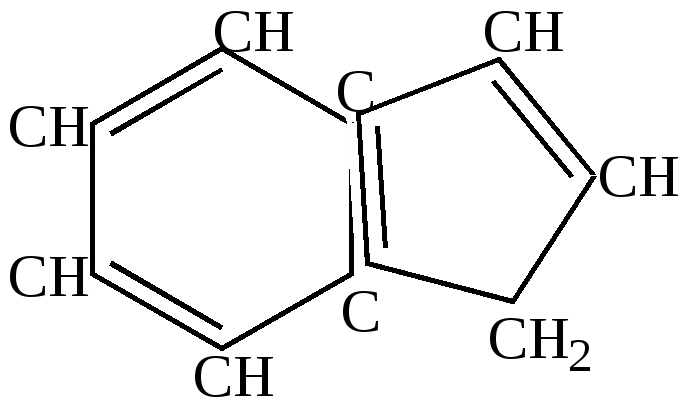 Ароматические соединения Это циклические соединения, ненасыщенные по составу, не проявляющие типичных свойств непредельных соединений, а обладающие особым комплексом свойств, объединенных термином “ароматический характер” кольца. Основные признаки ароматичности 1) Квантово-химический критерий - соответствие структуры правилам Хюккеля а) наличие 4n+2 (n-целое число, включая 0) б) плоское строение кольца. 2) Физический критерий – высокие значения энергии сопряжения (делокализации). Чем больше 3) Выравнивание длин простых и двойных связей в кольце. 4)Химический критерий – наличие комплекса химических свойств, характеризующих “ароматический характер”. а) устойчивость двойных связей кольца в реакциях присоединения и окисления; б) способность легко вступать в реакции замещения (по ионному механизму); в) способность легко образовываться в различных реакциях, т.е. высокая термодинамическая стойкость кольца. 4.6.1.Ароматические соединения подразделяются на:

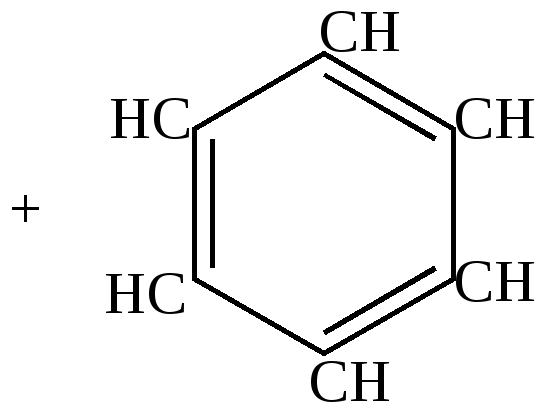
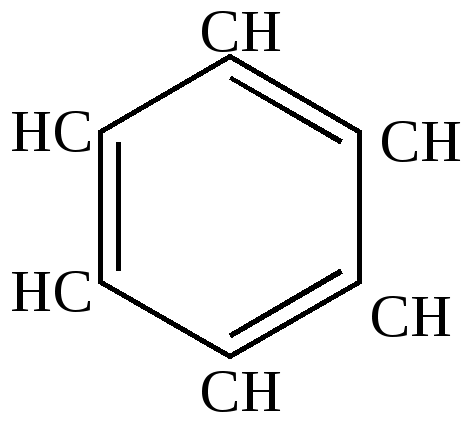
а) некоторые гетероциклические соединения; б) некоторые производные ненасыщенных циклических соединений с 3, 5, 7 и т.д. углеродными атомами в цикле. 1 группа – ароматические соединения бензоидного строения (ароматические углеводороды) Простейший представитель – бензол С6Н6 – по строению должен соответствовать циклогексатриену, т.к. его можно получить дегидрированием 1,3-циклогексадиена.
Такую формулу строения бензола предложил Кекуле. Однако эта формула не описывает всех особенностей свойств бензола. Отличительные особенности химического поведения ароматических углеводородов 1. Не дают качественных реакций на двойную связь – не обесцвечивают бромную воду и перманганат калия, не полимеризуются, т.е. устойчивы в реакциях присоединения и окисления. 2. При более энергичном воздействии, чем на непредельные углеводороды, вступают в реакции присоединения наиболее активных реагентов, например, водорода и хлора, при этом сразу происходит полное насыщение кольца, никаких промежуточных продуктов присоединения по одной или двум связям не обнаружено. Значит, в бензольном кольце вся система двойных связей ведет себя как единое целое.
3. Наиболее характерны для ароматических углеводородов реакции замещения, при которых двойные связи не затрагиваются. Это подтверждает прочность ароматического кольца.
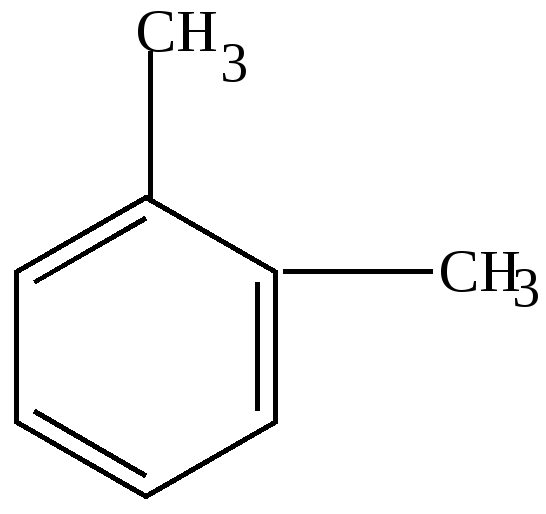
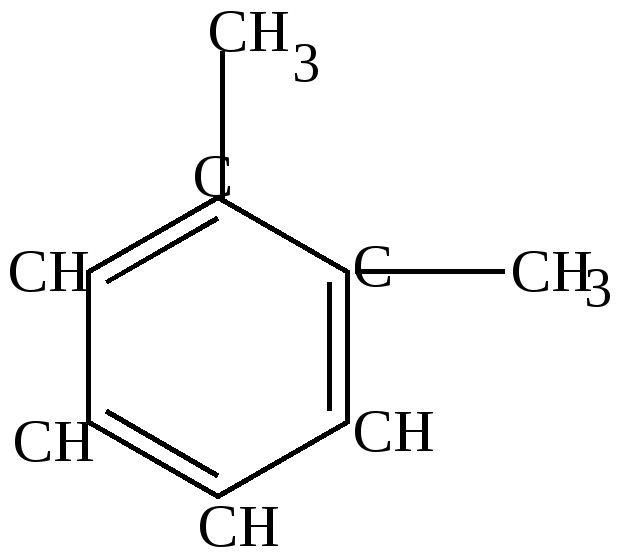
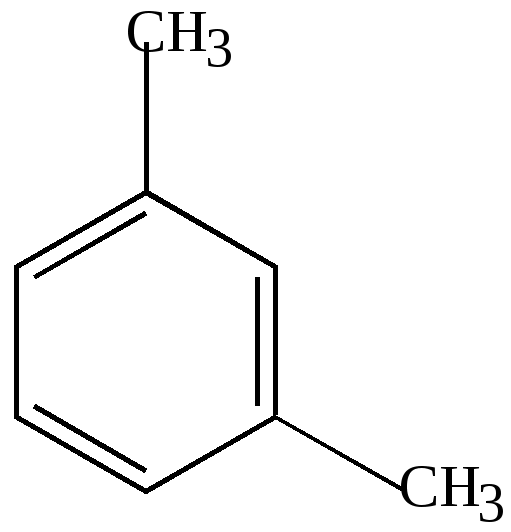
4. У ортодизамещенных гомологов существует только 1 изомер, т.е. формулы (1) и (2) о-ксилола равноценны.
Это подтверждается и реакцией озонирования. При разложении озонида получена смесь глиоксаля, метилглиоксаля и диметилглиоксаля. Это возможно в том случае, если реакция идет с участием соединений формул (1) и (2).
Значит, положение двойных связей в молекуле бензола нельзя считать закрепленным. Сейчас своеобразные свойства бензола получили свое объяснение в свете электронных представлений. Найдены валентные углы и длины связей. Атомы углерода в молекуле бензола расположены по углам правильного шестиугольника. Углы шестиугольника составляют составляют 1200С. В той же плоскости под углом 1200С к углерод - углеродным связям расположены атомы водорода. 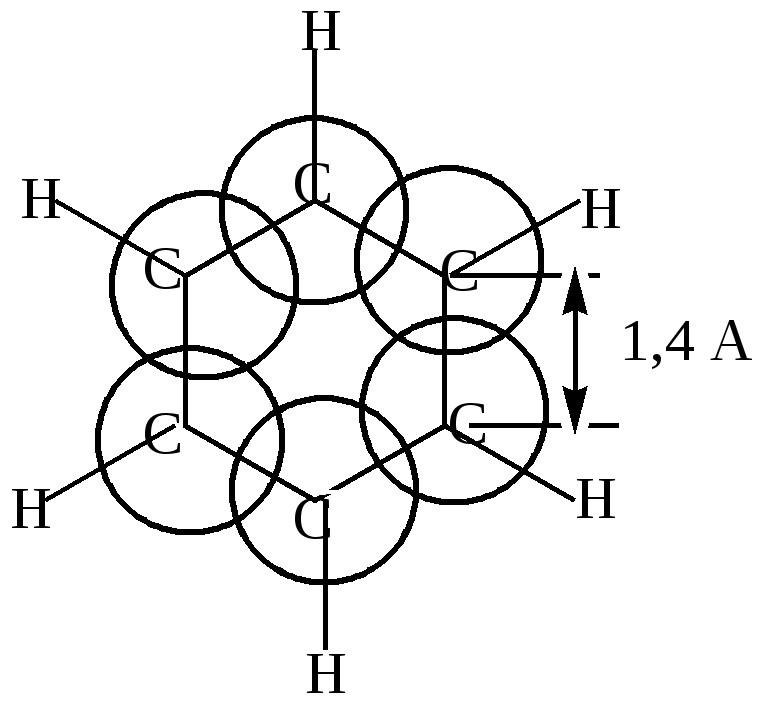 Угол (1,54+1,34)/2 Такая геометрия молекулы имеет место при sp2-гибридизации атомов углерода. Негибридизованные р-электроны занимают гантелеобразные орбиты, оси которых перпендикулярны плоскости шестиугольника и параллельны друг другу, поэтому каждое из них равноценно перерывается с двумя соседними. Выше и ниже кольца образуется единое шестиэлектронное облако, “ароматический секстет”. 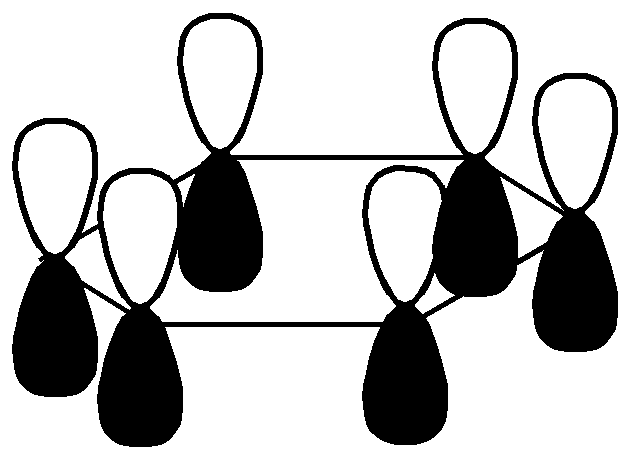 Длины связей между атомами углерода в ароматическом кольце имеют величину 1,4А0, промежуточную между длинами простых и двойных связей, но несколько меньше, чем среднеарифметическое: С-С 1,54А0, С=С 1,34 А0. Это служит свидетельством большей электронной плотности между атомами углерода по сравнению с ненасыщенными, что обуславливает большую прочность ароматического кольца. Подтверждением служит сравнение энергии образования бензола с вычисленной для циклогексатриена; Еэксп. на 39,6 ккал/моль меньше, чем Евыч. Эта разница (Евыч- Еэксп.= Формула Кекуле, таким образом, не точно описывает состояние связей в молекуле бензола. Это понял и сам Кекуле. Для уточнения он ввел понятие “осцилляции валентностей”, согласно которой считалось, что двойные связи в молекуле бензола не закреплены, то есть, что формулы (1) и (2) равнозначны.
С учетом этой поправки формула Кекуле используется и сейчас. Применяются также формулы Армстронга-Байера, которая отражает выравнивание электронной плотности в кольце, и некоторые другие. Гомологический ряд, изомерия и номенклатура ароматических углеводородов Общая молекулярная формула СnH2n-6 (n 1) бензол, русское название (систематическое название – бензен – в иностранной литературе).  2) толуол.  3)
(двухзамещенные гомологи бензола имеют три изомера: орто-рядом, мета - через одно звено, пара – через два звена). Так, у С9Н12, кроме прочих, имеются тризамещенные sim- и asim-изомеры с пара-, мета- орто – положениями метиловых и этиловых групп.
Если заместители не одинаковы, то их положение указывается с помощью нумерации, например, 1-метил, 2-этил, 5-пропилбензол. Нумерацию начинают с того атома углерода, который связан с наименьшим радикалом, и ведут в сторону ближайшего расположения следующих радикалов, по возможности, с учетом возрастания сложности. При наличии сложных радикалов за основу принимается боковая цепь. Например, 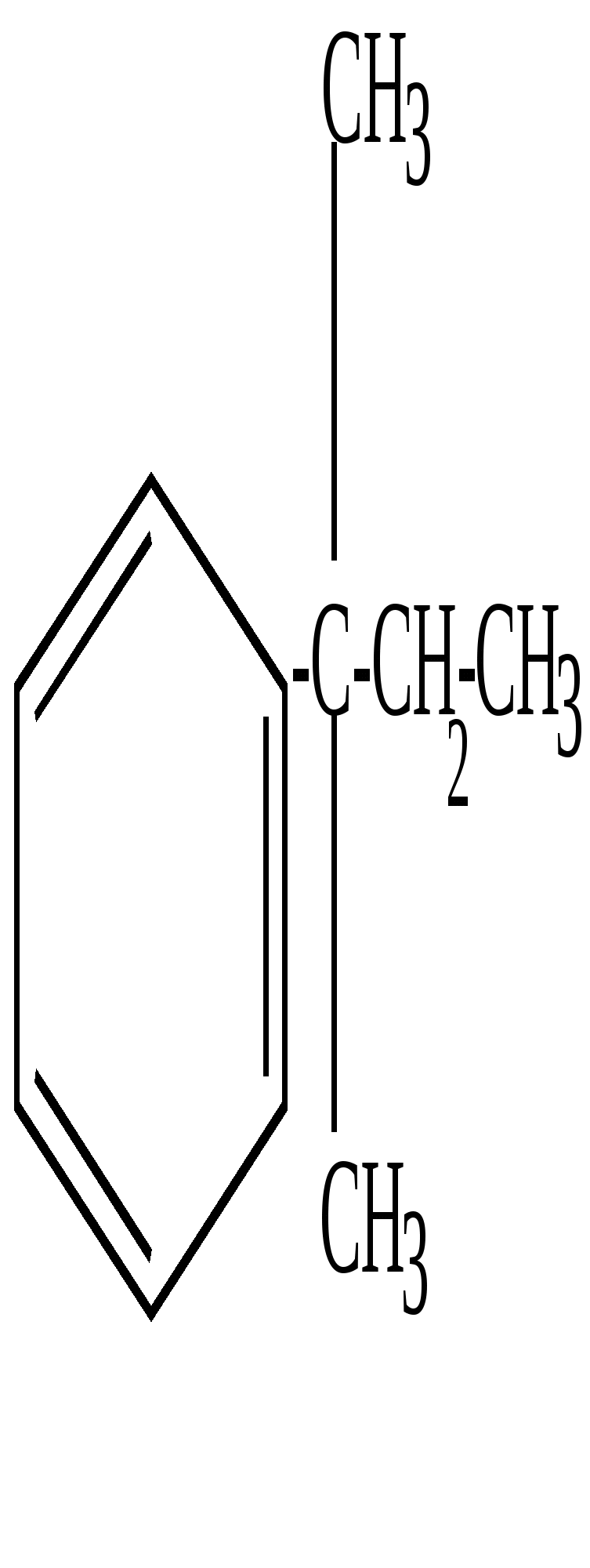 Диметилэтилфенилметан  2,3-диметил-1-фенилбутан Названия ароматических радикалов 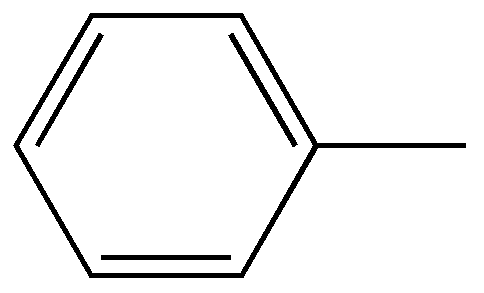 Фенил (происходит от старого названия бензола - фен)  Бензил  n-толил | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||





 + H2O
+ H2O