расчет. Карбоновые кислоты. Тема 1 Карбоновые кислоты. Вопрос 1
 Скачать 463 Kb. Скачать 463 Kb.
|
|
Тема 1: Карбоновые кислоты. Вопрос №1. Определение и классификация карбоновых кислот. Карбоновые кислоты – класс органических соединений, молекулы которых содержат одну или несколько функциональных карбоксильных групп.  Кислые свойства объясняется тем, что данная группа может легко отщеплять протон. За редким исключением карбоновые кислоты являются слабыми. Кислые свойства объясняется тем, что данная группа может легко отщеплять протон. За редким исключением карбоновые кислоты являются слабыми.Классифицируют по двум структурным признакам: 1) По числу карбоксильных групп в молекуле
2) По природе углеводородного радикала
Вопрос №2. Моно- и дикарбоновые кислоты. Монокарбоновые кислоты. Одноосновные карбоновые кислоты содержат одну карбоксильную группу, связанную с углеводородным радикалом (предельным, непредельным, ароматическим). Гомологический ряд:
Кислотные остатки и кислотные радикалы:
Монокарбоновые кислоты ненасыщенные: H2C=CH–COOH Пропеновая.(акриловая) Монокарбоновые кислоты ароматические:  Бензойная БензойнаяДикарбоновые кислоты. Называют органические кислоты, в молекулах которых содержатся две карбоксильные группы. Первым делом стоит отметить, что у них у всех по два названия: Систематическое. Дается по названию алкана (ациклического углеводорода) с добавлением суффикса «-диовая». Дикарбоновые кислоты алифатические: Тривиальное. Дается по названию природного продукта, из которого получается кислота. А теперь непосредственно о соединениях. Итак, вот некоторые наиболее известные кислоты: Щавелевая/этандиовая. НООС-СООН. Содержится в карамболе, ревене, щавеле. Также существует в виде оксалатов (солей и эфиров) кальция и калия. Малоновая/пропандиовая. НООС-СН2-СООН. Содержится в соке сахарной свеклы. Янтарная/бутандиовая. НООС-(СН2)2-СООН. Выглядит, как бесцветные кристаллы, отлично растворяющиеся в спирте и воде. Содержится в янтаре и в большинстве растений. Соли и эфиры дикарбоновой кислоты данного типа называют сукцинатами. Глутаровая/Пентандиовая. HOOC—(CH2)3—COOH. Получают посредством окисления азотной кислотой циклического кетона и участием оксида ванадия. Адипиновая/Гександиовая. НООС(СН2)4СООН. Дикарбоновые кислоты ненасыщенные: Бутендиовая (цис-изомер -малеиновая, транс- изомер -фумаровая)  Дикарбоновые кислоты ароматические 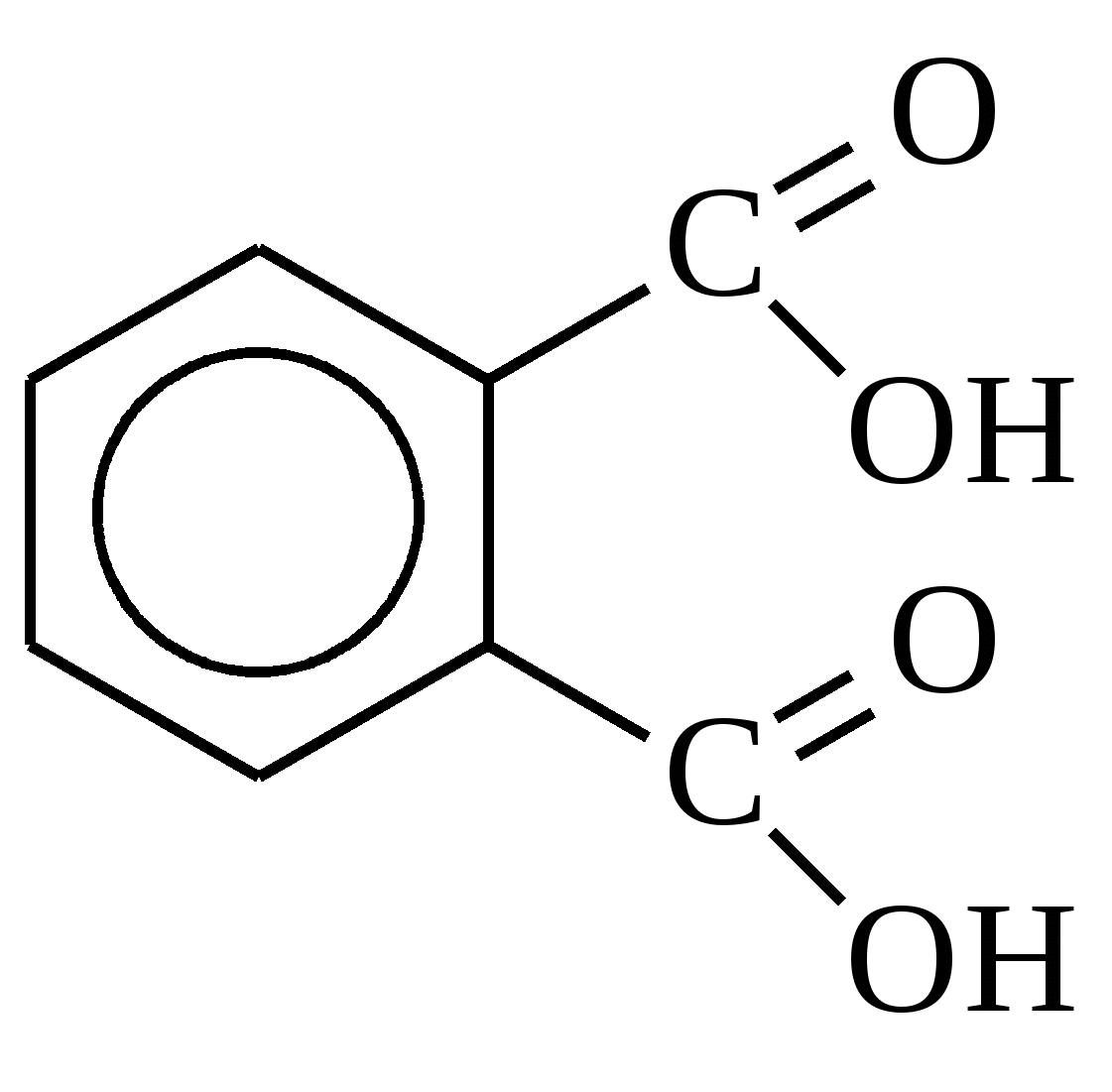 Фталевая Фталевая Вопрос №3. Номенклатура и изомерия. Способы получения. Изомерия и номенклатура I. Структурная А) Изомерия углеродного скелета (начиная с C4)  Б) Межклассоваясо сложными эфирами R— CO – O— R1 (начиная с C2) Например: для С3Н6О2 CH3—CH2—COOH пропионовая кислота СH3—CO—OCH3 метиловый эфир уксусной кислоты II. Пространственная А) Оптическая Например:  Б) Цис- транс – изомерия для непредельных кислот Пример:  Номенклатура карбоновых кислот Систематические названия кислот даются по названию соответствующего углеводорода с добавлением суффикса -овая и слова кислота. Чтобы указать положение заместителя (или радикала), нумерацию углеродной цепи начинают от атома углерода карбоксильной группы. Например, соединение с разветвленной углеродной цепью (CH3)2CH-CH2-COOH называется 3-метилбутановая кислота. Для органических кислот широко используются также тривиальные названия, которые обычно отражают природный источник, где были впервые обнаружены эти соединения. Некоторые одноосновные кислоты
Для многоосновных кислот применяют суффиксы -диовая, -триовая и т.д. Например: HOOC-COOH — этандиовая (щавелевая) кислота; HOOC-CH2-COOH — пропандиовая (малоновая) кислота. ПРЕДЕЛЬНЫЕ ОДНООСНОВНЫЕ КАРБОНОВЫЕ КИСЛОТЫ CnH2n+1—COOH или CnH2nO2 Гомологический ряд
Общие способы получения карбоновых кислот1. Окисление первичных спиртов и альдегидов под действием различных окислителей Окисление спиртов В качестве окислителей применяют KMnO4 и K2Cr2O7.  Например:   Окисление альдегидов Для окисления альдегидов используются те же реагенты, что и для спиртов. При окислении перманганатом калия происходит обесцвечивание фиолетово-розового раствора. При окислении дихроматом калия — цвет меняется с оранжевого на зеленый. А также для них характерны реакции «серебряного зеркала» и окисление гидроксидом меди (II) – качественные реакции альдегидов:  2. Гидролиз галогензамещенных углеводородов, содержащих три атома галогена у одного атома углерода В результате реакции образуются спирты, содержащие три группы ОН у одного атома углерода. Такие спирты неустойчивы и отщепляют воду с образованием карбоновой кислоты:  3. Получение карбоновых кислот из цианидов (нитрилов) Этот способ позволяет наращивать углеродную цепь при получении исходного цианида. Дополнительный атом углерода вводят в состав молекулы, используя реакцию замещения галогена в молекуле галогенуглеводорода цианидом натрия: Образующийся нитрил уксусной кислоты CH3-CN (ацетонитрил, метилцианид) при нагревании гидролизуется с образованием ацетата аммония: При подкислении раствора выделяется кислота: 4. Использование реактива Гриньяра 5. Гидролиз галогенангидридов кислот С водой низшие хлорангидриды реагируют чрезвычайно энергично, образуя соответствующую карбоновую кислоту и соляную кислоту:  В лаборатории1. Гидролиз сложных эфиров При кислотном гидролизе получают карбоновые кислоты и спирты (реакция обратная этерификации):  2. Из солей карбоновых кислот 3. Гидролиз ангидридов кислот При легком нагревании с водой ангидриды образуют соответствующие карбоновые кислоты: 4. Щелочной гидролиз галоген производных карбоновых кислот Специфические способы получения важнейших кислотСпособы получения НСООН 1. Взаимодействие оксида углерода (II) с гидроксидом натрия Муравьиную кислоту получают нагреванием под давлением гидроксида натрия и оксида углерода (II) под давлением и обработкой полученного формиата натрия серной кислотой: 2. Каталитическое окисление метана 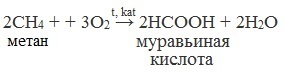 3. Декарбоксилирование щавелевой кислоты Муравьиную кислоту можно получить при нагревании щавелевой кислоты:  Способы получения СН3СООН Получение уксусной кислоты для химических целей 1. Синтез из ацетилена Данный способ получения уксусной кислоты основан на окислении уксусного альдегида, который в свою очередь получают из ацетилена по реакции Кучерова (ацетилен получают из очень доступного сырья — метана): 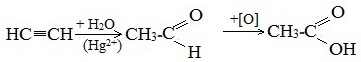 2. Каталитическое окисление бутана Большое значение имеет способ получения уксусной кислоты, основанный на окислении бутана кислородом воздуха: 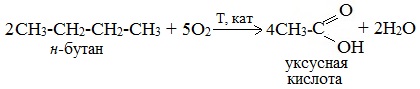 Процесс получения уксусной кислоты из метана является многостадийным (метан – ацетилен – уксусный альдегид – уксусная кислота). Ее получение окислениям будана сокращает число стадий, что дает большой экономический эффект. 3. Каталитическое карбонилирование метанола Получение уксусной кислоты для пищевых целей 4. Уксуснокислое брожение этанола Уксусную кислоту для пищевых целей получают уксуснокислым брожением жидкостей, содержащих спирт (вино. пиво): Вопрос №4. Промышленное окисление алканов на основе сырья нефтяных фракций и газов крекинга. В промышленности1. Выделяют из природных продуктов (жиров, восков, эфирных и растительных масел) 2. Окисление алканов кислородом воздуха ( в присутствии катализаторов – солей марганца или при нагревании под давлением) Обычно образуется смесь кислот. При окислении бутана единственным продуктом является уксусная кислота:  3. Окисление алкенови алкинов При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:    При жестком окислении (нагревание, концентрированные растворы, кислая среда) происходит расщепление углеродного скелета молекулы алкина по тройной связи и образуются карбоновые кислоты:  4. Окисление гомологов бензола (получение бензойной кислоты) Для получения бензойной кислоты можно использовать окисление монозамещенных гомологов бензола кислым раствором перманганата калия:  Вопрос №5. Физические свойства. Химические свойства. Физические свойства предельных одноосновных кислот Низшие члены этого ряда при обычных условиях представляют собой жидкости, обладающие характерным острым запахом. Например, этановая (уксусная) кислота имеет характерный «уксусный» запах. Безводная уксусная кислота при комнатной температуре представляет собой жидкость; при 17 °С она замерзает, превращаясь в льдистое вещество, которое получило название «ледяная» уксусная кислота. Средние представители этого гомологического ряда — вязкие, «маслообразные» жидкости; начиная с С10 — твердые вещества. Простейший представитель – муравьиная кислота НСООН – бесцветная жидкость с т. кип. 101 °С, а чистая безводная уксусная кислота CH3COOH при охлаждении до 16,8 °С превращается в прозрачные кристаллы, напоминающие лед (отсюда ее название ледяная кислота). Простейшая ароматическая кислота — бензойная C6H5COOH (т. пл. 122,4°С) — легко возгоняется, т.е. переходит в газообразное состояние, минуя жидкое. При охлаждении её пары сублимирутся в кристаллы. Это свойство используется для очистки вещества от примесей. Карбоксильная группа сочетает в себе две функциональные группы – карбонил >C=O и гидроксил —OH, взаимно влияющие друг на друга:  Кислотные свойства карбоновых кислот обусловлены смещением электронной плотности к карбонильному кислороду и вызванной этим дополнительной (по сравнению со спиртами) поляризации связи О–Н. В водном растворе карбоновые кислоты диссоциируют на ионы: Растворимость в воде и высокие температуры кипения кислот обусловлены образованием межмолекулярных водородных связей.   С увеличением молекулярной массы растворимость кислот в воде уменьшается. Химические свойства карбоновых кислот Карбоновые кислоты проявляют высокую реакционную способность. Они вступают в реакции с различными веществами и образуют разнообразные соединения, среди которых большое значение имеют функциональные производные, т.е. соединения, полученные в результате реакций по карбоксильной группе.  Названия солей составляют из названий остатка RCOO– (карбоксилат-иона) и металла. Например, CH3COONa – ацетат натрия, (HCOO)2Ca – формиат кальция, C17H35COOK – стеарат калия и т.п. I. Общие с другими кислотами 1. Диссоциация: R—COOH ↔ RCOO— + H+ -Сила кислот уменьшается в ряду: H-COOH > CH3-COOH > CH3-CH2-COOH 2. Взаимодействие с активными металлами: 2R-COOH + 2Na → 2R-COONa + H2↑ 3. Взаимодействие с основными оксидами и основаниями: 2R-COOH + CaO → (R-COO)2Ca + H2O R-COOH + NaOH → R-COONa + H2O 4. Взаимодействие с солями слабых кислот: R-COOH + NaHCO3 → R-COONa + H2O + CO2↑ -Соли карбоновых кислот разлагаются сильными минеральными кислотами: R-COONa + HСl → NaCl + R-COOH -В водных растворах гидролизуются: R—COONa + H2O ↔ R—COOH + NaOH 5. Образование сложных эфиров со спиртами:  II. Специфические свойства 1. Образование функциональных производных R—CO—X (свойства гидроксильной группы) Получение хлорангидридов: R-COOH + PCl5 → R-CO-Cl + POCl3 + HCl 2. Образование амидов CH3COOH + NH3→CH3COONH4 t˚C→ CH3CONH2 + H2O  Вместо карбоновых кислот чаще используют их галогенангидриды:  Амиды образуются также при взаимодействии карбоновых кислот (их галогенангидридов или ангидридов) с органическими производными аммиака (аминами):  Амиды играют важную роль в природе. Молекулы природных пептидов и белков построены из a-аминокислот с участием амидных групп — пептидных связей 3. Реакции замещения с галогенами (свойства углеводородного радикала, образуется а-хлорпроизводное карбоновой кислоты ):  4. Особенности муравьиной кислоты H—COOH: · Даёт реакцию «Серебряного зеркала»: H-COOH + 2[Ag(NH3)2]OH → 2Ag↓ + (NH4)2CO3 + 2NH3 + H2O · Окисление хлором: H-COOH + Cl2 → CO2 + 2HCl · Вступает в реакцию с гидроксидом меди(II): H-COOH + 2Cu(OH)2 t → Cu2O↓ + CO2↑ + 3H2O · Разлагается при нагревании: HCOOH t,H2SO4→ CO↑ + H2O 5. Реакции декарбоксилирования солей карбоновых кислот (получение алканов): R-COONa + NaOH t → Na2CO3 + R-H (алкан) 6. Окисление в атмосфере кислорода: R—COOH + O2 → CO2 + H2O Вопрос №6. Отдельные представители и их применение: муравьиная кислота. Уксусная кислота, изовалериановая кислота, матакриловая кислота, бензойная кислота, щавелевая кислота, малоновая кислота, янтарная кислота, адипиновая кислота, бутендиовая кислота, малеиновая и фумаровая кислота, фталевая кислота, терефталевая кислота. Муравьиная кислота (метановая)  Резко пахнущая бесцветная жидкость. Растворима в ацетоне, бензоле, глицерине, толуоле. Смешивается с водой, диэтиловым эфиром, этанолом. Ткип=100,7 Со Тпл=8,25 Со Применяют: Как консервирующий и антибактериальный агент при заготовке корма, замедляет процессы гниения и распада. Пермуравьиная кислота антисептическое средство в хирургии. Уксусная кислота (этановая) 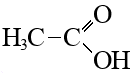 Ткип=118,1 Со Тпл=16,75 Со Бесцветная жидкость с характерным резким запахом и кислым вкусом. Гигроскопична. Неограниченно растворима в воде. Абсолютная уксусная уксусная кислота называется ледяной, так как при замерзании образует льдовидную массу. Концентрации: Близкая к 100% - ледяная; 70-80% - уксусная эссенция; 3-15% - уксус. Пищевая добавка Е-260. Применяют: В консервировании, избавлении от накипи, бытовая кулинария, для получения лекарственных и душистых веществ, в качестве замены нашатырного спирта. Изовалериановая кислота (3-метилбутановая)  Ткип=176,5 Со Тпл=-29,3 Со Бесцветная жидкость с неприятным запахом («потных стоп»), ограниченно растворима в воде, растворима в этиловом спирте, диэтиловом эфире, хлороформе. Применяют: Лекарственные препараты седативного действия, ароматизаторы в пищевой и парфюмерной промышленности. Метакриловая кислота (2-метил-2-пропеновая , изобутеновая)  Ткип=162-163 Со Тпл=16 Со Жидкость с характерным резким запахом технической кислоты, в чистом виде бесцветная – из-за примесей имеет бурый цвет. Хорошо смешивается с водой и органическими растворителями. Применение: Для синтеза полиметакриловой кислоты и сложных эфиров. Бензойная кислота (бензол карбоновая)  Ткип=249,2 Со Тпл=122,4 Со Белые кристаллы, плохо растворимы в воде, хорошо – в этаноле, хлороформе и диэтиловом эфире. Слабая кислота. Легко возгоняется. Применение: Калориметрия – для калибровки по температуре и теплоемкости. Сырье для получения многих реактивов. Консервант (Е210,211,212,213) Медицина как наружное антисептическое средство и фунгицидное средство. В парфюмерной промышленности. Щавелевая кислота (этандиовая)  | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||







