вопрос 37. Типы перекрывания атомных орбиталей
 Скачать 26.49 Kb. Скачать 26.49 Kb.
|
|
Типы перекрывания атомных орбиталей -тип перекрывания (-связь) образуется при перекрывании АО по линии, соединяющей ядра взаимодействующих атомов:  -тип перекрывания (-связь) образуется при перекрывании АО по обе стороны линии, соединяющей ядра взаимодействующих атомов:  При образовании молекулы метана атом углерода переходит в возбужденное состояние, то есть имеет три неспаренных р-электрона и один s-электрон. Рассуждая так же, как и в предыдущих случаях, можно предположить, что атом углерода будет образовывать три связи, направленные под углом 90o друг к другу и связь, направленную произвольно, поскольку она образована s-электроном, а s-электрон имеет сферическую симметрию. Поскольку р-орбитали более вытянуты от ядра, s-орбиталь, они сильнее перекрываются с орбиталями других атомов, а, значит, связи, образованные р-электронами должны быть более прочными. Но из эксперимента известно, что все связи в молекуле метана равноценны и направлены к вершинам тетраэдра (угол между связями равен 109,5о. Это явление объясняется представлением о гибридизации волновых функций, введённым Полингом и Слейтером. Гибридизация валентных орбиталей – это выравнивание их по форме и энергии. Представление о гибридизации используется в том случае, когда в образовании связей в молекуле участвуют электроны, принадлежащие к различным типам орбиталей. Гибридная орбиталь асимметрична и сильно вытянута по одну сторону от ядра. Рассмотрим электронное строение молекулы метана, но уже с позиций метода гибридизации. Четыре неспаренных электрона атома углерода взаимодействуют между собой в ходе образования химической связи с электронами другого атома, давая четыре новых равноценных гибридных облака. Такая гибридизация называется sp3-гибридизацией. Четыре совершенно одинаковые sp3-гибридные орбитали атома углерода расположены под углом 109,5о друг к другу и направлены к вершинам тетраэдра, в центре которого расположен атом углерода (рис. 7.3). 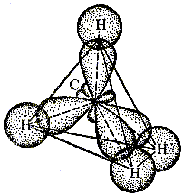 Рис. 7.3. Схема образования химических связей в молекуле метана |
