ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛА. Трансмембранная передача сигнала
 Скачать 5.01 Mb. Скачать 5.01 Mb.
|
|
ТРАНСМЕМБРАННАЯ ПЕРЕДАЧА СИГНАЛА Важное свойство мембран - способность воспринимать и передавать внутрь клетки сигналы из внешней среды. "Узнавание" сигнальных молекул осуществляется с помощью белков-рецепторов, встроенных в клеточную мембрану клеток-мишеней или находящихся в клетке. Клетку-мишень определяют по способности избирательно связывать данную сигнальную молекулу с помощью рецептора. Если сигнал воспринимается мембранными рецепторами, то схему передачи информации можно представить так:
Несмотря на огромное разнообразие сигнальных молекул, рецепторов и процессов, которые они регулируют, существует всего несколько механизмов трансмембранной передачи информации: с использованием аденилатциклазной системы, инозитолфосфатной системы, каталитических рецепторов, цитоплазматических или ядерных рецепторов. Сигнальные молекулы - гормоны, медиаторы, факторы роста, NO Сигнальными молекулами могут быть неполярные и полярные вещества. Неполярные вещества, например стероидные гормоны, проникают в клетку, проходя через липидный бислой. Полярные сигнальные молекулы в клетку не проникают, но связываются специфическими рецепторами клеточных мембран. Такое взаимодействие вызывает цепь последовательных событий в самой мембране и внутри клетки. К полярным сигнальным молекулам относят белковые гормоны (глюкагон, инсулин), нейромедиаторы (ацетилхолин, глицин, γ-аминомасляная кислота), факторы роста. Рецепторы По локализации различают мембранные, цитоплазматические и ядерные рецепторы. По другой классификации все рецепторы можно разделить на быстроотвечающие (в пределах миллисекунд) и медленноотвечающие, в пределах нескольких минут или даже часов, что характерно для гормонов, передающих сигнал на внутриклеточные рецепторы. Рецепторы первого типа - интегральные олигомерные белки, содержащие субъединицу, имеющую центр для связывания сигнальной молекулы и центральный ионный канал. 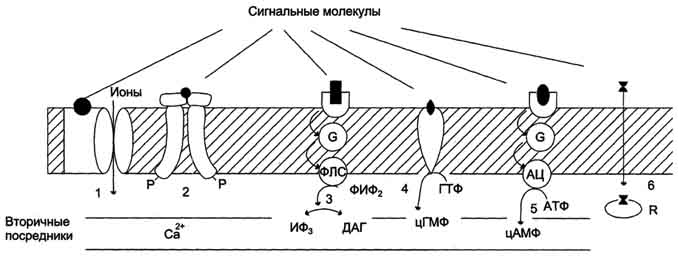 Участие рецепторов в трансмембранной передаче сигнала. Рецепторы: 1 - связанные с ионными каналами, например рецептор ГАМК; 2 - с каталитической активностью (рецептор инсулина); 3 - передающие сигнал на фосфолипазу С, например α1-адренорецептор; 4 - с каталитической активностью (гуанилатциклаза, рецептор ПНФ- предсердного натрийуретического фактора ); 5 - передающие сигнал на аденилатциклазу, например β-адренорецепторы; 6 - связывающие гормон в цитозоле или ядре, например рецептор кортизола. Рецепторы второго типа, локализованные в мембранах и не связанные с каналами, подразделяют на 2 большие группы: каталитические рецепторы, обладающие собственной тирозинкиназной или гуанилатциклазной активностью, и рецепторы, взаимодействующие через G-белок с мембранным ферментом. Связывание лиганда (например, гормона) с рецептором на наружной стороне клеточной мембраны приводит к изменению активности цитоплазматического фермента, который, в свою очередь, инициирует клеточный ответ, т.е. через мембрану переносится информация, а не заряды или растворённые молекулы. В случае цитоплазматических рецепторов через мембрану проходит гормон, а информация о присутствии гормона в клетке с помощью рецептора передаётся в ядро. Различные клетки организма в зависимости от выполняемых ими функций имеют определённый набор рецепторов. В мембране одной клетки может быть более десятка разных типов рецепторов. Взаимодействуя с рецептором, внеклеточные химические посредники оказывают влияние на метаболизм и функциональное состояние (пролиферация, секреция и т.д.) клеток-мишеней. Взаимодействие гормонов с рецепторами, сопряженными с G-белками, приводит к активации аденилатциклазной или инозитолфосфатной регуляторных систем. Аденилатциклазная система При участии аденилатциклазной системы реализуются эффекты сотни различных по своей природе сигнальных молекул – гормонов и нейромедиаторов. Функционирование системы трансмембранной передачи сигналов обеспечивают 5 белков. 
Последовательность событий, приводящих к активации аденилатциклазы: Рецептор имеет два центра связывания: для гормона на наружной поверхности мембраны и для G-белка на внутренней поверхности мембраны.
белки по серину и треонину, в результате изменяются конформация и активность фосфорилированных белков, а это приводит к изменению скорости и направления регулируемых ими процессов в клетке. Каскадный механизм усиления и подавления сигнала. Передача сигнала от мембранного рецептора через G-белок на фермент аденилатциклазу служит примером каскадной системы усиления этого сигнала. Одна молекула, активирующая рецептор, может "включать" несколько G-белков, и затем каждый активирует несколько молекул аденилатциклазы с образованием тысяч молекул цАМФ. На этом этапе сигнал усиливается в 102-103 раз. Образующийся цАМФ "включают" другой фермент - протеинкиназу А, усиливая сигнал ещё в 1000 раз. Фосфорилирование ферментов протеинкиназой А ещё больше усиливает сигнал, в результате суммарное усиление равно 106-107 раз. Таким образом, по механизму каскадного усиления одна молекула регулятора способна изменить активность миллионов других молекул. Инозитолфосфатная система Инозитолфосфатная система включает 3 мембранных белка:
Работу системы обеспечивают белок кальмодулин, фермент протеин киназа С, регулируемые Са2+ -каналы мембраны ЭПР, Са2+ -АТФаза клеточной и митохондриальной мембран  Последовательность событий, приводящих к активации фосфолипазы С:
субъединицы
Активация протеинкиназы С
Участие белка кальмодулина в инозитолфосфатной передаче сигнала В клетках многих тканей присутствует белок кальмодулин, который функционирует как внутриклеточный рецептор Са2+, он имеет 4 центра для связывания Са2+. При повышении концентрации кальция он присоединяется к кальмодулину, образуя комплекс (4Са2+-кальмодулин) и этот комплекс взаимодействует с различными белками и ферментами приводит к их активации, повышая скорость фосфорилирования по серину и треонину. Как и большинство систем трансмембранной передачи сигналов, инозитолфосфатная система имеет не только механизм усиления, но и механизм подавления сигнала. Присутствующие в цитозоле инозитол-1,4,5-трифосфат (ИФ3) и диацилглицерол (ДАТ) в мембране могут в результате серии реакций опять превращаться в фосфатидилинозитол-4,5-бисфосфат (ФИФ2). Ферменты, катализирующие восстановление фосфолипида, активируются фосфорилированием протеинкиназой С. Концентрация Са2+ в клетке снижается до исходного уровня при действии Са2+-АТФ-аз цитоплазматической мембраны и ЭР, а также Na+/Ca2+-и Н+/Са2+-транслоказ (активный антипорт) клеточной и митохондриальной мембран. Функционирование транслоказ Са2+ и Са2+-АТФ-аз может активироваться:
Рецепторы с гуанилатциклазной активностью Гуанилатциклаза катализирует образование цГМФ из ГТФ, одного из важных посредников внутриклеточной передачи сигнала. 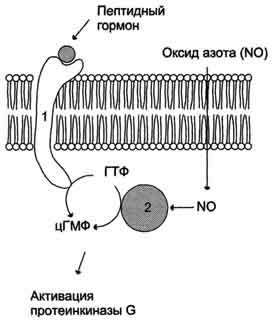 Регуляция активности мембранной (1) и цитозольной (2) гуанилатциклазы. Гуанилатциклаза находится в клетке, как в мембранно-связанном состоянии, так и в цитозольном. Соотношения этих двух форм фермента в различных тканях разное. Например, в клетках тонкого кишечника 90% гуанилатциклазы находится в мембранах, а в лёгких и печени - лишь 20%. Цитозольная и мембранно-связанная гуанилатциклазы различаются не только по локализации, но и по молекулярной массе, активности, способу регуляции. Цитозольная форма гуанилатциклазы состоит из двух субъединиц (α и β) и содержит в своём составе простетическую группу - гем. В области гема связывается активатор этой формы гуанилатциклазы - оксид азота (NO), образующийся из аргинина под действием фермента синтазы оксида азота. Мембранно-связанная гуанилатциклаза - трансмембранный гликопротеин. Внутриклеточный домен гуанилатциклазы проявляет каталитическую активность, внеклеточный домен служит рецептором. Присоединение активатора к рецептору вызывает изменение конформации в мембранном и цитозольном доменах и, как следствие, активацию гуанилатциклазы. В тканях человека присутствуют 3 типа мембранно-связанных гуанилатциклаз, в активации которых принимают участие специфические регуляторы - предсердный натрийуретический фактор (ПНФ), натрийуретический пептид из мозга и кишечный пептид гуанилин. В клетках тканей выявлены 3 основных типа внутриклеточных рецепторных белков, с которыми взаимодействует цГМФ: цГМФ-зависимая протеинкиназа (протеинкиназа G), цГМФ-регулируемые ионные каналы и цГМФ-регулируемая фосфодиэстераза, специфичная к цАМФ (катализирует превращение цАМФ в АМФ). цГМФ играет важную роль в регуляции Са2+-гомеостаза в различных типах клеток. Повышение концентрации цГМФ приводит к понижению концентрации Са2+ как в результате активации Са2+-АТФ-аз, так и за счёт подавления рецепторзависимого поступления этого иона в цитоплазму клетки. Эти эффекты опосредованы действием протеинкиназы G на мембранные белки, участвующие в обмене Са2+. Передача сигнала с помощью внутриклеточных рецепторов Передача сигнала липидорастворимых стероидных гормонов и тироксина возможна только при прохождении этих гормонов через плазматическую мембрану клеток-мишеней.  Передача сигнала на внутриклеточные рецепторы. Рецепторы гормонов могут находиться в цитозоле или в ядре. Цитозольные рецепторы связаны с белком-шапероном, который предотвращает преждевременную активацию рецептора. Ядерные и цитозольные рецепторы стероидных и тиреоидных гормонов содержат ДНК-связывающий домен, который обеспечивает в ядре взаимодействие комплекса гормон-рецептор с регуляторными сайтами ДНК. Последовательность событий, приводящих к экспрессии специфических белков:
Эффекты гормонов, которые передают сигнал через внутриклеточные рецепторы, нельзя наблюдать сразу, так как на протекание матричных процессов (транскрипцию и трансляцию) требуется время. Специфичность сигнализации Для исследователей, имеющих представление о количестве сигнальных молекул, о соответствующем количестве рецепторов, о трансмембранных системах передачи сигналов, вторичных посредниках, остаётся загадкой, как протеинкиназы выбирают соответствующий фермент метаболического пути для фосфорилирования. Исследователи для объяснения этого явления предлагают "гипотезу мишени". По этой гипотезе специфичность протеинкиназ и фосфопротеинфосфатаз достигается путём образования компартментов на мембране, в состав которых входят не только сами протеинкиназы и фосфопротеинфосфатазы, но и специфические белки-субстраты. Наличие остатка миристиновой или пальмитиновой кислоты в структуре белков-субстратов - условие их "заякоривания" в соответствующем мембранном компартменте. Однако в большинстве случаев процесс активации какого-либо метаболического процесса находится под контролем не одной, а нескольких систем внутриклеточной сигнализации, поэтому важным фактором ответа клеток служит взаимосвязь этих систем. |
