|
|
Урок Циклоалканы. Урок. Циклоалканы
Урок. Циклоалканы
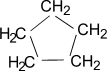
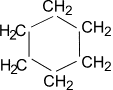
В отличие от предельных углеводородов, характеризующихся наличием открытых углеродных цепей, существуют углеводороды с замкнутыми цепями (циклами). По своим свойствам они напоминают обычные предельные углеводороды алканы (парафины), отсюда и произошло их название – циклоалканы (циклопарафины, нафтены). Общая формула гомологического ряда циклоалканов CnH2n. Представителями этого ряда соединений являются циклопропан, циклобутан, циклопентан, циклогексан.
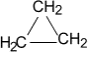
|

|
|
|
Циклопропан
|
Циклобутан
|
Циклопентан
|
Циклогексан
|
Очень часто в органической химии структурные формулы перечисленных циклоалканов изображают без символов C и H простыми геометрическими фигурами
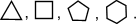
Физические свойства
Циклоалканы имеют более высокие температуры плавления, кипения и большую плотность, чем соответствующие алканы. При одинаковом составе температура кипения циклопарафина тем выше, чем больше размер цикла. Циклоалканы в воде практически не растворимы, однако растворимы в органических растворителях. Физические свойства некоторых циклоалканов представлены в таблице.
Таблица. Физические свойства некоторых циклоалканов
Соединение
|
t°пл.,
°С
|
t°кип.,
°С
|
Циклопропан
|
-126,9
|
-33
|
Метилциклопропан
|
-177,2
|
0,7
|
Циклобутан
|
- 80
|
13
|
Метилциклобутан
|
-149,3
|
36,8
|
Циклопентан
|
- 94,4
|
49,3
|
Метилциклопентан
|
-142,2
|
71,9
|
Циклогексан
|
6,5
|
80,7
|
Изомерия циклоалканов
Для циклоалканов характерны как структурная, так и пространственная изомерия.
Структурная изомеpия
1. Изомерия углеродного скелета:
а) кольца
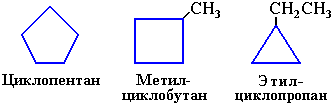
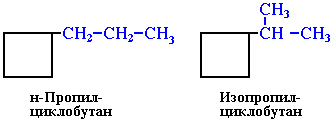
б) боковых цепей
2. Изомерия положения заместителей в кольце:
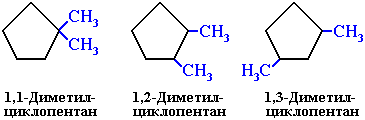
3. Межклассовая изомерия с алкенами:
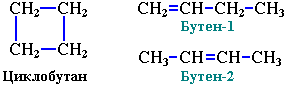
Пространственная изомерия
1. Цис-транс-изомерия, обусловленная различным взаимным расположением в пространстве заместителей относительно плоскости цикла. В цис-изомерах заместители находятся по одну сторону от плоскости кольца, в транс-изомерах – по разные анимация:
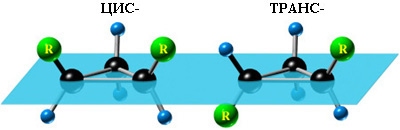
2. Оптическая изомерия некоторых ди- (и более) замещенных циклов. Например, транс-1,2-диметилциклопропан может существовать в виде двух оптических изомеров, относящихся друг к другу как предмет и его зеркальное изображение:
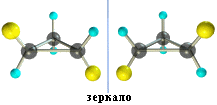
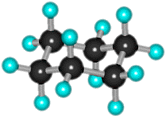
3. Конформационная изомерия циклоалканов. Все циклы, кроме циклопропана, имеют неплоское строение, что обусловлено стремлением атомов углерода к образованию нормальных (тетраэдрических) углов между связями. Это достигается поворотами по σ-связям С–С, входящим в цикл. При этом возникают различные конформации (поворотные изомеры) с разной энергией и чаще реализуются те из них, которые обладают наименьшей энергией, т.е. более устойчивые. Например, в циклогексане наиболее устойчивой является конформация "кресла".
Химические свойства
Химические свойства циклопарафинов зависят от числа атомов углерода, составляющих цикл. Низшие циклоалканы (циклопропан и циклобутан) ведут себя как ненасыщенные углеводороды, они способны вступать в реакции присоединения. Циклоалканы с большим количеством углеродных атомов в цикле ведут себя как алканы, для них характерны реакции замещения.
Реакции горения:
CnH2n + 3n/2O2 -t→ nCO2 + nH2O +Q
Малые циклы (n=3,4)
|
Реакции присоединения – сходство с алкенами.
1) Галогенирование:
C3H6 + Br2 → C3H6Br2 (1,3-дибромпропан )
циклопропан
2) Гидрирование:
C4H8 + H2 -t,Ni или Pt→ C4H10 ( бутан )
циклобутан
3) Гидрогалогенирование (по правилу Марковникова):
C3H6 + HI → CH3-CH2-CH2I ( 1- йодпропан )
|
Обычные циклы (n=5-7)
|
Реакции замещения – сходство с алканами.
1) Галогенирование:
C6H12 + Br2 -t→ C6H11Br + HBr
бромциклогексан
Реакции отщепления – дегидрирования циклогексана (р. Зелинского-Казанского):
C6H12 -t=300˚С ,Pt,Pd→ C6H6 + 3H2
бензол
|
Получение циклоалканов
В промышленности
|
1) Из нефти (пяти- и шестичленных)
Циклоалканы содержатся в значительных количествах в нефтях некоторых месторождений (отсюда произошло одно из их названий - нафтены). При переработке нефти выделяют главным образом циклоалканы С5 - С7.
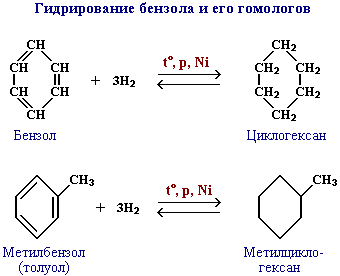
2) Из ароматических углеводородов – каталитическое гидрирование:
C6H6 + H2 -t,p,Ni→ C6H12
|
В лаборатории
|
Из дигалогенпроизводных алканов (внутримолекулярная реакция Вюрца):
Br-CH2-CH2-CH2-Br + Mg -t → MgBr2 + C3H6
или
Cl-CH2-CH2-CH2-CH2-Cl + 2Na → 2NaCl + C4H8
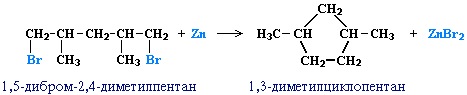
|
Применение
Наибольшее практическое значение имеют циклогексан, этилциклогексан. Циклогексан используется для получения циклогексанола, циклогексанона, адипиновой кислоты, капролактама, а также в качестве растворителя. Циклопропан используется в медицинской практике в качестве ингаляционного анестезирующего средства.
|
| |
|
|
 Скачать 73.93 Kb.
Скачать 73.93 Kb.