Урок Оксиды в свете ТЭД. Урок Оксиды в свете ТЭД 8 кл. Урок Оксиды в свете тэд
 Скачать 0.54 Mb. Скачать 0.54 Mb.
|
|
Урок «Оксиды в свете ТЭД» 8 кл (Слайд)
Оксиды: Элемент (Э) Оксиды - твердые     - жидкие - жидкиеМеталл Неметалл Мет.О Немет.О - газ (оксид металла) (оксид неметалла) 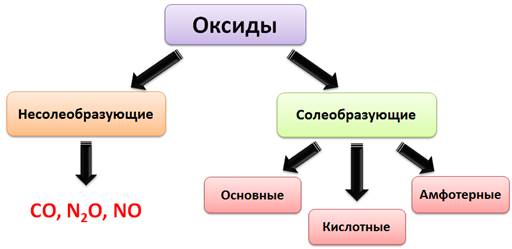 По химическим свойствам оксиды делятся на солеобразующие и несолеобразующие. Несолеобразующие оксиды – оксиды, которые не реагируют с кислотами и основаниями, а также не образуют солей: СО, NO, N2O. Остановимся на подробном рассмотрении солеобразующих оксидов. (основные, амфотерные, кислотные) ОСНОВНЫЕ ОКСИДЫ
Na → Na2O → NaOH Ba → BaO → Ba(OH)2 Металл Основный Основание Металл Основный Основание Оксид (гидроксид натрия) оксид  (оксид натрия) (оксид натрия)Записать: Основные оксиды вступают в реакции соединения с водой с образованием щелочей. Если образуется нерастворимое основание, то такая реакция не идёт. О 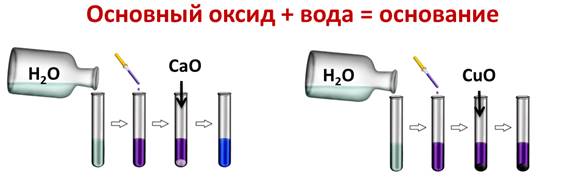 ПЫТ: Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.) ПЫТ: Например, если мы нальём в две пробирки воды и капнем туда несколько капель лакмуса, а затем поместим в первую пробирку оксид кальция, а в другую оксид меди (II), то реакция у нас идёт только в первой пробирке, т.к. образовалась щёлочь и лакмус изменил свою окраску на синюю, во второй пробирке изменений нет, т.к. оксид меди (II) не реагирует с водой, ведь Cu(OH)2 – нерастворимое в воде основание.)CaO + H2O = Ca(OH)2 CaO + H2O = Ca2+ + 2OH- CuO + H2O ≠ Основные оксиды вступают в реакции обмена с кислотами с образованием соли и воды. ОПЫТ: Поместим в пробирку немного порошка оксида меди (II), как видите, он чёрного цвета, в эту пробирку нальём раствора серной кислоты и слегка нагреем. Постепенно проходит реакция, т.к. порошок начинает растворяться. Чтобы убедиться в том, что в результате реакции образуется соль, несколько капель содержимого пробирки поместим на предметное стекло и выпарим, после чего на стекле появляются кристаллы соли.  CuO + H2SO4 = CuSO4 + H2O CuO + 2H+ = Cu2+ + H2O Основный оксид + Водород = Металл + Вода Na2O + H2 = 2Na + H2O КИСЛОТНЫЕ ОКСИДЫ
C → CO2 → H2CO3 ; Р → Р2О5 → Н3РО4 Неметалл Кислотный Кислота Неметалл Кислотный Кислота Оксид Оксид Записать:
Кислотные оксиды вступают в реакции соединения с водой с образованием кислоты. Однако эти реакции возможные, если оксид растворим в воде. ОПЫТ: Для этого подтверждения, нальём в одну пробирку дистиллированной воды, а в другую – раствор углекислого газа (газированной воды). В первую пробирку добавим оксида кремния (IV). А затем в каждую из пробирок добавим несколько капель лакмуса. В первой пробирке изменений нет, а во второй лакмус окрасился в красный цвет, значит, во второй пробирке кислота. В первой пробирке кислоты не образовалось, потому что оксид кремния (IV) не растворим в воде. 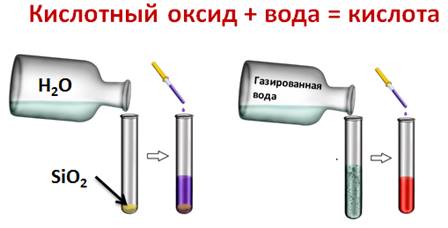 SiO2 + H2O ≠ CO2 + H2O ↔ H2CO3 Кислотные оксиды вступают в реакции обмена с основаниями, при этом образуется соль и вода. ОПЫТ: Если через пробирку с известковой водой пропустить углекислый газ, то известковая вода мутнеет, следствие образования соли – карбоната кальция.( или в газировку налить известковое молоко) 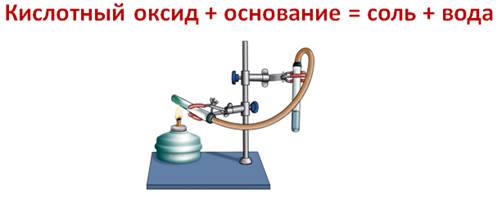 CO2 + Ca(OH)2 = CaCO3↓ + H2O CO2 + Ca2+ + 2OH- = CaCO3↓ + H2O 3Na2O + P2O5 = 2Na3PO4 MgO + SO3 = MgSO4 CaO + CO2 = CaCO3 АМФОТЕРНЫЕ ОКСИДЫ
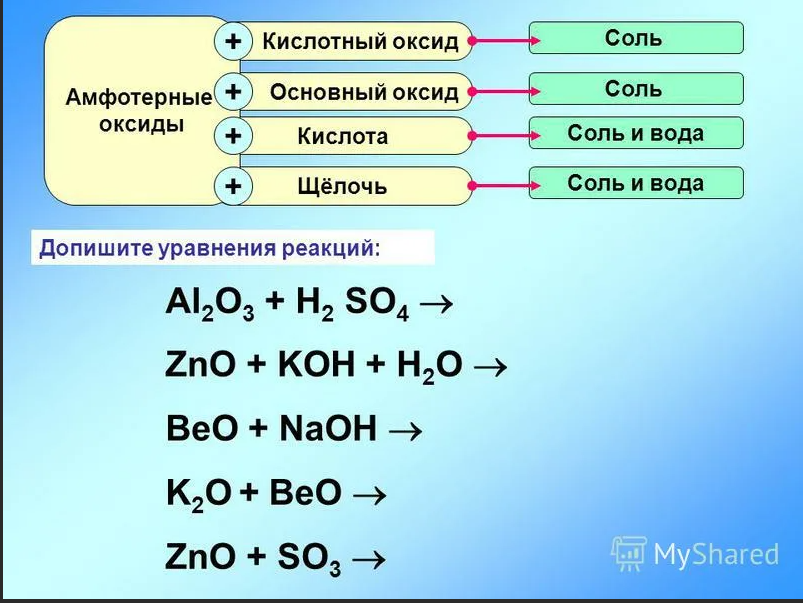 |
