Материаловедение. Урок1518 15. Практическое занятие 7 Анализ диаграммы состояния двойных сплавов
 Скачать 246.41 Kb. Скачать 246.41 Kb.
|
|
4.02.2021 Урок15-18 15. Практическое занятие 7Анализ диаграммы состояния двойных сплавов 16. Аллотропические превращения чистого железа. 17Диаграмма состояния сплавов системы железо – углерод. Основные характеристики структурных составляющих железоуглеродистых сплавов. Влияние углерода и постоянных примесей на свойства стали. 18. Практическое занятие 8 Решение задач по диаграмме Fe- Fe3С Рассмотрим диаграмму состояния компонентов с ограниченной растворимостью друг в друге в твердом состоянии (рис. 12). 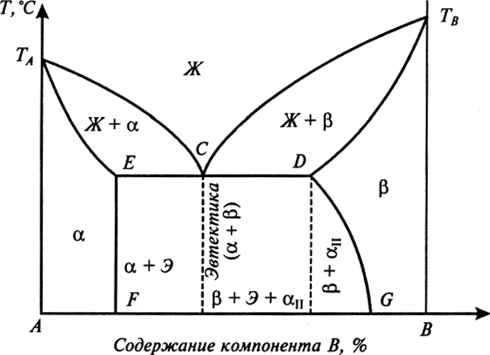 Рис. 12. Диаграмма состояния компонентов с ограниченной растворимостью друг в друге в твердом состоянии ТАиТв — температуры плавления компонентов Ап В соответственно. Линия ТАСТВ — линия ликвидус. Линия TAECDTB — линия солидус. Предельная растворимость компонента В в компоненте А соответствует точке F, компонента А в компоненте В — точке G. В интервале концентраций, соответствующих точкам F и G, компоненты А и В друг в друге нерастворимы. После кристаллизации сплавы таких концентраций представляют собой двухфазную систему, состоящую из а и р — твердых растворов. Сплав, соответствующий проекции точки С, является самым легкоплавким и называется эвтектическим. Этот сплав кристаллизуется (плавится) при постоянной температуре, при этом из расплава кристаллизуются одновременно две твердые фазы а- и p-растворы. Такой процесс называется эвтектическим превращением. Эвтектика — это механическая смесь нескольких твердых фаз, одновременно кристаллизующихся при постоянной температуре из расплава. Сплавы, относящиеся к области левее точки С до точки Е, называются доэвтектическими, правее точки С до точки D — заэвтектическими. 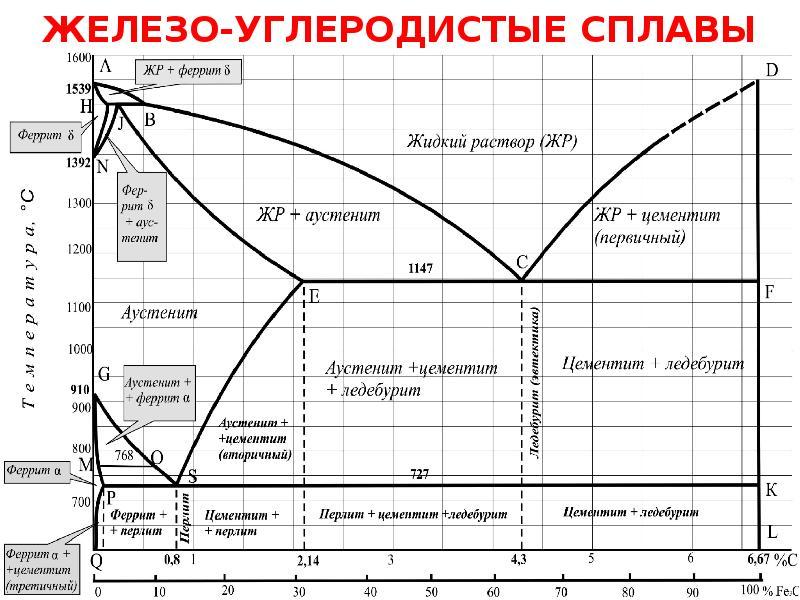 КОМПОНЕНТЫ В СИСТЕМЕ "ЖЕЛЕЗО-УГЛЕРОД" Компонентами железоуглеродистых сплавов являются железо, углерод и цементит: ЖЕЛЕЗО Железо – d-переходный металл серебристо-светлого цвета. Температура плавления – 1539° С. Удельный вес равен 7,86 г/см3. Наиболее существенной особенностью железа является его полиморфизм. В твердом состоянии железо может находиться в двух модификациях - α и γ. Полиморфные превращения происходят при температурах 911° С и 1392° С. При температуре ниже 911° С и выше 1392° С существует Feα (или α-Fе) с объемно-центрированной кубической решеткой. В интервале температур 911…1392° С устойчивым является Feγ (или γ-Fе) с гранецентрированной кубической решеткой. При превращении α→γ наблюдается уменьшение объема, так как решетка γ-Fе имеет более плотную упаковку атомов, чем решетка α-Fе. При охлаждении во время превращения γ→α наблюдается увеличение объема. В интервале температур 1392…1539° С высокотемпературное Feα называют Feδ. Высокотемпературная модификация Feα не представляет собой новой аллотропической формы. При температуре ниже 768° С железо ферромагнитно, а выше – парамагнитно. Точку 768° С, соответствующую магнитному превращению, т.е. переходу из ферромагнитного состояния в парамагнитное называют точкой Кюри. Модификация Feγ парамагнитна. Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (временное сопротивление – σв=250 МПа, предел текучести – σт=120 МПа) и высокими характеристиками пластичности (относительное удлинение – δ=50 %, а относительное сужение – ψ=80 %). Свойства могут изменяться в некоторых пределах в зависимости от величины зерна. Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов. Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения. УГЛЕРОД Углерод относится к неметаллам. Обладает полиморфным превращением, в зависимости от условий образования существует в форме графита с гексагональной кристаллической решеткой (температура плавления – 3500° С, плотность – 2,5 г/см3) или в форме алмаза со сложной кубической решеткой с координационным числом равным четырем (температура плавления – 5000° С). В сплавах железа с углеродом углерод находится в состоянии твердого раствора с железом и в виде химического соединения – цементита (Fe3C), а также в свободном состоянии в виде графита (в серых чугунах). ЦЕМЕНТИТ Цементит (Fe3C) – химическое соединение железа с углеродом (карбид железа), содержит 6,67 % углерода. Более точные исследования показали, что цементит может иметь переменную концентрацию углерода. Однако в дальнейшем, при разборе диаграммы состояния, сделаем допущение, что Fе3С имеет постоянный состав. Кристаллическая решетка цементита ромбическая, удельный вес 7,82 г/см3 (очень близок к удельному весу железа). При высоких температурах цементит диссоциирует, поэтому температура его плавления неясна и проставляется ориентировочно – 1260° С. Аллотропических превращений не испытывает. Кристаллическая решетка цементита состоит из ряда октаэдров, оси которых наклонены друг к другу. При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 210° С. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Цементит способен образовывать твердые растворы замещения. Атомы углерода могут замещаться атомами неметаллов: например, азотом; атомы железа – металлами: марганцем, хромом, вольфрамом и др. Такой твердый раствор на базе решетки цементита называется легированным цементитом. Если графит является стабильной фазой, то цементит – это метастабильная фаза. Цементит – соединение неустойчивое и при определенных условиях распадается с образованием свободного углерода в виде графита. Этот процесс имеет важное практическое значение при структурообразовании чугунов. ФАЗЫ В СИСТЕМЕ "ЖЕЛЕЗО-УГЛЕРОД"В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит, графит. ЖИДКАЯ ФАЗАЖидкая фаза. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы. ФЕРРИТФеррит (Ф, α)- твердый раствор внедрения углерода в α-железе (от латинского слова ferrum – железо). Различают низкотемпературный феррит с предельной растворимостью углерода 0,02 % при температуре 727° С (точка P) и высокотемпературный δ-феррит (в интервале температур 1392…1539° С) с предельной растворимостью углерода 0,1 % при температуре 1499° С (точка J). Свойства феррита близки к свойствам железа. Он мягок (твердость – 80 - 130 НВ, временное сопротивление – σв=300 МПа) и пластичен (относительное удлинение - δ=50 %), магнитен до 768° С. Под микроскопом феррит выглядит как светлые полиэдрические зерна. В сталях может существовать в виде сетки (разной толщины, в зависимости от содержания углерода), зерен (малоуглеродистые стали), пластин или игл (видманштетт). АУСТЕНИТ В СТАЛЯХАустенит (А, γ) – твердый раствор внедрения углерода в γ–железо (по имени английского ученого Р.Аустена). Углерод занимает место в центре гранецентрированной кубической ячейки. Предельная растворимость углерода в γ -железе 2,14 % при температуре 1147° С (точка Е). Аустенит имеет твердость 180 НВ, пластичен (относительное удлинение – δ=40…50 %), парамагнитен. При растворении в аустените других элементов могут изменяться свойства и температурные границы существования. Под микроскопом выглядит как светлые полиэдрические зерна с двойниками. ЦЕМЕНТИТ – ФОРМЫ СУЩЕСТВОВАНИЯВ железоуглеродистых сплавах присутствуют фазы: цементит первичный, цементит вторичный, цементит третичный. Химические и физические свойства этих фаз одинаковы. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Цементит первичный выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Цементит вторичный выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Цементит третичный выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен. Поскольку углерод в сплавах с железом встречается в виде цементита и графита, существуют две диаграммы состояния, описывающие условия равновесия фаз в системах железо - цементит и железо - графит. Первая диаграмма (Fе — Fе3С) называется цементитной (метастабильная), вторая (Fе - С) - графитной (стабильная). Оба варианта диаграммы приводятся вместе в одной системе координат: температура - содержание углерода. Диаграмма состояния системы железо - углерод построена по результатам многочисленных исследований, проведенных учеными ряда стран. Особое место среди них занимают работы Д.К. Чернова. Он открыл существование критических точек в стали, определил их зависимость от содержания углерода, заложил основы для построения диаграммы состояния железоуглеродистых сплавов в ее нижней, наиболее важной Диаграмма состояния — графическое изображение, показывающее фазовый состав сплавов в зависимости от температуры и концентрации химических элементов в условиях равновесия. Диаграмма железо-углерод, как ясно из названия, должна распространяться от железа до углерода. Железо образует с углеродом химическое соединение – цементит Fe3C. Следовательно, компонентами данной диаграммы можно считать железо и цементит. Принципиально важным для железо-углеродистых сплавов является то, что основной компонент - железо существует в двух аллотропических модификациях: объемноцентрированного куба (Fe - ОЦК) и гранецентрированного куба (Fe - ГЦК). Обычно железо никогда не бывает абсолютно чистым, оно всегда содержит примеси. В настоящее время можно получить железо высокой чистоты, минуя доменную плавку, - железо прямого восстановления (примеси 0, 01%), но чаще используют техническое железо (армко железо), которое содержит 99,8-99,9% железа и 0,1-0,2%примесей. Железо имеет высокую температуру плавления – 1539o С В твердом состоянии железо может находиться в двух модификациях. Полиморфные превращения происходят при температурах 911o С и 1392o С. При температуре ниже 911o С существует Feс объемно-центрированной кубической решеткой. В интервале температур 911…1392o С устойчивым является Fe с гранецентрированной кубической решеткой. Выше 1392o С железо имеет объемно-центрированную кубическую решетку и называется Fe или высокотемпературное Fe. Высокотемпературная модификация Fe не представляет собой новой аллотропической формы. При температуре ниже 768o С железо ферромагнитно, а выше – парамагнитно (немагнитно). Точка Кюри железа 768o С обозначается А2. Железо технической чистоты обладает невысокой твердостью (80 НВ) и прочностью (предел прочности – и высокими характеристиками пластичности (относительное удлинение – Железо характеризуется высоким модулем упругости, наличие которого проявляется и в сплавах на его основе, обеспечивая высокую жесткость деталей из этих сплавов. Железо со многими элементами образует растворы: с металлами – растворы замещения, с углеродом, азотом и водородом – растворы внедрения. Цементит химическое соединение железа с углеродом (карбид железа Fe3C), содержит 6,67 % углерода. Температура плавления цементита точно не установлена (1250-1550oС). При низких температурах цементит слабо ферромагнитен, магнитные свойства теряет при температуре около 217oС. Цементит имеет высокую твердость (более 800 НВ, легко царапает стекло), но чрезвычайно низкую, практически нулевую, пластичность. Такие свойства являются следствием сложного строения кристаллической решетки. В зависимости от содержания углерода железо-углеродистые сплавы делятся на два класса: стали и чугуны. На диаграмме состояния железо–углерод (рис. 1) сплавы, относящиеся к сталям, расположены в интервале концентраций углерода до 2,14 %, т.е. левее точки Е. Чугуны имеют в своем составе от 2,14 до 6,67% углерода. При температурах ниже 727 С все отожженные углеродистые стали состоят из двух фаз феррита и цементита. В зависимости от содержания углерода и структуры сталей различают: техническое железо - сплавы, содержащие до 0,02% углерода. доэвтектоидные стали - сплавы, содержащие от 0,02 до 0,8% углерода, э 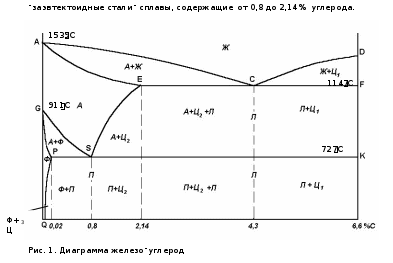 втектоидные стали - сплавы, содержащие 0,8% углерода, В системе железо – углерод существуют следующие фазы: жидкая фаза, феррит, аустенит, цементит. Жидкая фаза представляет собой неограниченный раствор железа и углерода, распространяющийся выше линии ликвидус АСD – от 0 до 6.67 %С. В жидком состоянии железо хорошо растворяет углерод в любых пропорциях с образованием однородной жидкой фазы. Твердые растворы. В данной системе имеются твердые растворы железа с углеродом на основе двух кристаллических модификаций железа. Они являются твердыми растворами внедрения, т.е. атомы железа занимают узлы пространственной решетки, а атомы углерода размещаются в междоузлиях. Феррит– твердый раствор внедрения углерода в температуре 727oС (точка P). Углерод располагается в дефектах решетки. Свойства феррита близки к свойствам железа. Твердость феррита около 800–1000 МПа, предел прочности σв250 МПа; σт120 МПа, относительное удлинение (δ ) до 50 %, а поперечное сужение φ -до 80 %. До температуры 768° С феррит ферромагнитен, выше – парамагнитен. Аустенит – твердый раствор внедрения углерода в -железо. Значительно большую область на диаграмме железо-углерод занимает твердый раствор углерода в γ-железе с ГЦК-решеткой, который называется аустенитом. Углерод занимает место в центре гранецентрированной кубической ячейки. Аустенит имеет переменную предельную растворимость углерода: минимальную – 0,8 % при температуре 727oС (точка S), максимальную – 2,14 % при температуре 1147oС (точка Е). Аустенит имеет твердость 1700 – 2000 МПа (200…250 НВ),σв 50 – 80МПа, пластичен (относительное удлинение – 3. Цементит – характеристика дана выше. В результате фазовых превращений в твердом состоянии при малых скоростях охлаждения в стали образуются следующие структуры: перлит, феррит, вторичный цементит Ц2 и третичный цементит Ц3. Влияние на механические свойства сплавов оказывает различие в размерах, количестве и расположении этих выделений. Ц1 выделяется из жидкой фазы в виде крупных пластинчатых кристаллов. Ц2 выделяется из аустенита и располагается в виде сетки вокруг зерен аустенита (при охлаждении – вокруг зерен перлита). Ц3 выделяется из феррита и в виде мелких включений располагается у границ ферритных зерен. Процессы при структурообразовании железоуглеродистых сплавов Все линии диаграммы можно разделить на следующие группы: линии ликвидус – начало затвердения при охлаждении или конец плавления при нагревании; линии солидус – конец затвердевания при охлаждении и начало плавления при нагревании; линии превращения в твердом состоянии. Из них особо выделяются горизонтальные линии (параллельные оси составов). Эвтектика системы железо – цементит называется ледебуритом (Л), по имени немецкого ученого Ледебура, содержит 4,3 % углерода. При температуре ниже 727o С в состав ледебурита входят Ц1 и П. По линии МО при постоянной температуре 768o С имеют место магнитные превращения. По линии PSK при постоянной температуре 727o С идет эвтектоидное превращение, заключающееся в том, что А, содержащий 0,8 % углерода, превращается в эвтектоидную смесь Ф и Ц2: По механизму данное превращение похоже на эвтектическое, но протекает в твердом состоянии. Эвтектоид системы железо – цементит называется перлитом (П), содержит 0,8 % углерода (П=Ц2+Ф). |
