2.КИСЛОТЫ. Валентность кислотного остаткаравна числу таких атомов водорода
 Скачать 234.18 Kb. Скачать 234.18 Kb.
|
|
КИСЛОТЫ Кислоты — это сложные вещества, в состав молекул которых входит активный атом водорода и кислотный остаток. Этот активный атом водорода в химических реакциях способен замещаться на атом металла, в результате чего всегда получается соль. В формулах неорганических кислот этот атом водорода записывается на первом месте*: * В химических формулах органических кислот атом водорода стоит в конце, например, CH3–COOH уксусная кислота В состав любой кислоты кроме атомов водорода входит кислотный остаток. Кислотный остаток — это часть молекулы кислоты без атомов водорода (которые могут быть замещены на атом металла).Валентность кислотного остаткаравна числу таких атомов водорода: 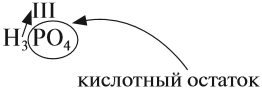 При определении валентности кислотного остатка учитываются те атомы водорода, которые участвовали в реакции или могут участвовать в ней. Так, фосфорной кислоте Н3РО4, в зависимости от условий, могут соответствовать кислотные остатки иного состава: 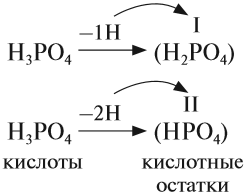 У органических кислот не все атомы водорода в молекуле способны замещаться на атом металла: 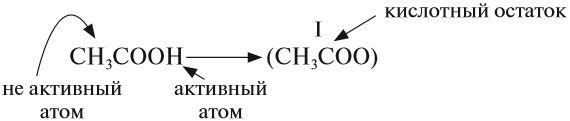 По числу атомов водорода кислоты делят на одноосновные и многоосновные: НСl — одноосновная, так как один атом водорода; Н2СО3 — двухосновная, так как два атома водорода. По составу кислоты делят на: бескислородные: НСl, Н2S; кислородсодержащие: НСlO, Н2SO4. Бескислородные кислоты представляют собой растворы некоторых газов в воде, при этом и растворённому газу, и полученному раствору приписывают одинаковые свойства, хотя это не так. Например, из простых веществ водорода и хлора получается газ хлороводород: Этот газ не проявляет кислотных свойств, если он сухой: его можно перевозить в металлических ёмкостях, и никакой реакции не происходит. Но при растворении хлороводорода в воде получается раствор, который проявляет свойства сильной кислоты, её перевозить в металлических ёмкостях нельзя! Этот раствор называется «соляная кислота». Названия бескислородных кислот составляют по принципу: «ЭЛЕМЕНТ» + «ВОДОРОД»ная кислота H2S — сероводородная кислота (это раствор газа сероводорода в воде); НСl — хлороводородная (соляная) кислота (это раствор газа хлороводорода в воде); НF — фтороводородная (плавиковая) кислота (это раствор газа фтороводорода в воде). Кислородсодержащие кислоты могут быть получены при действии воды на кислотные оксиды (см. задание 2.6). Исходные кислотные оксиды называются «АНГИДРИДЫ кислот»: 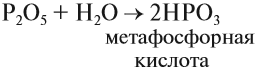 Метафосфорная кислота неустойчива и, присоединяя воду, превращается в более устойчивую кислоту:  или в суммарном виде: Таким образом, Р2O5 — ангидрид фосфорной кислоты, а также некоторых других, менее устойчивых кислот. Обратите внимание! Название кислородосодержащей кислоты содержит в виде корня название элемента, входящего в состав ангидрида: Если элементу соответствуют несколько кислот, то для кислоты с большей валентностью элемента, входящего в состав ангидрида, в названии употребляют суффикс «Н» или «В». Для кислот с меньшей валентностью элемента в названиях добавляют еще один суффикс «ИСТ». Валентность элемента проще всего определять по формуле ангидрида: 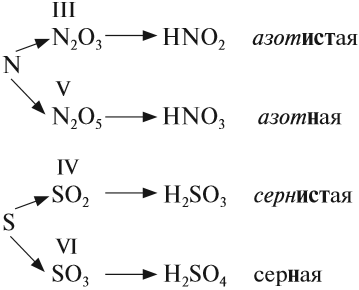 Обратим внимание, что в названии сернистой кислоты основной суффикс -ИСТ-, а суффикс -Н- введён дополнительно для благозвучия. Сведём всё известное о названиях кислот в таблицу 4. 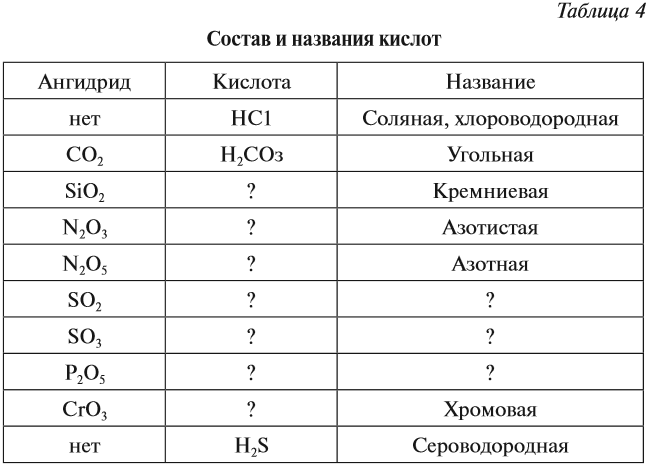 СВОЙСТВА КИСЛОТ Главным свойством всех кислот является их способность образовывать соли. Соли образуются в любой реакции, в которой участвует кислота, при этом замещаются активные атомы водорода (один, все или несколько). 1. Кислоты реагируютс металлами, при этом атом водорода кислоты замещается на атом металла — в результате образуется растворимая соль* и водород: * Если образуется нерастворимая соль, то эта соль закрывает поверхность металла и реакция останавливается.  Не все металлы способны вытеснять водород из растворов кислот: этот процесс возможен только для тех металлов, которые стоят в ряду напряжений ДО водорода (рис. 3 или таблица 3).  Некоторые кислоты могут растворять металлы, которые стоят в ряду напряжения после водорода, но водород при этом не выделяется: 2. Кислоты реагируют с основаниями образуя соль и воду*. Это реакция обмена, и поэтому валентность составных частей в результате реакции не меняется: * Реакция между кислотой и основанием называется реакцией нейтрализации.  Расставим коэффициенты: 3. Кислоты могут реагировать с солями, при этом сильная кислота вытесняет более слабую из её соли. К сильным кислотам относятся: серная, азотная, соляная и др. К слабым кислотам относятся: угольная, кремниевая, сероводородная, азотистая. Происходит реакция обмена: образуется новая соль и новая кислота. 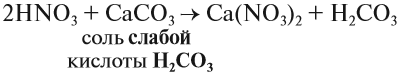 Более подробно о подобных реакциях 4. Выяснив свойства кислот ответьте на вопрос : Можно ли обнаружить кислоту в растворе? Например, в одном стакане налита вода, а в другом — раствор кислоты. Как определить, где кислота? Хотя многие кислоты кислые на вкус, пробовать их НЕЛЬЗЯ — это опасно! Выручают особые вещества — ИНДИКАТОРЫ. Это соединения, которые изменяют цвет в присутствии кислот: синий ЛАКМУС становится красным; оранжевый МЕТИЛОРАНЖ тоже становится красным. ВЫВОДЫ КИСЛОТЫ КЛАССИФИЦИРУЮТСЯ: по числу атомов водорода на одноосновные, двухосновные и т. д., по наличию атома кислорода в составе молекулы на бескислородные и кислородсодержащие, по силе на сильные и слабые, по устойчивости на устойчивые и неустойчивые. Кислоты реагируют: с активными металлами (до «Н»), с основаниями, с основными и амфотерными оксидами, с солями более слабых кислот. Кислоты обнаруживаются индикаторами в кислой («красной») области. ЗАДАНИЯ Задание 13. Определите состав и валентность кислотных остатков для кислот, учитывая, что всеатомы водорода кислот участвуют в реакции: Задание 14. Заполнить табл. 4, заменив знаки вопросов формулами и названиями соответствующих кислот. Задание 15. Напишите НА ПАМЯТЬ формулы кислот: кремниевой, сернистой, серной, сероводородной, азотистой, азотной, соляной, фосфорной, угольной. Укажите ангидриды этих кислот (там, где они существуют). Задание 16. Составьте уравнения возможных реакций серная кислота + алюминий → соляная кислота + серебро → бромоводородная кислота + цинк → При составлении уравнений пользуйтесь рядом напряжений и схемой реакции: кислота + металл (до водорода) → соль + водород Не забывайте, составляя формулы солей, учитывать валентность металла и кислотного остатка. Задание 17. Составьте аналогичные уравнения реакций по схеме: Кислота + Основание = Соль+ Вода для серной кислоты и Fe(ОН)3; соляной кислоты и Ва(ОН)2; сернистой кислоты и NаОН. Не забудьте! составить формулу соли по валентности металла и кислотного остатка; расставить коэффициенты. Задание 18. Составьте НА ПАМЯТЬ формулы : а) сильных кислот; б) слабых кислот Задание 19. Составьте уравнения реакций по схеме: (более сильная) кислота + соль → соль + кислота (более слабая): соляная кислота + FeS → азотная кислота + Na2SiO3 → серная кислота + K2CO3 → |
