мап. Теория цветности 2. Влияние пространственных факторов
 Скачать 122.5 Kb. Скачать 122.5 Kb.
|
|
Переход к 6 положению цветности ВЛИЯНИЕ ПРОСТРАНСТВЕННЫХ ФАКТОРОВ Большое влияние на поглощение света органическими соединениями оказывают пространственные (стерические) факторы, приводящие к искажениям формы молекул. При этом существенное значение имеет характер такого искажения. В основном все случаи такого рода можно разделить на две группы: искажения формы с нарушением плоскостности молекул и без такового. Нарушение плоскостности. Возникновение сопряженной системы приводит к образованию единого облака π-электронов в результате перекрывания отдельных облаков π-электронов соседних атомов. Поскольку эти облака симметричны относительно осей, перпендикулярных линии, которая соединяет центры атомов (т. е. линии σ-связи), а в случае ароматических соединений — относительно осей, перпендикулярных плоскости кольца, то наибольшее перекрывание облаков π-электронов имеет место при параллельном расположении их осей симметрии, что возможно лишь при плоском строении молекулы. Искажение плоскостности молекулы нарушает параллельность осей симметрии π-электронных облаков и уменьшает степень их взаимного перекрывания. Тем самым нарушается взаимодействие π-электронов, в том числе и возможность смещения их по цепочке сопряженных двойных связей. При повороте осей симметрии облаков π-электронов соседних атомов на 90° по отношению друг к другу перекрывание облаков полностью снимается, что означает фактический разрыв в этом месте цепи сопряжения. Однако и меньшее нарушение плоскостного строения, которое не приводит к полному снятию перекрывания соседних π-электронных облаков и полному разобщению участков цепи сопряжения, лежащих по обе стороны от места нарушения параллельности осей симметрии π-электронных облаков, сказывается на поглощении света: λмакс. сдвигается в сторону более коротких волн. Это объясняется тем, что нарушение плоскостности молекулы затрудняет ее переход в возбужденное состояние, требуя дополнительных энергетических затрат на восстановление плоской структуры, вследствие чего возрастает уровень энергии молекулы в возбужденном состоянии, а следовательно, и энергия возбуждения. Так, молекулы бифенила и 9,10-дигидрофенантрена имеют одинаковые сопряженные системы и равное число π-электронов в них, но молекула бифенила в основном состоянии не плоская из-за вращения вокруг связи Сар—Сар . 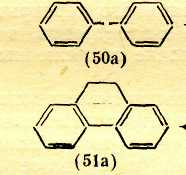 В молекуле 9,10-дигидрофенантрена бензольные кольца жестко закреплены мостиком СН2СН2 и поворот вокруг связи Сар—Сар невозможен. Поэтому полоса поглощения бифенила смещена на 15,5 нм в коротковолновую область по сравнению с дигидрофенантреном . Свободное вращение. Разобщение отдельных частей сопряженной системы вследствие вращения вокруг связи С—С является причиной так называемого эффекта внутримолекулярного смешения цветов, особенно часто наблюдаемого в случае азокрасителей; каждая независимая сопряженная система молекулы поглощает «свои» фотоны подобно самостоятельной изолированной молекуле, и цвет соединения приблизительно отвечает цвету смеси соответствующих окрашенных соединений. Например, зеленый цвет азокрасителя (60), в молекуле которого вращение вокруг связи Сар—Сар между бензольными остатками нарушает единую цепь сопряжения, приблизительно соответствует цвету смеси желтого (61) и темно-синего (62) красителей, которые образуются при фактическом разрыве молекулы (60) по месту этой связи. 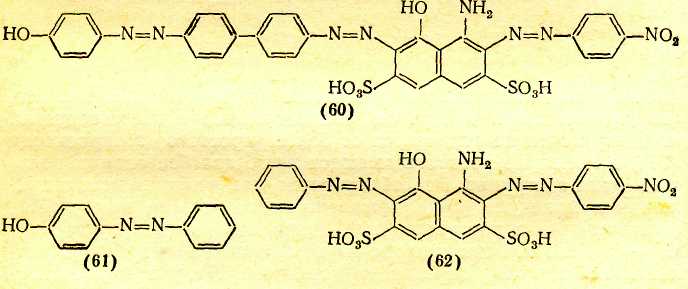 Пространственные затруднения. При наличии вблизи связи С—С крупных по размерам заместителей возникают пространственные затруднения, делающие неизбежным поворот вокруг этой связи и закрепляющие неплоское строение молекулы. 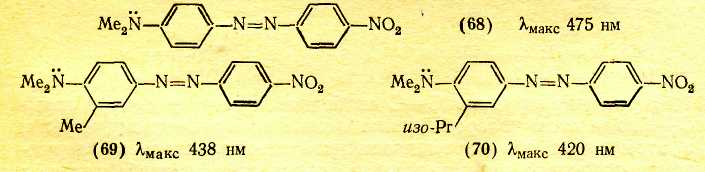 Например, если в молекулу красителя (68) в орто-положение к ЭД-заместителю (группе Me2N) ввести метильную группу [краситель (69)] или еще более объемистую изопропильную группу [краситель (70)], возникают пространственные затруднения, выводящие диметилами-ногруппу из плоскости ароматического кольца. Вследствие этого неподеленные электроны атома азота диметиламиногруппы в той или иной степени выходят из сопряжения с π-электронами кольца, что ослабляет электронодонорное действие этой группы, в результате чего наблюдается гипсохромный сдвиг максимума поглощения и уменьшение интенсивности поглощения соответственно в 1,5 и 1,7 раза. Искажение валентных углов. Если искажение формы молекулы происходит без значительного нарушения ее плоской структуры и заключается в изменении нормальных углов между направлениями связей атомов, то наблюдается сдвиг полосы поглощения в длинноволновую область спектра, т. е. углубление цвета. Причиной этого является то, что при изменении валентных углов без нарушения плоскостности молекулы сопряжение π-электронов существенно не нарушается, так как оси симметрии облаков π-электронов остаются параллельными. Однако возникающее в молекуле напряжение приближает уровень ее энергии в основном состоянии к уровню энергии возбужденного состояния, снижая тем самым энергию возбуждения. Шестое положение теории цветности Нарушение плоскостности молекул в результате свободного вращения вокруг простой связи или поворота вокруг простой связи под влиянием пространственных затруднений приводит к частичному или полному разобщению отдельных участков сопряженной системы, что сопровождается сдвигом полосы поглощения в коротковолновую область спектра (т. е. повышением цвета). Изменение валентных углов атомов под влиянием пространственных затруднений, происходящее без нарушения плоскостности молекулы, сопровождается сдвигом полосы поглощения в длинноволновую область (т. е. углублением цвета). Переход к 7 положению цветности КОМПЛЕКСООБРАЗОВАНИЕ С МЕТАЛЛАМИ Поскольку поглощение света органическими соединениями зависит от перехода в возбужденное состояние электронов, участвующих в процессах смещения в системах сопряженных связей, всякое изменение в молекуле, в котором участвуют эти электроны, отражается на окраске. Это наблюдается, в частности, при некоторых процессах образования внутрикомплексных соединений с металлами. В молекуле внутрикомплексного соединения атом металла входит в устойчивый пяти- или шестичленный цикл, будучи связан по крайней мере с двумя различными атомами. 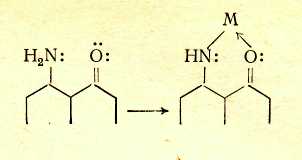 Электронное состояние атома кислорода карбонильной группы существенно изменяется, поскольку одна из принадлежавших ему неподеленных пар электронов расходуется на связь с атомом металла. Атом металла при этом включается в сопряженную систему, оказывая на нее влияние как своей электронной оболочкой, так и зарядом ядра. В качестве металлов-комплексообразователей в химии красителей наиболее часто используют хром, медь, никель, кобальт, железо, алюминий. Комплексообразование с металлами создает новые возможности электронных переходов, обусловливающие появление новых полос поглощения в спектрах комплексов. Комплексообразование с углублением цвета. Если атом, предоставляющий неподеленную пару электронов для образования связи с атомом металла, входит в главную систему сопряженных двойных связей органического соединения, ответственную за поглощение света в длинноволновой области, то комплексообразование сопровождается углублением цвета. Так цвет Ализарина (79) углубляется от желтого до красного при комплексообразовании с соединениями алюминия, до коричневого — с соединениями хрома, до фиолетового — с соединениями железа. Здесь комплексообразование также изменяет электронную оболочку атома кислорода, входящего в сопряженную систему, что и является причиной углубления окраски. 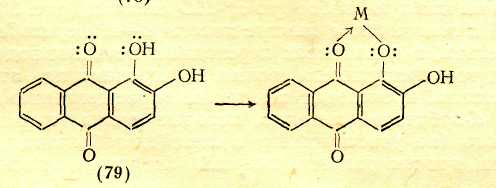 Комплексообразование без углубления цвета. Если образование внутрикомплексного соединения существенно не меняет электронную оболочку атомов, входящих в систему сопряженных связей, т. е. происходит не за счет неподеленных пар электронов, участвующих в процессах смещения электронов в этой системе, то комплексообразование практически не отражается на цвете. Так, азокрасители, являющиеся производными салициловой кислоты, например (84), почти не изменяют окраску при образовании внутрикомплексных соединений. Это объясняется тем, что карбоксильная группа находится в мета-положении к азогруппе и не сопряжена с нею, вследствие чего неподеленные электроны кислорода, за счет которых возникает координационная связь с атомом металла, не участвуют в процессах смещения в главной сопряженной системе; электронная же оболочка кислорода гидроксигруппы, входящего в эту систему, существенно не изменяется при замещении связанного с ним атома водорода металлом. 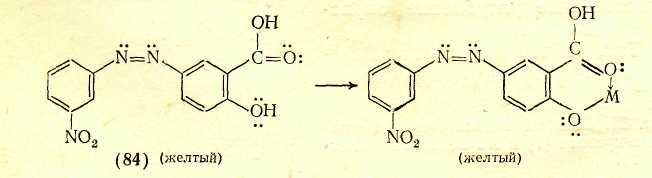 Седьмое положение теории цветности Комплексообразование органических соединений с металлами создает возможность дополнительных электронных переходов. При этом, если при образовании внутрикомплексного соединения с металлом координационная связь возникает за счет неподеленной пары электронов атома, который входит в сопряженную систему лиганда, ответственную за поглощение света в видимой части спектра, комплексообразование приводит к углублению цвета. |
