Индивидуальный проект на тему вода - экологический вид топлива. А-версия проекта (2). Вода экологический вид топлива
 Скачать 277.88 Kb. Скачать 277.88 Kb.
|
|
Государственное общеобразовательное учреждение Ростовской области «Орловский казачий кадетский корпус» Исследовательская работа на тему: « Вода – экологический вид топлива » Выполнил работу кадет 10 класса Яковлев Василий Владимирович Руководитель проекта Учитель физики Каменцева Ольга Николаевна п.Орловский 2021г. ОглавлениеВведение 3 Глава 1 4 История открытия водорода 4 Физико-Химические свойства водорода 5 Получение водорода электролизом воды и растворов солей 6 Получение водорода химическими реакциями. 8 Закон Фарадея для электролиза воды. 9 Стехиометрические различия водорода и газа Брауна. 9 Глава 2 10 Электролизер. Сборка 10 Описание процесса работы 12 Приложения 12 ВведениеМиллионы нефтяных вышек работают, чуть ли не круглосуточно, добывая нефть и попутный газ, что бы эту нефть, газ могли сжигать миллионы тепловых станций и котельных, миллиарды машин и мотоциклов, мопедов скутеров и пр. Этот процесс сопровождается выбросами в атмосферу миллиардами тонн углекислого газа в атмосферу, тем самым повышая удельную массу этого газа. Человек пользуется углеводородным топливом уже давно. Под углеводородным топливом можно считать от дров, которыми до сих пор отапливаются дома в деревнях и в некоторых небольших поселках (в подобном живу и я), до природного газа, благодаря которому, мы не замерзаем зимой. Подобное топливо в себе хранит энергию, какая человеку нужна и для выживания (изначально), и для комфортной жизни (сейчас) - это, конечно, положительная сторона углеводородного сырья, но, при сжигании (то есть высвобождении необходимой энергии) выделяется газ СО2 , сказывающий пагубное влияние на экологию. Это влияние связано с тем, что СО2 скапливается в атмосфере, создавая парниковый эффект, из-за которого происходит глобальное повышение температуры. Конечно, не стоит забывать, что углекислый газ поглощается растениями, мировым океаном и некоторыми зелеными бактериями, но интенсивность поглощения ими углекислого газа отстает от скорости синтеза человеком этого газа, именно поэтому человечеству необходимо задуматься над сокращением выбросов СО2 в атмосферу. С этой проблемой человечество стало бороться относительно недавно, но уже заметен прогресс в данном направлении. Привычному для нас топливу альтернативой может стать водород, который является составляющей частью воды. Положительная сторона водородного топлива заключается в том, что оно и есть вода, только вода, разложенная на водород и кислород. Да, для того, чтобы добыть данное топливо, нужно затратить некоторую энергию, притом, что не вся затраченная энергия пойдет на образование водородного газа (ведь КПД не будет равным 100%)- это из минусов. Но можно для этого использовать энергию ветряных электрогенераторов и солнечных батарей, которые синтезируют электроэнергию, зачастую, в не совсем удобное для человека время (поэтому теряется часть энергии), тогда водород заменит аккумуляторы, которые итак не эффективные, но еще и экологически - вредные. Стоит сказать, что при сгорании газа Брауна ((здесь и далее) смесь атомарного и двухатомного газов кислорода и водорода, то самое водородное топливо, или же по-другому водный газ, синтез-газ) образуется водный пар. Этот пар не имеет такого свойства углекислого газа, как скапливаться в атмосфере. Пар, конденсируясь в воду, выпадает в виде привычного дождя - круговорот воды в природе, то есть воду нельзя исчерпать - это конечно относится к плюсам. Не стоит упускать из виду, что газ Брауна по энергоемкости уступает лишь обогащенному урану, и имеет самую высокую скорость сгорания во вселенной. Проблема: замена углеводородного топлива на альтернативный газ Брауна Актуальность: водяной газ имеет много преимуществ над углеводородным топливом. Например, безотходное производство, стоит заметить, что производство, а не добыча; Продукт сгорания не представляет опасности для экологии; Неисчерпаемость воды – основного компонента безотходного производства. Цель проекта: с помощью электрического тока разделить молекулы воды на газ Брауна – О2 + Н2. Задачи: углубленно изучить тему проекта; Собрать установку для электролиза; провести опыты по получению газа Брауна, с помощью собранной установки; Подготовиться к защите проекта и сделать презентацию для этого Гипотеза: проведя электрический ток через воду, мы сможем ее разделить на горючий водородно-кислородный газ. Методы: анализ основных процессов электролиза; проектировка прибора, который позволит провести электролиз воды, создание этого прибора; добыча газа Брауна в домашних условиях Этапы проведения проекта: анализ процессов, происходящих при электролизе. приобретение материалов, нужных для создания электролизера. сбор электролизера и прочего оборудования. опыты по получению газа Брауна. оформление \ составление окончательного варианта проекта. создание презентации и подготовка к защите проекта Практическая ценность проекта: продукт данного проекта в большей степени может решить многие проблемы пользования энергии топлива. Сферы, где может применяться газ Брауна, достаточно разнообразны: от использования в котельных, тепловых электростанциях и в качестве машинного топлива, до основного топлива самолетов и космических ракет. Если не использовать водород как основное топливо, то можно смело пользоваться им, как добавкой к основному топливу. Хоть газ Брауна это смесь водорода и кислорода в определенных пропорциях, мы будем в основном рассматривать водород, потому что кислород имеется в атмосфере, и его получать не обязательно. Глава 1История открытия водородаВ открытии водорода и описании его свойств особое участие принимали ученые XVI и XVII веков. Первым, кто смог получить водород и, главное, описать, был Парацельс (Фили́пп Аурео́л Теофра́ст Бомба́ст фон Го́генгейм) – Швейцарский алхимик, врач, философ. Он погружал металлы в серную кислоту, в надежде получить философский камень, но получил газ, который интенсивно горел. Реакции металлов с разбавленными кислотами, при которых образуется водород, в 1671 году описал Роберт Бойль – англо-ирландский натурфилософ, физик, химик и богослов. В 1766 британский физик и химик Генри Кавендиш смог добыть чистый газообразный водород. При описании его свойств, водороду присвоили название « Горючий воздух». Во времена Кавендиша, была распространена гипотеза, что в любом горючем веществе, будь то древесина, уголь или же горючий газ, имеется флогистон. Флогистон – это гипотетическое вещество, «сверхтонкая материя», «огненная субстанция», которая, как считалось, имеется во всем горящем, высвобождающаяся при горении. Сам Кавендиш являлся приверженцем этой теории, поэтому он считал, что водород и есть чистый флогистон. По его мнению, в реакциях взаимодействия кислот с металлами происходило вытеснение этого гипотетического загадочного вещества (флогистона) из самого металла, ему не могло прийти в голову, что реакция происходит примерно так: Кислота + Ме = соль + Н2↑ (1.1) H+x (кислотный радикал) x- + Me = Mey+x(кислотный радикал)yx- + H2 ↑ (1.2) Где металл вытеснял водород из соединения кислоты По мнению Кавендиша, все происходило по-другому: [Me * флогистон] + кислота = соль + флогистон (водород) ↑ (1.3) Ломоносов, при изучении водорода, еще в 1745 году отмечал сильное сходство водорода и флогистона и, какое-то время, считал водород этим гипотетическим веществом, но, все-таки, понимал, что выделявшийся газ - простое вещество, которое флогистоном не является Свой вклад в изучении водорода внес Антуан Лавуазье. Работая вместе с инженером Жаном Мёнье, Лавуазье смог получить чистый водород, прогнав водяной пар над раскаленным железом. Этим экспериментом они доказали, что водород входит в состав воды и что вода не являлась простым неделимым веществом, как это считалось ранее. Теория флогистона была опровергнута. Физико-Химические свойства водородаВодород является веществом весьма интересным. Про него можно смело говорить «самый-самый…»: Еще с уроков химии мы знаем, что таблица химических элементов Менделеева начинается с водорода. Это неспроста, ведь водород устроен проще, чем любой другой элемент: водород - это всего лишь 1 протон, рядом с которым, в постоянном движении, находится 1 электрон. На этом физико-химические свойства элемента не заканчиваются. В свободном состоянии, при н.у., газообразный водород не имеет ни цвета, ни запаха, ни вкуса. Благодаря простоте своего строения, hydrogen - самое легкое вещество, что в газообразном состоянии (при температуре водорода T>33K) среди газов, что в жидком (при температуре водорода T<33K) среди жидкостей, что в твердом состоянии (при температуре водорода T<13К) среди твердых веществ. Так же стоит отметить, что атом водорода имеет настолько маленький радиус, что молекулу этого вещества не могут задержать никакие вещества. Это значит, что газообразный водород диффундирует с любой поверхностью, поэтому водород опасно хранить подобно тому, как хранят природные газы. Это является одним из отрицательных свойств водородного топлива. (См. табл. 1.1) Водород, в своем роде, один из лучших восстановителей. Это свойство используют при восстановлении некоторых цветных металлов из их окислов. Он легче всего отдает единственный электрон, при этом становясь положительным ионом. В металлургии восстановителем чаще всего используют кокс (мелкодисперсный углерод) или оксид углерода II, но водород мог бы частично заменить эти вещества. Почему частично? Во многих сплавах кокс есть, как составляющая вещества. Но не исключено и то, что водород может стать окислителем. Это происходит в случаях реагировании с более активными металлами. При контакте его с щелочными и щелечноземельными металлами (металлы 1й и 2й группы), водород образует такие соединения, как гидриды (NaH, KH, CaH2). Интересен тот факт, что водород самое распространенное вещество во вселенной, а на земле он уступает кислороду, кремнию, алюминию, железу, кальцию, натрию, калию. Имеются и другие физические свойства этого удивительного газа. (См. табл. 1.2) Получение водорода электролизом воды и растворов солейВ некоторых случаях, мы будем рассматривать получение лишь водорода, а не всего газа Брауна, ведь газ Брауна – это кислород и водород, а кислород имеется в атмосфере. На данный, момент человек знает большое количество способов получения водородного топлива, но электролиз водных растворов солей, кислот и щелочей отличается целым рядом преимуществ. Во-первых, в ход идет сырье достаточно доступное — водный раствор солей, кислот и щелочей и электроэнергия. Во-вторых, производство отличается экологичностью – никаких загрязняющих выбросов не может быть априори. В-третьих, процесс может быть целиком автоматизирован. И, наконец, на выходе мы получаем 99,99% чистый водород, в зависимости от того, раствор какого вещества мы подвергаем электролизу Электролиз – это физико-химический процесс, при котором, для проведения окислительно-востановительной реакции, через вещество пропускается электрический ток. В нашем случае мы будем рассматривать электролиз водного раствора едкого натра (NaОН). В результате проведения электролиза, в пересчете на 1 кг воды (1 л), можно получить около 1860 л газа Брауна (при н.у.) Но, так же, стоит отметить, что существует электролиз расплавов. Этот вид электролиза отличается тем, что вещество, через которое пропускают ток, не растворяется в воде, а значит реакция происходит без воздействия ионов Н+ и ОН-, на которые разлаживается вода из-за диссоциации (растворения) кислот, щелочей и солей в воде. Нужное для электролиза вещество нагревают до его плавления, и с этим расплавом производят электролиз. Подобный метод электролиза используют в тех случаях, когда нужно осадить какой-либо активный металл или выделить нужный неметалл. При электролизе водного раствора, как я сказал выше, помимо ионов растворенного вещества, в реакции участвуют ионы воды, поэтому при электролизе водного раствора на катоде возможны следующие реакции: Восстановление катионов металла (Men+): Men+ + nē = Me. (2.1) Восстановление металлов, расположенных в ряду активностей металлов после водорода, происходит легче всего. Если рассматривать металлы, находящиеся в РАМ от алюминия до водорода, то на катоде происходит реакция восстановления и металла, и водорода. Активные металлы (все, что находятся левее алюминия включительно) восстановить из водных растворов очень сложно. Восстановление водорода из воды 2Н2О + 2ē Н2↑ + 2ОН– (2.2) Происходит, при наличии в растворе ионов активных металлов. (См. Табл. 2.1) На аноде, в зависимости от рода аниона, так же возможные разные восстановительно-окислительные реакции: Окисление аниона (Ann-), до образования простого вещества: Ann- - nē = An (2.3) Происходит, при наличии в растворе кислот и солей анионов галогенов, кроме солей и кислот, содержащих фтор, потому что при наличии ионов этого галогена в растворе, при электролизе происходит окисление воды (об этом чуть ниже). Или происходит окисление гидроксильной группы в растворе щелочи: 4ОН- - 4ē = 02↑+ 2Н2О (2.4) Окисление воды: 2Н2О- 4ē = 2О2↑+2Н2 (2.5) В растворе кислородосодержащих анионов кислот и солей и неорганических соединений фтора См. Табл. (2.3) Поэтому, для производства достаточно чистого газа Брауна, нам нужно подобрать такой раствор либо щелочи, либо кислоты, либо соли, чтоб составляющие этих веществ при окислительно-восстановительных реакциях не конкурировали с ионами воды Н+ и ОН-. Для этого идеально подходит карбонат натрия Na2CO. Этот вариант как раз идеален, ведь катион – очень активный металл, а анион – содержит кислород. Рассмотрев практически все нюансы электролиза водных растворов, мы можем теперь расписать окислительно-восстановительный процесс, происходящий во время электролиза: Диссоциация: Na2CO3 ↔ 2Na+ + CO32- Н2О ↔Н+ + ОН- КАТОД (-): Na+ и CO32- не восстанавливаются, поэтому постоянно находятся в растворе; происходит восстановление воды до атомарного водорода и гидроксильной группы КАТОД(-): 2Н2О+ 2ē = Н2↑+ 2ОН (восстановление водорода) АНОД(+): 2Н2О - 4ē = 2О2↑+2Н2 (окисление воды) СУМАРНОЕ: 4Н2О + 4ē + 4ОН¯ - 4ē = 2H2↑ + 4OH¯ + 2H2O +O2↑ (в связи с тем, что реактив пришлось сменить с гидроксида натрия на карбонат натрия, нужно переписать эту строчку, это я седлаю в корпусе) 2Н2О (электролиз)→ 2Н2↑ + О2↑ Получение водорода химическими реакциями.Достаточно очевидным является то, что водород можно получить, если провести реакцию металлов и кислот. Этим и занимались те первые, которые открыли и описали водород. В обобщенном виде, формула любой неорганической кислоты выглядит так: Н+n(кислот. радикал)n- Кислоту определяет не столько кислотный радикал, сколько наличие водорода. Ведь кислотный радикал имеется и в солях, но кислотами они не являются. Отличие органических кислот от неорганических в том, что, вместо кислотного радикала у таких кислот карбоксильная группа. Водород в них тоже присутствует, иначе они не были бы кислотами. Данный водород достаточно несложно освободить. Это осуществляется добавлением в кислоты металлов: Н+n(кислот. радикал)n- + Ме = Меm-n(кислот. радикал)n-m + (n/2)Н2↑ Так же водород выделяется при взаимодействии щелочных и щелочноземельных металлов с водой: 2Na + 2H2O = 2NaOH +H2↑ Ca +2H2O = Ca(OH)2 + H2↑ И при взаимодействии гидридов тех же металлов с водой: NaH + H2O = NaOH + H2↑ Почему мы все-таки решили провести электролиз? Электролиз является наиболее экологичным выбором, ведь во всех реакциях, описанных выше, имеется какой-либо продукт реакции помимо водорода. С продуктами этих реакциях приходилось бы что-нибудь делать. Далеко не самое рациональное пользование ресурсов Закон Фарадея для электролиза воды.Впервые теоретическое предположение о связи массы вещества, выделившегося при электролизе, от параметров электролиза в 1836 году установил Майкл Фарадей. Он стремился установить количественное соотношение, поэтому проводил эксперименты в 1833-1834. В конечном результате его закон выглядит так:  Где I– сила тока;  - время, за которое проходит ток через электролит или расплав; k – электрохимический коэффициент вещества, который рассчитывается для каждого вещества отдельно по формуле: - время, за которое проходит ток через электролит или расплав; k – электрохимический коэффициент вещества, который рассчитывается для каждого вещества отдельно по формуле: F- Постоянная фарадея, равная 9,65 ∙ 104 Кл/моль; M – молярная масса вещества; n- химическая валентность вещества. Если подставить в закон Фарадея формулу электрохимического коэффициента, то выйдет так: 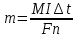 Так же, массу вещества можно рассчитать и по другому: Стехиометрические различия водорода и газа Брауна.Хоть выше я и сказал, что в основном рассматривать буду водород, но в такой теме, как стехиометрия, водород координально отличается от газа Брауна. Стехиометрия – это раздел химии, в котором изучаются соотношения реагирующих веществ. В стехиометрии различают два вида горения веществ: кинетический и диффузионный. Диффузионный тип горения веществ заключается в том, что горючее вещество не перемешано с окислителем, и, при горении, окислитель диффундирует в воспламеняемое вещество (поэтому и диффузионный тип горения), в область химической реакции. Для такого типа горения характерно то, что скорость горения зависит не только от скорости химической реакции, но и от других физико-химических факторов. Такими факторами могут быть и скорость поступления реагирующих веществ, и степень диффузии окислителя в пламя. Отличительной чертой данного типа горения веществ является наличие фронта пламени – тонкой светящейся «пленки» в пламени. Фронт пламени это зона, обычно, не превышающая толщиной десятые доли миллиметра, в ней происходят химические реакции горения. Именно туда должен диффундировать окислитель. Не стоит упускать из виду, что диффузионо могут гореть и гетерогенные (пламя создается горением твердого или жидкого вещества в газообразном окислителе) и гомогенные (и горючее вещество, и окислитель - газы) горючие вещества. При кинетическом горении фронт пламени тоже есть, но стоит различать фронт пламени при ламинарном горении (не создаются завихрения; фронт пламени ровный и неподвижный относительно горелки) и при турбулентном, когда фронт пламени либо не имеет ровных краев (низкая степень турбулентности), либо вообще его заметить вообще не представляется возможным (высокая степень турбулентности). Отличие кинетического типа горения от диффузионного заключаются в том, что оно происходит только в гомогенных горючих веществах и в том, что горючее вещество с окислителем предварительно перемешано. Благодаря этому зависимость скорости горения заключена только в физико-химических свойствах данного газа(-ов), в особенности таких, как концентрация веществ, давление (и атмосферное, и парциальное), теплопроводность, теплоемкость, турбулентность. При кинетическом горении фронт пламени тоже имеется, но стоит различать фронт пламени при ламинарном горении (не создаются завихрения; фронт пламени ровный и неподвижный относительно горелки (диффузионное горение)) и при турбулентном, когда фронт пламени либо не имеет ровных краев (низкая степень турбулентности), либо его заметить вообще не представляется возможным (высокая степень турбулентности). Глава 2Электролизер. СборкаДля более эффективного электролиза мне нужно сделать «электролизер» - прибор, позволяющий проводить электролиз максимально эффективно. Как я говорил выше, что б провести электролиз, нужно провести через раствор или расплав электрический ток, для этого нужно опустить электроды, подключенные к сети, соответственно на «+» и «-» при постоянном токе, в растворили расплав. Обычно электродами берут графитовые стержни, т.к. графит не взаимодействует с большинством из реагентов. Конечно, я графитовые стержни заменю, ведь они обладают низкой электропроводностью - это раз; второе - нам нужно добиться того, чтоб газ, добываемый нами, исходил под некоторым давлением. Это связанно с тем, что водородно-кислородная смесь имеет самую высокую скорость сгорания, поэтому нужно добиться такой скорости истечения газа, что бы газ горел и имел постоянное пламя, а не просто взрывался. Как раз взрыв этой смеси нам нужно будет предотвратить, именно для этого мной был приобретен огнепреградительный клапан. Добиться этого давлением можем, если резервуар с раствором будет герметично закрыт с электродами. Легче всего получить такой результат мы сможем, если использовать не графитовые стержни, а пластины из нержавеющей стали. Это решение имеет еще несколько преимуществ: Интенсивность электролиза прямопропорционально зависит от площади электрода, ведь процессы, происходящие в этот момент, идут у поверхности электродов, и, чем больше данная поверхность, тем большая скорость реакций, а у пластины площадь поверхности куда больше, нежели у стержня. Из этих пластин можно сделать нужный резервуар, некую электролитическую ячейку. Если в каждой пластине сделать 2 отверстия для поступления раствора и выхода газа, между каждой стальной пластины класть резиновые прокладки 2-3 мм толщиной, то образуются ячейки, в которых будет происходить процесс электролиза. Всю эту конструкцию, похожую на слоеный торт, мы помещаем между двух пластин из оргстекла и крепко стягиваем болтами. Оргстекло выбрано было для того, чтобы можно было наблюдать за процессом. Его можно заменить любым другим материалом, но только так, чтобы этот материал либо не проводил электрический ток либо не контактировал с болтами, иначе будет потеря электрического тока на обкладках и будет совершаться меньшая работа по превращению воды в газ Брауна. У каждой пластины активная зона находится сразу с обеих сторон, что не может не быть положительной стороной данного прибора. Пластины подсоединяются к сети так, чтобы заряды пластин чередовались. 2 герметично сжатые с резиновой прокладкой и имеющие разные заряды пластины образуют 1 электролитическую ячейку. В оргстекле будут сделаны 2 отверстия так, как они расположены на пластинах. Нижнее - для поступления жидкости, верхнее – для отвода газа. С помощью специальных фитингов соединяем шланги с оргстеклом, потом этими шлангами соединяем бак, в котором будет та часть раствора, которая не поместится в электролизер. У этого бака есть и еще несколько ролей, где одна из них - осушение газа. При процессе электролиза, интенсивность газообразования может быть такая, что раствор начнет пениться, а пена, в свою очередь, может попасть в огнеупорный клапан – это раз, и это является одним из опасных исходов; пена может погасить пламя – это два, это достаточно неприятное событие. Стоит учитывать еще то, что некоторая часть воды в растворе, при электролизе, будет испаряться, а как мы знаем, водяной пар не горюч, он будет лишь мешать. Так же, без данного бака было бы сложно добиться удобства и практичности данного электролизера. Осушение газа мы добиваемся тем, что шланг вывода газа соединяем с бачком, но так, что бы шланг был выше уровня раствора в бачке. Данное техническое решение помогает еще тем, что во всей системе нормализует давление, иначе, если бы не делал равным давление во всей системе, газ бы вытолкнул раствор из электролизера, что сильно бы сказалось на производительности. Для большей безопасности, что бы предотвратить взрывоопасное возгорание горючей смеси в системе, можно подключить еще один резервуар, в котором шланга входа газа будет погружена в воду, а выход на крышке этого резервуара. Уже после этого резервуара будет соединяться огнеупорный клапан, но чем больше деталей, чем больше мест соединений, тем сложнее добиться максимальной герметичности, тем больше шансов, что что-нибудь выйдет из строя. К тому же крепость всей системы определяется самым слабым звеном, поэтому стоит хорошо подумать: стоит включать в цепь дополнительное звено или не стоит. Когда вся система собрана, очень важно проверить ее на герметичность, и выдержит ли она давление выше 1 атм. Почему именно такое давление? Из параметров огнеупорного клапана ясно, что минимальное парциальное давление газа должно быть не меньше 1 атм., иначе газ не сможет просочиться сквозь этот клапан. Описание процесса работыНам удалось собрать электролизер, описанный выше. А теперь давайте рассмотрим, как будет происходить вес процесс превращения воды в горючую смесь Брауна: Сначала нам нужно замешать 15% раствор гидроксида натрия и залить в бачок. Раствор залить можно единожды, а потом подливать чистую воду, это понятно из главы 1, где я сказал, что натрий и гидроксильная группа никуда из электролизера не девается. Конечно, спустя много времени рабочего состояния электролизера стоит сливать раствор и промывать аппарат, но это делать не обязательно. Залив в бачок раствор, нужно немного подержать бочок в открытом состоянии, чтобы раствор мог наполнить ячейки электролизера. Как только ячейки наполнятся, плотно закрываем крышку бака. Дальше нужно лишь включить электролизер в сеть, и можно становиться наблюдателем сего процесса превращения воды в горючую смесь водорода и кислорода. Как только электролизер будет включен в сеть, начнут появляться меленькие пузырьки на пластинах, а спустя время уже каскад таких пузырьков устремится вверх. Конечно, как я говорил выше, от такого количества пузырьков начнет образовываться пена, но дальше бака ейв систему не попасть. Газ, минув бак с раствором, по шлангам попадет резервуар с водой, и, уже пузырями крупнее, начнет всплывать к огнепреградительному клапану. Давление газа со временем будет подниматься, и, как давление станет больше 1 атм., горючая смесь минует этот клапан. Поднеся источник огня к струе газа, можно будет узреть небольшое сине-голубое пламя, которое, кажется холодное, но имеет температуру больше 2000⁰С. Именно так горит кислородно-водородная смесь, газ Брауна. ПриложенияХарактеристика водорода как топлива (Таблица1.1)  Физические свойства водорода (таблица 1.2)
Ряд активностей металлов, катионов (Таблица 2.1)  Ряд активностей анионов растворов (Таблица 2.2)  Структура свободных пламен  Электролитические ячейки (активная зона электролизера)  Резиновая прокладка  Металлическая пластина (электрод)  Огнепреградительный клапан  Бачек  Емкость для максимальной безопасности   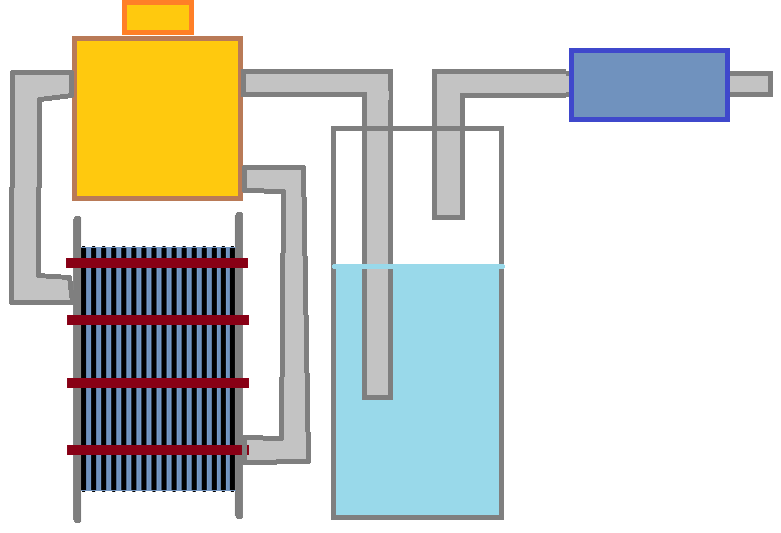 | ||||||||||||||||||||
