Вопросы, задание. Вопросы металлы. Общая характеристика
 Скачать 0.91 Mb. Скачать 0.91 Mb.
|
|
ВОПРОСЫ 1.Металлы. Общая характеристика. Металлы – это химические элементы, атомы которых отдают электроны внешнего электронного слоя, превращаясь в катионы. I,II,III группы Периодической системы, а также побочные подгруппы остальных групп включают только Ме (кроме Н и В). В остальных группах главных подгруппах металлы отделены диагональю В – At. Ме имеют сравнительно большие R(радиус) и малое число ẽ(электроны) (от 1 до 3) на внешнем слое. Исключение составляют 6 Ме: германий Ge, олово Sn, свинец Pb – 4ẽ, сурьма Sb, висмут Bi – 5ẽ, полоний Ро – 6ẽ. Для атомов Ме характерны исключительно восстановительные свойства (т.е. способность отдавать ẽ и превращаться в катионы +). Группы I …. VIII  Закономерности изменения свойств Ме. Закономерности изменения свойств Ме.  В периоде: - заряды ядер атомов увеличиваются; R атомов уменьшаются; число ẽ на внешнем слое увеличивается; электроотрицательность возрастает; восстановительные свойства уменьшаются; Ме свойства ослабевают. Тип химической связи в молекулах Ме – металлическая хим связь. Металлическая связь – это связь в Ме и сплавах между атом-ионами Ме, расположенными в узлах кристаллической решетки, которая осуществляется обобществленными валентными ẽ. Физические свойства Металлический блеск. Высокая отражательная способность в видимой части спектра. Непрозрачны даже в очень тонких слоях. Плотная структура. Пластичность, ковкость. Структуры металлов нежесткие, сдвигаются друг относительно друга (кроме Sb, Bi). Высокие тепло- и электропроводность. Классификация 1. По удельной плотности (тяжелые, легкие) 2. По температурам плавления (тугоплавкие, легкоплавкие) 3.По твердости (самый мягкий – Li, самый твердый – Cr). По химическим свойствам благородные(Ag, Au, Pt, Os, Ir, Ru, Pd, Rh) щелочные ( I группа главная подгруппа) щелочно-земельные (Ca, Sr, Ba, Ra) редкоземельные ( Sc, Y, La и лантаноиды, Ac и актиноиды). ЭЛЕКТРОХИМИЧЕСКИЙРЯДНАПРЯЖЕНИЙМЕТАЛЛОВ Li K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb (H2) Cu Hg Ag Pt Au Чем левее Ме, тем он более сильный восстановитель Каждый Ме способен вытеснять (восстанавливать) Ме, который стоит правее (аналогично вытесняет Н из кислот) Ме щелочные и щелочно-земельные в водных растворах реагируют прежде всего с водой 2. Неметаллы. Общая характеристика. Неметаллы – химические элементы, атомы которых принимают электроны для завершения внешнего энергетического уровня, образуя при этом отрицательно заряженные ионы. Электронная конфигурация валентных электронов неметаллов в общем виде — ns2np1−5 Исключение составляют водород (1s1) и гелий (1s2), которые тоже рассматривают как неметаллы. Неметаллические свойства элементов определяются способностью атомов «принимать» электроны, т.е. проявлять при взаимодействии с атомами других элементов окислительные свойства. Из всех элементов неметаллическими свойствами обладают 22 элемента, остальные элементы характеризуются металлическими свойствами. Ряд элементов проявляет амфотерные свойства. Физические свойства Элементы-неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях: • газы (благородные газы: He, Ne, Ar, Kr, Xe, Rn;водород H2, кислород O2, азот N2, фтор F2, хлор Cl2.), • жидкость (бром Br2) , • твердые вещества ( йод I2, углерод C, кремний Si, сера S, фосфор P и др. ) . Атомы неметаллов образуют менее плотно упакованную структуру чем металлы, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электричество, не обладают пластичностью. Химические свойства 1. Окислительные свойства неметаллов проявляются при взаимодействии с металлами 4Al + 3C = Al4C3 2. Неметаллы играют роль окислителя при взаимодействии с водородом H2 + F2 = 2HF 3 Любой неметалл выступает в роли окислителя в реакциях с теми металлами, которые имеют низкую ЭО 2P + 5S = P2S5 4. Окислительные свойства проявляются в реакциях с некоторыми сложными веществами CH4 + 2O2 = CO2 + 2H2O 5. Неметаллы могут играть роль окислителя в реакциях со сложными веществами 2FeCl2 + Cl2 = 2FeCl3 6. Все неметаллы выступают в роли восстановителей при взаимодействии с кислородом 4P + 5O2 = 2P2O5 7. Многие неметаллы выступают в роли восстановителей в реакциях со сложными веществами-окислителями S + 6HNO3 = H2SO4 + 6NO2 + 2H2O 8. Наиболее сильные восстановительные свойства имеют углерод и водород ZnO + C = Zn + CO; CuO + H2 = Cu + H2O 9. Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления-самовосстановления (диспропорционирования) Cl2 + H2O =HCl + HClO Получение неметаллов Способы получения неметаллов отличаются многообразием и специфичностью, общих подходов не существует. Рассмотрим основные способы получения некоторых неметаллов. 1. Получение галогенов. Самые активные галогены – фтор и хлор – получают электролизом. Фтор – электролизом расплава KHF2, хлор – электролизом расплава или раствора хлорида натрия: 2Г- - 2 = Г2. 2. Получение водорода. Основной промышленный способ получения водорода – конверсия метана (каталитический процесс): CH4 + H2O = CO + 3H2. 3. Получение кремния. Кремний получают восстановлением коксом из кремнезема: SiO2 + 2C = Si + 2CO. 4. Получение фосфора. Фосфор получают восстановлением из фосфата кальция, который входит в состав апатита и фосфорита: Ca3(PO4)2 + 3SiO2 + 5C = 3CaSiO3 + 2P + 5CO. 5. Кислород и азот получают фракционной перегонкой жидкого воздуха. 6. Сера и углерод встречаются в природе в самородном виде. 7. Селен и теллур получают из отходов производства серной кислоты, так как эти элементы встречаются в природе вместе с соединениями серы. 8. Мышьяк получают из мышьяковистого колчедана по сложной схеме превращений, включающей стадии получения оксида и восстановления из оксида углеродом. 9. Бор получают восстановлением оксида бора магнием. 3.Оксиды (определение, пример). ОКСИДЫ – это сложные вещества, состоящие из двух элементов, одним из которых является кислород. Пример: Al2O3, N2O, Fe2O3, PbO2, Na2O, Li2O, S2O3, CO2, Ga2O3, Ag2O, Se2O3, SnO2, P2O5, MgO, B2O3,Cl2O7 4.Кислоты (определение, пример). Кислоты - это сложные вещества, состоящие из одного или нескольких атомов водорода и кислотного остатка. Пример: HCl – хлороводородная кислота; H2SO4 – серная кислота; H3PO4 – фосфорная кислота. 5.Основания (определение, пример). Основания - сложные вещества, молекулы котрых состоят из атома металла и одной или нескольких гидрооксидных групп – ОH. Общпя формула оснований: Me(oh)y Где y – число гидрооксидных групп, равное валентности металла Me. Примеры оснований: NaOH, Ca(OH)2, Co(OH)3 6.Соли (определение, пример). Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков. Пример: BaSO4, K3N, NA3PO4 7. Теория хим. строения органических соединений А.М. Бутлерова. 1. Все атомы в молекуле органического соединения связаны друг с другом в определенной последовательности в соответствии с их валентностью. Изменение последовательности расположения атомов приводит к образованию нового вещества с новыми свойствами. 2. Свойства веществ зависят от их химического строения. Химическое строение – это определенный порядок в чередовании атомов в молекуле, во взаимодействии и взаимном влиянии атомов друг на друга – как соседних, так и через другие атомы. Изменение строения вещества приводит к явлению изомерии. 3. Атомы в молекуле оказывают взаимное влияние друг на друга вне зависимости от их расположения 4. Химическое строение вещества можно установить по его химическим и физическим свойствам. По строению вещества можно судить о его химических или физических свойствах. 8.Углеводороды (определение, классификация). Углеводороды - это органические вещества, молекулы которых состоят из атомов углерода и водорода. Классификация  9.Природные источники углеводородов Основными природными источниками углеводородов являются природный и попутный нефтяной газы, нефть и каменный уголь. 10.Кислородсодержащие орг. соединения (классификация) Кислородсодержащие органические соединения – соединения, в состав которых входят атомы углерода, водорода и кислорода. Свойства кислородсодержащих органических веществ очень разнообразны, и они определяются тем, в состав какой группы атомов входит атом кислорода. 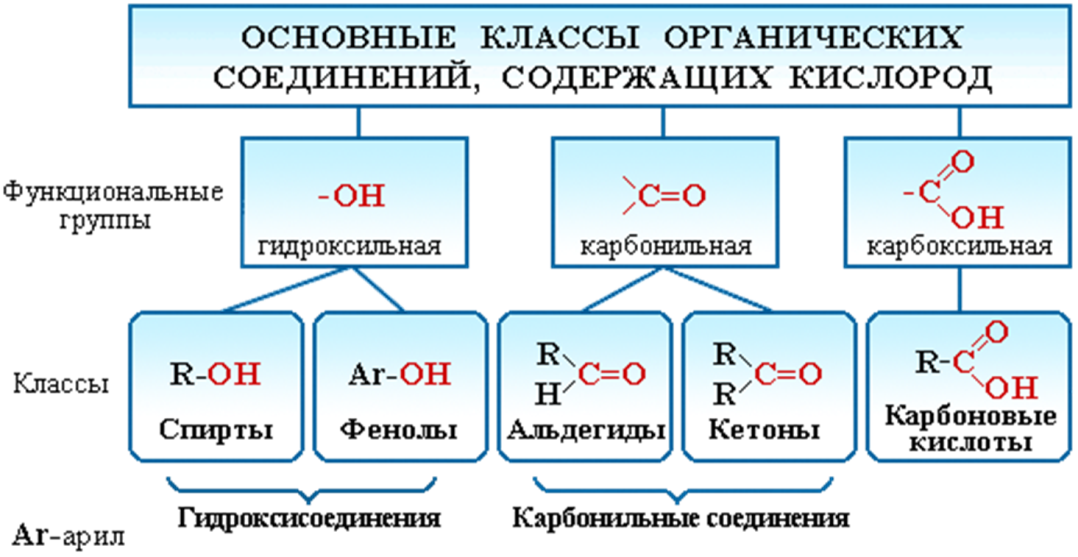 11.Азотсодержащие орг. соединения (классификация). Азотсодержащие органические соединения весьма обширный класс органических соединений, в состав которых входит ковалентно связанный азот. Азот в них может быть связан как с углеродом (например, в аминах), так и входить в состав функциональных групп, связанных с углеродом другим гетероатомом (например, нитроэфиры).  12.Полимеры: пластмассы и волокна (определение, примеры). Пластмассы - это материалы, полученные на основе полимеров, способные приобретать заданную форму при изготовлении изделия и сохранять ее в процессе эксплуатации Волокна - это полимеры линейного строения, которые пригодны для изготовления нитей, жгутов, пряжи и текстильных материалов Пластмасса содержит: полимер (самый важный компонент); красители (придают материалу цвет); наполнители (обеспечивают жесткость пластмассы); пластификаторы (делают материал более эластичным, гибким) и др. Пример: Полиэтилен (пластиковые бутылки и листы); Полистирол (популярный упаковочный материал); Полипропилен (пластиковые трубы, тросы); Поливинилхлорид (игрушки, кредитные карты); Поликарбонат (твердые пластиковые окна, корпуса автомобильных фар); Полиамид (нейлон - используется в самых разных применениях, от чулок до зубных щёток и зонтиков). Капрон Лавсан Найлон ЗАДАНИЯ 1.Определить класс неорганических веществ по формуле и назвать вещества: Н2SO4, FeO, CaCO3, Al(OH)3. Н2SO4 – серная кислота, неорганическая кислородсодержащая двухосновная кислота; FeO - оксид железа, оксид CaCO3 - карбонат кальция, соль Al(OH)3 - гидроксид алюминия, основание 2.Разделить элементы на металлы и неметаллы: барий Ba, фтор F, ртуть Hg, мышьяк As, хром Cr, ванадий V, галлий Ga, бор B, марганец Mn, cера S.
3.Разделить вещества на органические и неорганические: поваренная соль, пластмасса, уксусная кислота, гипс, нефть, йод, ацетон, сода, белок куриного яйца, сталь, свиной жир, метан, крахмал, марганцовка.
4.Определить класс (алканы, алкены, алкины, алкадиены, арены, спирты, фенолы, альдегиды, кетоны, карбоновые кислоты, эфиры, углеводы, амины, аминокислоты) органических веществ по формуле:
|
