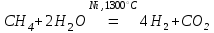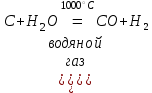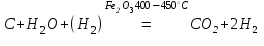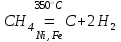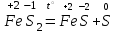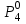Лекция4 по химии. Общий обзор неметаллов положение неметаллов в периодической системе элементов
 Скачать 194.84 Kb. Скачать 194.84 Kb.
|
|
ОБЩИЙ ОБЗОР НЕМЕТАЛЛОВ Положение неметаллов в периодической системе элементов. К неметаллам относятся p-элементы и s-элемент - водород.  Валентными являются электроны внешнего уровня s- и p-подуровней. Общее число их соответствует номеру группы, в которой расположен элемент. Для неметаллов второго периода максимальная валентность равна четырем (т.е. не всегда соответствует номеру группы), т.к. на внешнем уровне 2p-элементы имеют всего четыре орбитали. Для неметаллов третьего периода максимальная валентность соответствует номеру группы, т.к. у атомов 3p-элементов на внешнем уровне есть свободный d-подуровень, поэтому при возбуждении атомов электроны s- и p-подуровней могут переходить на свободный d-подуровень. Неметаллы в элементарном состоянии находятся в промежуточной степени окисления, поэтому они проявляют как окислительные, так и восстановительные свойства (исключение фтор и кислород), а следовательно, как отрицательные, так и положительные степени окисления. Высшая положительная степень окисления соответствует номеру группы (исключение кислород и фтор), а отрицательная минимальная - определяется по разности (№ - 8), где № - номер группы. В периодах с увеличением порядкового номера у р-элементов уменьшаются радиусы атомов, увеличивается число электронов на внешнем уровне и возрастает электроотрицательность. Поэтому в этом же направлении уменьшается восстановительная и усиливается окислительная способность атомов. В группах у p-элементов с увеличением порядкового номера радиусы атомов увеличиваются, электроотрицательность уменьшается, поэтому усиливаются восстановительные свойства и ослабевают окислительные. Ниже указаны степени окисления атомов неметаллов второго и третьего периодов, которые они реально проявляют в соединениях.
Получение неметаллов Некоторые неметаллы в природе встречаются как в свободном виде, так и в виде соединений (кислород, азот, сера, углерод), другие только в виде соединений. Получение неметаллов рассматривают в лабораторных и промышленных условиях.
Физические свойства неметаллов Молекулы галогенов, кислорода, азота и водорода состоят из двух атомов. Водород, азот, кислород, фтор и хлор представляют собой газы, бром - жидкость, остальные неметаллы твердые вещества. Некоторые неметаллы (углерод, кремний, фосфор, сера) способны образовывать цепи из одинаковых атомов. Например, углерод образует цепи практически неограниченной длины, кремний - не длинные (6 атомов). А такие неметаллы, как сера, углерод, кремний, фосфор, кислород, образуют аллотропные модификации (фосфор - белый, красный и черный; углерод - алмаз, графит, карбин, фуррелен). В V - VII группах сверху вниз растет плотность, повышается температура кипения и плавления неметаллов. В воде нерастворимы или малорастворимы. Фтор в воде растворять нельзя, так как он бурно реагирует с водой. Некоторые из них (галогены, сера) лучше растворяются в органических растворителях, а белый фосфор - в сероуглероде. Неметаллы имеют различную окраску, при этом в группах сверху вниз окраска усиливается. Фтор - светло-зеленый газ, а хлор - желто-зеленый, бром - красно-бурая жидкость, йод - темно-фиолетовые кристаллы. Кремний, черный фосфор обладают полупроводниковыми свойствами, а графит – тепло- и электропроводностью. Химические свойства неметаллов Неметаллы в элементарном состоянии находятся в промежуточной степени окисления; поэтому они могут выступать в окислительно-восстановительных реакциях как в роли окислителя, так и в роли восстановителя (исключение фтор и кислород) в зависимости от того, с каким веществом они вступают во взаимодействие, а также возможны реакции диспропорционирования, т.е. в общем виде можно представить следующей схемой (Э - неметалл):  Окислительно-восстановительная двойственность характерна и для водорода:  Этим и объясняется двойственное положение водорода в периодической системе элементов (в I и VII группах). | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||