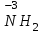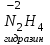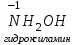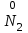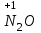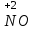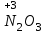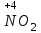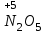Лекция4 по химии. Общий обзор неметаллов положение неметаллов в периодической системе элементов
 Скачать 194.84 Kb. Скачать 194.84 Kb.
|
|
Фтороводород получают по реакции CaF2+H2SO4→CaSO4+2HF, молекулы HF существуют только в газообразном состоянии при высокой температуре, а в обычных условиях молекулы HF представляют собой ассоциаты, соединены между собой водородными связями F─F•••F─F•••F─F. Водный раствор HF называется фтороводородной (плавиковой) кислотой. Соли HF называются фториды. Соли подвергаются гидролизу, образуя щелочную среду: NaF+H2O→NaОН+НF NaF и гаксафторосиликат натрия Na2[SiF6] –очень токсичны, используются для борьбы с вредными насекомыми и для консервирования древесины. Полимер (-CF2-CF2-)n известен под названием тефлон. Тефлон обладает очень высокой химической стойкостью, электроизоляционными свойствами и малым коэффициентом трения. ФреоныCCl2F2, охлаждающие жидкости, используют в холодильной технике. Особенности соединений хлора: Cl2 реагирует: – с водой: Cl2+H2O→HClO+HCl. Эта смесь называется «хлорная вода», обладает отбеливающим действием, так как HClO разлагается с образованием атомарного хлора: HClO→HCl+O – со щелочами: 2KOH(холодный)+Cl2→KCl+KClO+H2O –эта смесь называется "жавелевая вода", оказывает отбеливающее действие, т.к. углекислый газ вытесняет из гипохлорита калия KClO хлорноватистую кислоту HClO: KClO+CO2+H2O→KHCO3+HClO 6KOH(горячий)+Cl2→KClO3+5KCl+3H2O. KClO3 .-называется бертолетова соль, хлорат калия. 2 Cl2+Ca(OH)2(сухая)→CaCl2+Ca(OCl)2+2H2O. CaCl2+Ca(OCl)2-хлорная «белильная» известь. Ca(OCl)2 +2НСl→ CaCl2+ Cl2+H2O Ca(OCl)2+CO2+H2O→CaCO3+2HClO – с органическими веществами: CH4+Cl2→CH3Cl+HCl CH3Cl+Cl2→CH2Cl2+HCl и т. д. - вытесняет бром и йод из растворов: Cl2+2KBr→2KCl+Br2 Cl2+2KI→2KCl+ I2 Хлор образует следующие кислородосодержащие кислоты:  Усиление кислотных свойств; повышение устойчивости 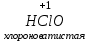 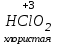  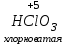 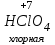 Усиление окислительной способности  Соли приведенных кислот называются соответственно так: гипохлориты, хлориты, хлораты и перхлораты. Применение хлора и его соединений. Хлор используется для получения HCl, для отбеливания тканей, бумаги, для обеззараживания питьевой воды, для производства многих веществ. В организме человека содержание хлора составляет примерно 100г. Хлорид-ионы активируют некоторые ферменты, создают благоприятную среду для действия протолитических ферментов желудочного сока, обеспечивают ионные потоки через клеточные мембраны. HCl входит в состав желудочного сока (рН желудочного сока равен 1,7). NaCl-пищевая приправа, в пищевой промышленности используется для консервирования, а также является сырьём для получения Cl2, Na2CO3, HCl, NaOH. КCl-ценное калийное удобрение; ВаСl2∙2Н2О – инсектицид, НgСl2-сулема, применяется для протравливания семян, для дезинфекции; АgСl-применяется в фотографии; NaClO3, Mg(ClO3)2,. Ca(ClO3)2-гербициды сплошного действия. НС1 – продукт многотоннажного производства хим. Промышленности. Перхлораты. Термин пестициды – пестия – разрушающий, цид – убивать – объединяет вещества, токсичные для вредных организмов и применяемые для защиты растений от насекомых, вредителе, возбудителей болезни и сорняков. Должны быть высоко токсичные для вредителей, возбудителей болезни, но практически безвредные для культурных растений, с/х животных и человека. Некоторые особенности халькогалогенов и их соединений Получение серы. Промышленность выпускает несколько видов серы: а) комовую-неочищенную; б) серный цвет-очищенная; в) черенковая сера-размолотая комовая; г) коллоидная –мелкозернистая специально для с/х, при смешивании с водой дает устойчивую суспензию для опрыскивания растений. Важным источником получения серы служит железный колчедан FeS2 или пирит, и полиметаллические руды. Некоторое количество серы получают из газов, образующихся при коксовании и газификации угля. Физические свойства серы. При обычных условиях сера – твердое кристаллическое вещество желтого цвета с t пл. 112,8ºC. Она нерастворима в воде, но довольно хорошо растворяется в сероуглероде CS2, бензоле, и других жидкостях, плохо проводит теплоту и электричество. Сера образует несколько аллотропических видоизменений. Аллотропия серы обусловлена различным строением молекул серы, т.е. неодиноковой структурой кристаллов. Определение молекулярной массы серы по Δt замерзания ее растворов в бензоле приводит к заключению, что молекулы серы состоят из восьми атомов(S8). Кристаллы ромбической и моноклинной серы построены из таких молекул S8, имеющих кольцевое строение. В кристаллах серы молекулы S8 имеют кольчатое строение, при нагревании кольцевые молекулы разрываются и образуются молекулы с открытой цепью атомов. Расплавленная сера состоит из молекулы S8, S6, пары серы содержат молекулы S6, S4 , S2 . Если расплавленную и нагретую почти до кипения серу быстро охладить ( вливая струей в холодную воду), получается коричневая резиноодобная масса-пластическая сера. При температуре выше 1700ºС пары серы состоят из атомов S. Химические свойства серы. Сера активно взаимодействует со многими металлами, образуя сульфиды с выделением большого количества теплоты. 2AL + 3S2 = Al2S3 ; Zn + S = ZnS; реагирует и с нескоторыми неметаллами : S+O2 = SO2 ( горит синим пламенем); с водородом ( при нагревании) с галогенами: S+3F2 = SF6 -реагирует с HNO3 : S + 2HNO3 = H2SO4 + 2NO. Сероводород. Сульфиды. С водородом сера образует ряд соединений, имеющих общую формулу H2Sx – H2S2 H2S2 ; H2S3 ;H2S5 и т.д. Важнейшее водородное соединение серы-сероводород – H2S, в котором сера проявляет степень окисления –2. H2 + S ↔ H2S + Q Однако реакция обратима и неудобна для практических целей. В лаборатории H2S получают действием на сульфид железа разбавленной HCl или H2SO4 . FeS + 2HCl = H2S↑+ FeCl2 FeS + 2H = H2S↑ + Fe² Сероводород - бесцветный газ с характерным неприятным запахом гниющего белка. Он немного тяжелее воздуха, ядовит и вызывает отравление, т.к.с железом гемоглобина крови образует сульфид железа. На воздухе сероводород горит голубоватым пламенем, образуя диоксид серы и воду : 2H2S + 3O2 = 2SO2 + 2H2O Смеси сероводорода с воздухом взрывают при поджигании. Если внести в пламя сероводорода какой-нибудь холодный предмет, то температура пламени значительно понижается и H2S окисляется только до свободной серы : 2H2S + O2 = 2S + 2H2O. При 20ºС один объем воды растворяет 2, 5 объема сероводорода. Раствор сероводорода в воде называется сероводородной водой. Раствор H2S в воде обладает свойствами кислоты, ведет себя как слабая двухосновная кислота, которая диссоциируется в две ступени : α в 0, 1 Н раствора 0,07%. В основном по I ступене H2S↔ H + HS ( K1= 5,7 ·10 ) По второй в ничтожно малой: HS↔ H + S ( K2 = 1,2 ·10) Сероводород –сильная сильный восстановитель, может окисляться до свободной серы, двуокиси и трехокси серы. 2KMnO4 + 5H2S + 3H2SO4 = 5S↓+2MnSO4 + K2SO4 + 8H2O с хлором : H2S +Сl2 = 2HCl +S ↓ (аналогично с бромом и иодом). Средние соли сероводорода называются сульфидами. Их можно получать:: Взаимодействием H2S с гидроксидами : H2S+2NaOH = Na2S + H2O Действием H2S на растворы солей : H2S + СuCl2= ↓CuS+HCL H2S + Cd(NO3)2 = ↓CdS+2HNO3 H2S+ZnSO4= ↓ZnS+H2SO4 Непосредственным соединением металлов с серой: Fe+S=FeS Сульфиды тяжелых металлов малорастворимы в воде, имеют характерную окраску-ZnS- белый, CuS-черный, MnS-телесный, CdS-желтый, HgS-красный. Благодаря этому они используются в аналитической химии в качественном анализе. Кислородные соединения серы. У серы несколько соединений с кислородом, но важнейшие из них- оксид серы (IV) SO2 и оксид серы (VI) SO3. Диоксид серы-сернистый ангидрид образуется при сжигании серы на воздухе или кислороде : S+O2=SO2 Но в лаборатории получают действием HCl на сульфиды : Na2SO3+2HCl=2NaCl = H2O+SO2 Или взаимодействием концентрированной H2SO4 c Cu : 2H2SO4 +Cu=CuSO4 +2H2O+SO2↑ В промышленности SO2 получают обжигом пирита: 4FeS2+11O2=8SO2 ↑+2Fe2O3 Диоксид серы-бесцветный газ, с резким запахом горящей серы. Он ядовит. Диоксид серы хорошо растворяется в воде (около 40 объемов в 1 объеме воды при 20ºС) при этом частично происходит реакция с водой и образуется сернистая кислота : SO2 + H2O ↔H2SO3 Поскольку сера в степени окисления +4 может терять 2е и присоединять 6е, то оксид серы (IV) в одних реакциях ведет себя как восстановитель, а в других как окислитель. SO2 + 2H2S =3S↓ +2H2O SO2 + I2 +2H2O=2HI+H2SO4 SO2- окислитель SO2– восстановитель Применение. SO2 обесцвечивает органические пигменты и его применяют для отбеливания шелка, шерсти, соломы. SO2 окуривают склады, подвалы и тару для уничтожения плесневых грибов, а в ветеринарии –окуриваение животных против чесотки. Сернистая кислота. H2SO3 – очень непрочное соединение. Известна только в водных растворах. При попытках выделить H2SO3 она разлагается на SO2 и воду. Сернистая кислота-средней силы, двухосновная. H2SO3 на воздухе, поглощая кислород, медленно окисляется в серную кислоту : 2H2SO3 +O2 =2H2SO4 H2SO3 – хороший восстановитель. Свободные галогены восстанавливаются ею в галогеноводороды. H2SO3 + Сl2 +H2O = 2HCl +H2SO4 2KMnO4 +5H2SO3 = 2MnSO4 +K2SO4 +2H2SO4 +3H2O K2CrO7 +3H2SO3 +4H2SO4 =Cr2(SO4)3 +K2SO4 +4H2O+3H2SO4 H2SO3 образует два ряда солей. Средние-сульфиты, кислые-гидросульфиты. Серная кислота. Оксид серы VI является ангидридом серной кислоты. Жадно соединяясь с водой, образует серную кислоту: SO3+H2O=H2SO4+88кДж/моль H2SO4 – тяжелая, бесцветная, маслянистая жидкость, кристаллизующаяся при t –10,4ºС. Продажная H2SO4 имеет d=1,84 г/см и содержит 96% H2SO4. Различают несколько сортов серной кислоты: 1.купоросное масло, т.к.получали из железного купороса – 96,5% H2SO4 2. моногидрат – SO3 ·H2O – 100% H2SO4 олеум –раствор SO3 в 100% H2SO4 - H2SO4 ·SO3 при хранении H2SO4 +SO3 =H2S2O7 – пиросерная кислота С водой серная кислота образует гидраты, раствор разогревается . Конц. H2SO4 жадно поглощает пары воды и отнимает воду от углеводов (сахара, клетчатки), обугливая эти органические вещества. C12H22O4 –конц.-------->12C + 11H2O, но H2SO4 сильный окислитель. С +2H2SO4 =CO2↑+2H2O↑+2SO2 вся масса вспучивается Концентрированная H2SO4 , особенно горячая-сильный окислитель. Она окисляет HI и HBr до свободных галогенов: 8HI+ H2SO4 = 4I2 +H2S+4H2O 2HBr + H2SO4 =Br +SO2 +2H2O уголь до CO2 : C+2H2SO4 = CO2+2SO2 +2H2O, серу до SO2 : S+2H2SO4 = 3SO2 + 2H2O Серная кислота взаимодействует с основаниями, оксидами, солями. Купоросы . Так называются сульфаты меди, железа, цинка и никеля, содержащие кристаллы. CuS04 ·5H20 – применяется в сельском хозяйстве для борьбы с болезнями сельскохозяйственных культур, и протравлении семян. FeS04 ·7H20 – для борьбы с сельскими вредителями, для консервированного дерева, чернил, Na2S04 ·10H20 – используют для приготовлении стекла, в медицине, ветеринарии. K2S04 –калийное удобрение. CaS04 ·2H20- гипс, применяется для гипсования засоленных почв в целях их улучшения. 2СaS04 · H20- алебастр-в строительстве, медицине, стоматологии, архитектуре. Некоторые особенности атома азота и его соединений А 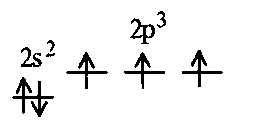 зот - элемент пятой группы главной подгруппы. Валентные электроны расположены на внешнем энергетическом уровне -1s2 2р3 У атома азота три неспаренных электрона, следовательно, азот трехвалентен за счет неспаренных электронов. Вследствие отсутствия d-подуровня на втором уровне атом азота не может переходить в возбужденное состояние. Поэтому азот не проявляет валентность равную пяти. Однако, как и все элементы второго периода, атом азота на внешнем уровне имеет четыре валентных орбитали: одну и три р-орбитали, поэтому он может быть четырехвалентным. Четвертая валентность обусловлена двухэлектронной орбиталью (см донорно-акцепторный механизм образования связи). В молекуле N2 атомы азота связаны тройной связью: одна  - и две π-связи (рис. ) - и две π-связи (рис. )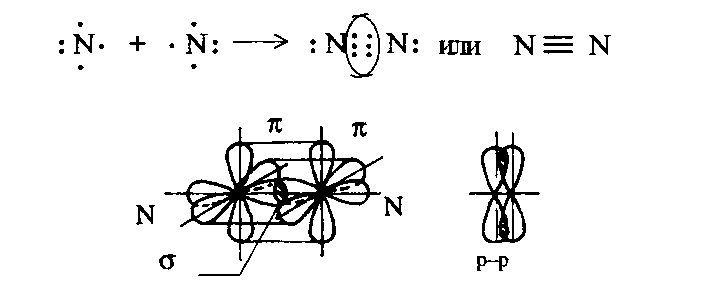 Схема образования π -связи Рис. . 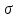 и π - Связи в молекуле азота и π - Связи в молекуле азотаЭнергия связи в молекуле N2 равна ≈942 кДж/моль. Это самая прочная связь среди двухатомных молекул. Даже при 3300 °С только одна из тысяч молекул N2 распадается на атомы. Поэтому свободный азот в обычных условиях инертен к большинству веществ и в реакции вступает только при высоких температурах, облучении или действии катализатора. Из металлов свободный азот реагирует в обычных условиях только с литием, образуя нитрид: 6Li+ N2= 2Li3N Атомарный азот - активный неметалл. Его электроотрицательность (3,07) уступает только кислороду и фтору. На внешнем энергетическом уровне атома азота находятся пять электронов, поэтому в соединениях он способен проявлять степени окисления от -3 до +5. Степени окисления в соединениях
|