Лекция4 по химии. Общий обзор неметаллов положение неметаллов в периодической системе элементов
 Скачать 194.84 Kb. Скачать 194.84 Kb.
|
При непосредственном взаимодействии азота с кислородом образуется только оксид азота (II): 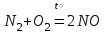 другие оксиды получают косвенным путем. Электронная и графическая формула молекулы HNO3 В молекуле азотной кислоты атом водорода связан с атомом кислорода ковалентной связью: Атом кислорода за счет второго неподеленного электрона образует ковалентную связь с атомом азота: Два неспаренных электрона атома азота образуют две ковалентные связи со вторым атомом кислорода: Видим, что у атома азота сохранилась неподеленная пара электронов, поэтому азот способен образовать еще одну (четвертую) ковалентную связь по донорно-акцепторному механизму. В молекуле HNO3 акцептором электронной пары атома азота является третий атом кислорода, переходящий в возбужденное состояние, в котором он обладает свободной 2p-орбиталью. В данном случае возбуждение атома выражается не в распаривании электронов, а в переходе неспаренного электрона на орбиталь, занятую другим неспаренным электроном: 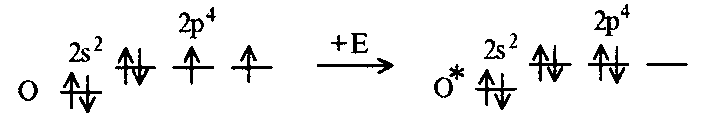 Таким образом, получаем следующую электронную и графическую схему молекулы HNO3: 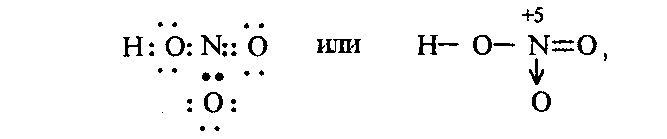 где стрелкой обозначена связь, образованная по донорно- акцепторному механизму. Итак, валентность азота в молекуле HNO3 равна четырем, а степень окисления - пяти. Распределение электронов в молекуле HNO3 можно более точно передать следующей схемой: П 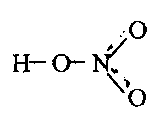 унктирные линии означают, что одна из общих. электронных пар принадлежит не двум, а трем атомам - атому азота и двум атомам кислорода, образованная ею связь является не двухцентровой, а трехцентровой. унктирные линии означают, что одна из общих. электронных пар принадлежит не двум, а трем атомам - атому азота и двум атомам кислорода, образованная ею связь является не двухцентровой, а трехцентровой.Аналогичны электронная и графическая формулы N2O5 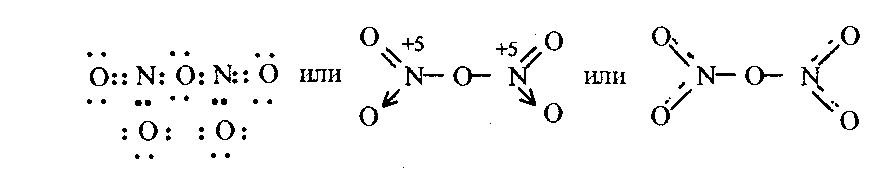 А 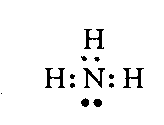 ммиак - NH3. Электронная формула молекулы аммиака: Видно, что у атома азота одна неподеленная пара электронов. Получение аммиака. В лаборатории NH3 получают слабым нагреванием хлорида аммония с гидроксидом кальция: 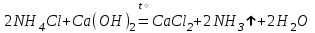 В промышленности - синтезом из азота и водорода: Физические свойства. Аммиак - бесцветный газ, легче воздуха, с резким запахом, сжижается при -33,35 °С, затвердевает при -77,7 °С. Хорошо растворим в воде (700 объемов в одном объеме воды), в спиртах, бензоле, ацетоне. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. Химические свойства. I. Реакция присоединения протекает благодаря неподеленной паре электронов в молекуле NH3. Например, образование иона аммония путем присоединения иона водорода к молекуле NH3. 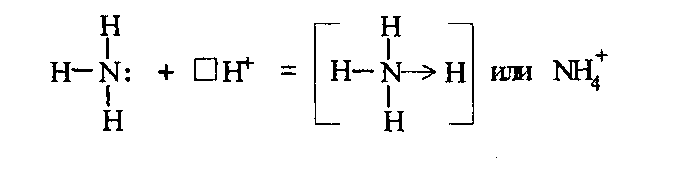 Аммиак взаимодействует: 1 - с водой: NH3 + HOH<=>NH3 · Н2O<=>NH4+ +ОН¯ 2-c кислотами, образуя соли аммония: NH3 + НСl = NH4Cl С многоосновными кислотами аммиак образует средние (а) и кислые (б) соли: a) 2NH3 + H2SO4 = (NH4)2SO4 б) NH3 + H2SO4 = NH4HSO4 II. В окислительно-восстановительных реакциях аммиак - активный восстановитель. Аммиак окисляется (горит) кислородом без катализатора до азота: 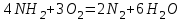 В присутствии катализатора окисление идет до NO: 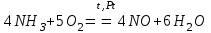 При нагревании аммиака с Cl2, Вr2, Н2O2 образуется азот: 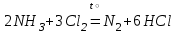 ; ;  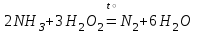 Аммиак восстанавливает некоторые металлы из их оксидов: 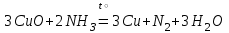 Соли аммония. 1. В водном растворе гидролизуются: 2 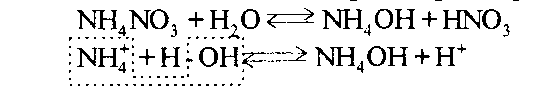 . При нагревании разлагаются: Если в состав соли входит анион, который проявляет резко выраженные окислительные свойства, то разложение идет необратимо, протекает внутримолекулярная окислительно-восстановительная реакция: 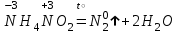 ; ;  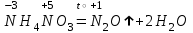 Качественная реакция на 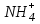 - это реакция взаимодействия солей аммония со щелочами: - это реакция взаимодействия солей аммония со щелочами: Выделяющийся NH3 определяют по запаху или по посинению влажной лакмусовой бумаги. Удобрения, применяемые в сельском хозяйстве Двойной суперфосфат – не содержит CaSO4. Ca3(PO4)2 + 4H3PO4 = 3Ca(H2PO4)2 - содержит 40 – 50% Р2О5 Преципитат CaHPO4*2H2O получают нейтрализацией Н3РО4 Ca(OH)2 до гидрофосфата: Н3РО4 + Са(ОН)2 = СаНРО4*2Н2О Белый, негигроскопичный порошок, содержит 30 – 35% Р2О5. Хорошо усваиваются растениями на кислых почвах. Более перспективны комплексные сложные удобрения. Аммофос – NH4H2PO4 NH3 + H3PO4 = NH4H2PO4 содержит 44% Р2О5 и 11% N2 Диаммофос – (NH4)2HPO4 получают нейтрализацией 2NH3 + H3PO4 = (NH4)2HPO4 содержит 52% Р2О5 и 20% N2 Суперфосфат – NH4H2PO4 + CaHPO4 NH3 + Ca(H2PO4)2 = NH4H2PO4 + CaHPO4 содержит 20% Р2О5 и 23% N2 Нитрофоска – тройное удобрение Содержит NH4H2PO4*NH4NO3*KCl (K2SO4) Томасшлак – Са3(РО4)2*СаО – измельченный шлак. Содержит 10 – 20% Р2О5 |
