Лекция4 по химии. Общий обзор неметаллов положение неметаллов в периодической системе элементов
 Скачать 194.84 Kb. Скачать 194.84 Kb.
|
|
I. Взаимодействие неметаллов с простыми веществами (большинство реакций протекает при нагревании). Как окислители они реагируют с металлами и водородом: 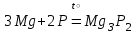 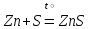 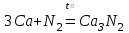 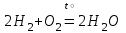 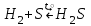 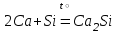 Водород как окислитель реагирует со щелочными и щелочно-земельными металлами: 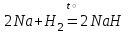 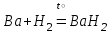 Как восстановители они реагируют с кислородом, фтором: 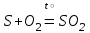  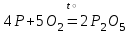 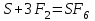 Неметаллы взаимодействуют друг с другом (роль одного неметалла по отношению к другому определяется их электроотрицательностью): 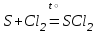 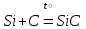 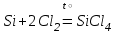 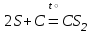 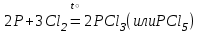 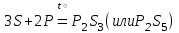 Взаимодействие со сложными веществами. 1. С водой реагируют фтор, хлор: 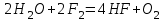 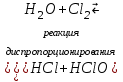 и некоторые другие неметаллы; так, при нагревании с водяным паром углерод вытесняет из воды водород: 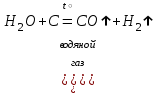 Со щелочами реагируют хлор и сера (реакция диспропорционирования): 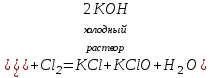 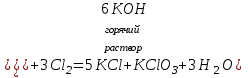 6KOH+3S=2K2S+K2SO3+3H2O Иначе взаимодействует со щелочами кремний: Si + 2NaOH + Н2O = Na2SiO3+ 2Н2↑ С кислотами-окислителями (H2SO4 конц. и HNO3) взаимодействуют углерод, сера, фосфор и др. неметаллы. Концентрированная H2SO4 восстанавливается при этом до оксида серы (IV): 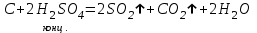 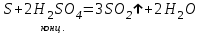 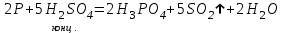 При окислении серы концентрированной H2SO4 в качестве продукта окисления и продукта восстановления образуется оксид серы (IV). Азотная кислота окисляет серу, углерод, фосфор и др. неметаллы до соответствующих кислот, а степень восстановления азотной кислоты зависит от ее концентрации. Концентрированная азотная кислота, как правило, восстанавливается до NO2. Это объясняется тем, что если бы даже в результате реакции образовались низшие оксиды азота, то концентрированная азотная кислота окислила бы их до NO2. Например: NO+ 2HNO3 <=>3NO2+ Н2O 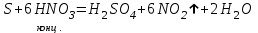 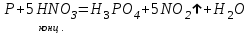 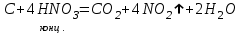 Разбавленная HNO3 восстанавливается до оксида азота (II): 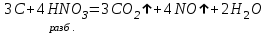 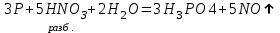 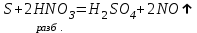 Кремний при обычных условиях взаимодействует со смесью фтороводородной (плавиковой) и азотной кислот (HF + HNO3): 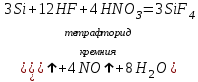 С избытком фтороводородной кислоты тетрафторид кремния образует гексафторокремниевую кислоту H2[SiF6]: SiF4+ 2HF = H2[SiF6] Для углерода и водорода характерно взаимодействие с оксидами: 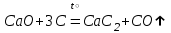 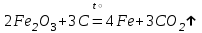 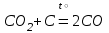 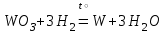 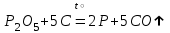 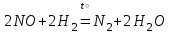 Для галогенов характерно: каждый предыдущий галоген вытесняет последующий из его соединений с металлом или водородом, т.е. фтор вытесняет все остальные галогены, хлор вытесняет бром, йод и т.д. Например: 2КВr + Сl2= 2KCl+ Вr2 Водородные соединения неметаллов С а) 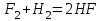 ; ; б)  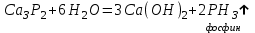 Водородные соединения неметаллов IV группы (СН4, SiH4) не взаимодействуют ни с кислотами, ни с основаниями, практически не растворяются в воде, а V группы - при растворении в воде образуют основания: При растворении в воде водородных соединений неметаллов VI и VII групп (исключение Н2O) образуются соответствующие кислоты (H2S - сероводородная кислота, НСl хлороводородная кислота). Следовательно, в периоде слева направо усиливаются кислотные свойства водных растворов водородных соединений неметаллов, а в группах - сверху вниз (III - самая сильная бескислородная кислота). Химические свойства. 1. В окислительно-восстановительных реакциях водородные соединения неметаллов проявляют ярко выраженные восстановительные свойства, которые обусловлены неметаллом в минимальной степени окисления. Например: СН4 +2O2 = СO2 + 2Н2O; MnO2+4НСl = МnСl2 +Сl2↑ + 2Н2O; К2Cr2О7+ 3H2S + 4H2SO4 = 3S + Cr2(SO4)3 +K2SO4 +7H2O Восстановительные свойства данных соединений усиливаются в периодах справа налево, в группах - сверху вниз (SiH4 - наиболее активный восстановитель, самовоспламеняется на воздухе). Это объясняется тем, что в периодах уменьшение радиуса и увеличение электроотрицательности атомов приводит к возрастанию степени перекрывания электронных облаков элементов с электронным облаком атома водорода. Это вызывает усиление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. к уменьшению длины и увеличению прочности связи, и как следствие, повышение устойчивости водородных соединений и понижение их восстановительной способности. Например, HCl более устойчив, но менее активный восстановитель, чем H2S. А в подгруппах сверху вниз увеличение радиуса и уменьшение электроотрицательности атомов приводит к уменьшению степени перекрывания валентных электронных облаков элементов с электронным облаком водорода. Это вызывает ослабление притяжения ядер взаимодействующих атомов к области перекрывания электронных облаков, т.е. к увеличению длины и ослаблению связи, и как следствие - понижение устойчивости водородных соединений и повышение их восстановительной способности. Например, HCl более устойчив, но менее активный восстановитель, чем HI. Следовательно, HF - самое устойчивое и наименее реакционноспособное соединение. Водородные соединения неметаллов VI и VII групп могут выступать и в роли окислителей за счет водорода в максимальной степени окисления +1: 2Н2O + 2К = 2КОН + Н2↑; 2HCl+Mg= MgCl2+H2↑ Водородные соединения неметаллов вступают в реакции, протекающие без изменения степени окисления: CuSO4 + H2S = CuS↓ + H2SO4; PH3 + HCl = РН4Cl; CaO + Н2O = Ca(OH)2 Кислородные соединения неметаллов Неметаллы в высшей степени окисления образуют оксиды и гидроксиды, которые проявляют кислотные свойства.
Сила кислот в периодах усиливается слева направо, а в группах - снизу вверх (НСlO4 - самая сильная кислородсодержащая кислота). В окислительно-восстановительных реакциях данные соединения могут выступать в качестве окислителей (так как неметаллы имеют высшую степень окисления). На практике в качестве окислителей обычно используют H2SO4 конц. и HNO3 (см действие данных кислот на металлы и неметаллы) Неметаллы с кислородом образуют оксиды и гидроксиды, в которых проявляют промежуточные степени окисления. Данные соединения также обладают кислотными свойствами, но в окислительно-восстановительных реакциях они могут выступать как в роли восстановителей (а), так и окислителей (б): а) 2HNO2 + O2 = 2HNO3; SO2 + Cl2 + 2H2O = H2SO4 + 2HCl; б) SO2 + 2H2S = 3S + 2H2O 2HNO2 + 3HI = I2 + 2NO↑ + 2H2O Некоторые особенности галогенов и их соединений Название галогены означает «солерождающие». Фтор, хлор и йод - относятся к жизненно важным элементам. Однако использование галогенов и их соединений в сельскохозяйственном производстве невелико по сравнению с промышленностью невелико. Галогены были открыты: F 2 в 1886г электролизом KF в жидком HF (Муассон, Франция); Cl2 в 1774г (Шееле, Швеция); Br2 в 1826г в морской воде (Балар, Франция); I2 в 1811г в золе морских водорослей (Куртуа, Франция); At был получен искусственным путем в 1940году, радиоактивен. Галогены - активные окислители. Сравнительные данные таблицы 1: увеличение радиуса, уменьшение относительной электроотрицательности говорят об ослаблении неметаллических и окислительных свойств. Галогены с меньшим порядковым номером вытесняют из растворов солей атомы с большим порядковым номером: F2+2KCl→KF+Cl2 F2+2KBr→2KF+Br2 Cl2+2KBr→KCl+Br2 F2 +2KI→ KF+I2 Cl2+2KI→KCl+I2 Нахождение в природе: Из-за высокой химической активности галогены в свободном виде в природе не встречаются. Галогены встречаются в виде солей в земной коре или ионов в морской воде. HCl↑ и HF↑ входят в состав вулканических газов.Основная масса фтора распылена по различным горным породам, важнейшими из которых являются минерал флюорит или плавиковый шпат - CaF2, фторапатит - 3Ca3(PO4)2•CaF2, минерал криолит - AlF3•3NaF. Хлор входит в состав минералов: NaCl - галит; KCl - сильвин; nNaCl•mKCl - сильвинит; KCl•MgCl2·6H2O – карналлит, MgSO4•KCl•3H2O – каинит. Бром встречается в воде некоторых соляных озер, в морской воде. Основным источником промышленного получения йода являются буровые воды и зола морских водорослей. F2 cветло - желтый газ, Cl2 желто - зелёный газ, Br2 красно - бурая жидкость (вызывает сильные ожоги), I2 темно - серые кристаллы с металлическим блеском. Для йода характерно явление возгонки (сублимации), т.е. переход из твёрдого состояния в газообразное, минуя жидкое. Все галогены имеют резкий запах, очень токсичны. В ряду анионов Наl- увеличивается радиус аниона, усиливаются восстановительные свойства, уменьшается прочность связи, растёт сила кислот (HF-средней силы, остальные - сильные). Соединения фтора: OF2 – фторид кислорода, бесцветный газ с запахом, похожим на запах озона, является сильнейшим окислителем и очень ядовит. (в этом соединении кислород проявляет степень окисления 2+). Взаимодействие фтора со щелочами происходит по уравнению: 2F2+2NaOH→2NaF+H2O+ OF2 |
