|
|
Донцова реф. Введение Актуальность исследования
Содержание:
Введение…………………………………………………………………………..3
1. Методы получения наночастиц оксида цинка и диоксида титана…………..7
2. Общие свойства наноструктур оксида цинка и диоксида титана…..…..….11
2.1. Кристаллическая структура оксида цинка и диоксида титана……11
2.2. Оптические свойства оксида цинка и диоксида титана…………...14
2.3. Электрофизические свойстваоксида цинка и диоксида титана…...17
3. Методика исследования спектров фотолюминесценции наноструктур на основе оксида цинка и оксида титана…………………………………………..21
4. Спектры ФЛ наноструктур на основе оксида цинка………………………..22
5. Спектры ФЛ наноструктур на основе оксида титана……………………….27
6.Иммуноферментный оптический биосенсор на основе наночастиц диоксида титана и оксида цинка…………………………………...………………………30
7. Биосенсор на основе диоксида титана….……………………………………31
8. Биосенсор на основе оксида цинка….……………………………………….35
Выводы………………………………….…………………………………….….
Литература………………………………………….…………………………....
Введение:
Актуальность исследования
Оксиды металлов представляют класс неорганических соединений, являющихся преимущественно широкозонными полупроводниками или диэлектриками с энергией ширины запрещенной зоны порядка 2.5-9 эВ. Данные материалы широко применяются в качестве каталитических и фотокаталитических элементов для химического окисления органических веществ [1], как оптические проводящие покрытия [2] в гибридных солнечных элементах [3], защитные антикороззийные покрытия [1] и т.д.
Последние 15 лет интерес исследователей к получению и исследованию свойств наноразмерных структур полупроводниковых материалов на основе оксидов металлов, обусловлен возможностью получать нанообъекты заданных размеров и формы, в виде тонких плёнок, пористых и других структур, а также встраивать их в диэлектрические матрицы и формировать с их помощью нанокомпозиты.
Квантово-размерные эффекты, возникающие при уменьшении размера кристаллитов приводят к увеличению ширины запрещенной зоны, уменьшению рабочих температур и повышению каталитической способности этих материалов, что может быть использовано для их практических применений, приведенных выше [1, 3].
Одним из перспективных прикладных направлений применений оксидов металлов, а именно TiO2 и ZnO является использование их в качестве химических сенсоров газа и жидкости, а также оптических биосенсоров [4-17].
Еще одним важным направлением использования нанооксидов металлов является применение их в качестве материала для биосенсоров. Биосенсоры представляют собой широкий класс устройств, призванных измерять концентрацию биологических молекул, структур или микроорганизмов, преобразуя биохимическое взаимодействие на поверхности образца в физический сигнал, измеряемый далее при помощи традиционных методов [4]. Биосенсор представляет собой устройство, состоящее из биологически чувствительного элемента (белок, фермент, антитело, антиген и т.д.) и трансдьюсера (электрохимический электрод, резистивный элемент, оптоволокно, пьезоэлектрический элемент и т.д.), который преобразует биологический сигнал в электрический, оптический, механический и т.д [7].
Применение биосенсоров в биологии позволяет в ряде случаев отказаться от иммунологических анализов, имеющих высокую стоимостью и длительность [7]. Диагностика при помощи оптических биосенсоров занимает минуты и, при тщательном подборе рецепторных слоев, обеспечивающих специфичность реакции, может быть столь же достоверна, как традиционные методы [7].
Принцип работы биоселективного слоя биосенсора основан на системе распознавания, обусловленной специфическими взаимодействиями, такими как фермент-подложка, антитело-антиген, рецептор-гормон [4].
В последние годы все больше внимания уделяется применению биосенсоров на основе наноматериалов.
Фотолюминесцентные (ФЛ) наноматериалы имеют преимущества перед традиционными флуоресцентными красителями, а именно лучшую стабильность [8-9], большую интенсивность сигнала. К тому же, есть возможность изменять полосу излучения ФЛ путем модификации поверхности образцов и изменения размера частиц [6, 8-9]. Таким образом, фотолюминесцентные наноструктуры могут обеспечивать новую функциональную платформу для биоаналитических исследований и биомедицинской инженерии.
Среди наноструткур, которые используются в качестве платформы для биосенсоров, оксиды металлов занимают важное место, поскольку они устойчивы в агрессивных средах с рН от 2.5 до 9.7, обладают как гидрофильными, так и гидрофобными свойствами, что является крайне важным для создания биологического селективного слоя на их поверхности [8-9].
Среди оксидов металлов особый интерес представляют оксиды титана и цинка как основа ФЛ биосенсоров. Данные материалы является широкозонными полупроводниками с энергией ширины запрещенной зоны 3.2-3.4 эВ. Они прозрачны в видимой области спектра и край их собственного поглощения приходится на интервал 340-390 нм [8-9].
Разработан ряд технологических методов нанесения, которые позволяют получать образцы наноструктур оксидов металлов (плёнки, наночастицы, наностержни, и т.д.) с заданными значениями электрической проводимости и морфологии поверхности [8-9].
Определяющей особенностью наноструктур на основе данных материалов является фотолюминесценция при комнатной температуре, которая наблюдается в области 450-670 нм для наноструктур оксида титана и 370-430 и 450-700 для оксида цинка.
Оксиды титана и цинка широко применяются в биосенсорах различного типа: электрохимических [10, 11], электрических [10, 12] и оптических [8-9].
Оптимальное по простоте и себестоимости нанесение биоселективного слоя на поверхность трансдьюсера показано на примере оптических биосенсоров на основе оксидов металлов [8-9, 11]. В данных биосенсорах наноструктуры на основе TiO2 и ZnO выступают в роли активных и пассивных компонент. В первом случае свойства оксидов металлов изменялись в результате биологического взаимодействия на их поверхности (изменение коэффициента преломления, отражения, и т.д.) тогда как во втором случае поверхность наноструктур оксидов металлов выступает в качестве «подложки» для биологических объектов.
Целью работы являеться исследовать оптическии свойста наноструктур диоксида титана и оксида цинка для создания оптических биосенсоров
Основные задачи исследований:
1) Детальное и систематическое исследование закономерностей формирования наночастиц диоксида титана и оксида цинка для целенаправленного синтеза перспективных наноматериалов с заданными физико-химическими свойствами.
2)Определение фотолюминесцентной характеристики НЧ диоксида титана и оксида цинка для применении в качестве оптических биосенсора.
3) Изучение влияния биологических материалов на ФЛ полученных образцов
Литературный обзор данных
В числе преимуществ ZnO и TiO2: нетоксичность, высокие оптические характеристики (способность к рассеиванию света), доступность, химическая инертность, атмосферостойкость и др.[3]
1.Методы получения наночастиц TiO2 и ZnO
Способы получения НЧ металлов сегодня продолжают интенсивно развиваться. В настоящее время известны два основных способа получения наноразмерных частиц [3, 4, 5]:1) физический, который включает термическое испарение НЧ при обработке плазмой, лазером, электрической дугой и т.д., конденсацию исходного материала в вакууме, механохимическое диспергирование, электроэрозию, литографию;
2) химический, заключающийся в получении НЧ металлов методами: термического или радиационного восстановления металлсодержащих соединений, разложения при воздействии УФ, УЗ, температуры или синтеза в обратных мицеллах, на границе раздела фаз или золь-гель метод.
Получения наночастиц диоксида титана(Золь-гель метод)
Одним из наиболее универсальных методов получения диоксида титана является золь-гель синтез [5-6]. В типичном золь-гель процессе коллоидная суспензия или золь образуются в результате гидролиза и реакции полимеризации из предшественников, которыми обычно выступают неорганические соли металлов или металлорганические соединения, такие как алкоксиды металлов. Полная полимеризация и убыль растворителя приводят к переходу из жидкого золя в твердую фазу геля. Аэрогели, материалы с высокой пористостью и очень низкой плотностью получаются при удалении растворителя из влажного геля при сверхкритических условиях.
Наиболее широко распространен золь-гель метод по получению наночастиц диоксида титана путем гидролиза предшественника, содержащего титан в степени окисления (+4). Этот метод удобен тем, что благодаря варьированию разных параметров синтеза в довольно мягких условиях: водная среда, небольшой температурный диапазон (0-100 °C), pH среды, можно получать наночастицы диоксида титана с различной структурой, размером, текстурными характеристиками и морфологией [7-10]. Данный процесс обычно проходит через этап гидролиза алкоксида титана (IV), катализируемого кислотой, с последующей конденсацией [57]. Образование трёхмерных полимерных скелетов с близкой упаковкой является результатом развития Ti-O-Ti цепей. Развитию Ti-O-Ti цепочек благоприятствует низкое содержание воды, медленное протекание гидролиза и избыток алкоксида титана в реакционной смеси. Плотно упакованные частицы первого порядка можно получить из образовавшегося трёхмерного скелета геля. Образованию Ti(OH)4 способствует быстрый гидролиз при среднем количестве воды. Присутствие большого количества Ti-ОН и недостаточное развитие трехмерных полимерных скелетов приводит к образованию рыхлых частиц первого порядка. Исследование кинетики роста наночастиц TiO2 в водном растворе из тетраизопропоксида титана (TTIP), используемого в качестве предшественника, показало, что константа скорости увеличивается с ростом температуры, что обусловлено температурной зависимостью вязкости раствора и равновесия растворимости TiO2. Вторичные частицы образуются в результате эпитаксиальной самосборки первичных частицы при большем времени синтеза и при более высоких температурах, а также число первичных частиц на вторичной частице возрастает с течением времени. Cредний радиус наночастиц TiO2 увеличивается линейно во времени, согласно модели укрупнения Лифшица-Слиозова-Вагнера .
Высоко кристаллические наночастицы TiO2 со структурой анатаз различного размера и формы могут быть получены при поликонденсации алкоксида титана в присутствии тетраметиламмония [8]. По типичной методике к находящимуся в трехгорлой колбе алкоксиду титана в спиртовом растворителе добавляется основание при 2°C, после чего полученный раствор нагревается до 50-60°C и выдерживается в течение 13 дней или при температуре 90-100°C в течение 6 часов. Далее полученные частицы подвергаются обработке в автоклаве при 175 и 200°С, что повышает кристалличность наночастиц TiO2.
Под руководством Сугимото и соавторов[59]. были проведены тщательные исследования с применением золь-гель метода для установления влияния параметров реакции на формирование наночастиц TiO2, т.е. на размер и форму. Основной 0,50 М раствор, служащий источником Ti, получен смешиванием TTIP с триэтаноламином (ТЕОА) ([TTIP]/[ТЕОА])=1:02) с последующим добавлением воды. Исходный раствор разбавлен раствором, содержащем амины для регулирования формы, и затем выдерживался при 100°C в течение 1 дня и при 140°С в течение 3 дней. pН раствора регулируется добавлением HClO4 или NaOH. Амины, используемые в качестве контролеров формы наночастиц TiO2, действуют как поверхностно-активные вещества. Эти амины включают ТЕОА, диэтилентриамин, триметилендиамин, триэтилентетраамин. Морфология поверхности наночастиц TiO2 изменяется от кубической до эллипсоидальной при рН > 11 с ТЕОА. Форма наночастиц TiO2 эволюционирует в эллипсоидальную при рН выше 9,5 с диэтилентриамином и с более высоким значением соотношения, чем с ТЕОА. Вторичные амины, такие как диэтиламин, и третичные амины, такие как триметиламин и триэтиламин, действуют в качестве комплексообразующих агентов ионов Ti (IV) и промотируют рост эллипсоидальных частиц при более низких соотношениях.
Форма наночастиц TiO2 также может быть отрегулирована от округлых треугольных кубов до кубов с острыми краями при помощи олеата натрия и стеарата натрия. Контроль формы относится к регулировке скорости роста разных кристаллических плоскостей наночастиц TiO2 при помощи специфической адсорбции регуляторов формы на эти плоскости при разных значениях pH.
Чтобы избежать агломерирования приготовленных наночастиц TiO2 в процессе кристаллизации, нужно длительное нагревание при температуре ниже 100 °С [8]. Согласно исследованиям Чжана и Банфилда при нагревании аморфного TiO2 на воздухе может наблюдаться большое количество однофазных наночастиц диоксида титана со средним размером частиц от 7 до 50 нм. По данным Знаиди с соавторами, высокая кристалличность и узкое распределение наночастиц TiO2 с разными модификациями по размерам была достигнута при синтезе золь-гель методом полунепрерывным способом, по данным Ким и др.- двухстадийным методом смешения и методом непрерывной реакции [20].
Получение наностержней оксида цинка (газодисперсный синтез ( ГДС ))
Наностержни оксида цинка были получены в виде нанопорошков методом газодисперсного синтеза [21]. Газодисперсный синтез ( ГДС ) - новый высокопродуктивный метод получения химически чистых (> 99,7% ) гранулометрически узких, сферической формы, хорошо дезагрегированных нанопорошков со средним размером частиц в диапазоне 20 - 400 нм цинка, железа и др. В основе метода лежит сжигание в специально организованных двухфазных пламенах газовзвесей частиц цинка. Наностержни оксида цинка образуются в результате конденсации газофазных продуктов горения цинка в окислительной среде [21].
Фазовый состав полученных наноструктур на основе оксида цинка исследовался методами дифракции рентгеновского излучения и сканирующей электронной микроскопии.
Исследования методом электронной микроскопии были проведены с помощью электронного микроскопа TESCAN MIRA3 с использованием ускоряющего напряжения 15 кВ при увеличении в 100 тыс. раз
Исследования спектров дифракции рентгеновского излучения образцов проводились на установке Rigaku Ultima XRD-setup (CuKα, λ=0.154 нм). Сканирование проводилось в интервале углов 2θ от 20 до 80°.
Согласно данным таблиц материалов (JCPDS No. 36-1451) установлено, что полученное вещество является оксидом цинка со структурой вюртцита. Наличие большого количества пиков указывает на отсутствие определённого направления роста, что характерно для порошков наноструктур.
Порошок, состоящий из наностержней оксида цинка, исследовался также методом сканирующей электронной микроскопии. С этой целью, порошок, состоящий из наностержней наносился тонким слоем на проводящий двусторонний скотч, который другой стороной крепился к металлическому держателю, который затем помещался в измерительную камеру микроскопа. Результаты исследований проводились на сканирующем электронном микроскопе TESCAN VEGA при ускоряющей разности потенциалов 15 кВ.
2. Общие свойства наноструктур оксида цинка и диоксида титана
2.1.Кристаллическая структура оксида цинка и диоксида титана
Кристаллическая структура диоксида титана
TiO2 принадлежит к классу оксидов переходных металлов и имеет несколько модификаций: анатаз, рутил, брукит, TiO2 (B), TiO2 (II), TiO2 (H) . Стоит отметить, что первые три широко распространены в природе. TiO2 (B), с моноклинной структурой также встречается в природе, но редко. TiO2 (II) со структурой PbO2 и TiO2 (H) со структурой голландита были получены искусственно из рутила в условиях высокого давления. В этом обзоре рассмотрены только основные три кристаллические структуры: анатаз, рутил и брукит, характеристики которых приведены в таблице 1.[4-5]
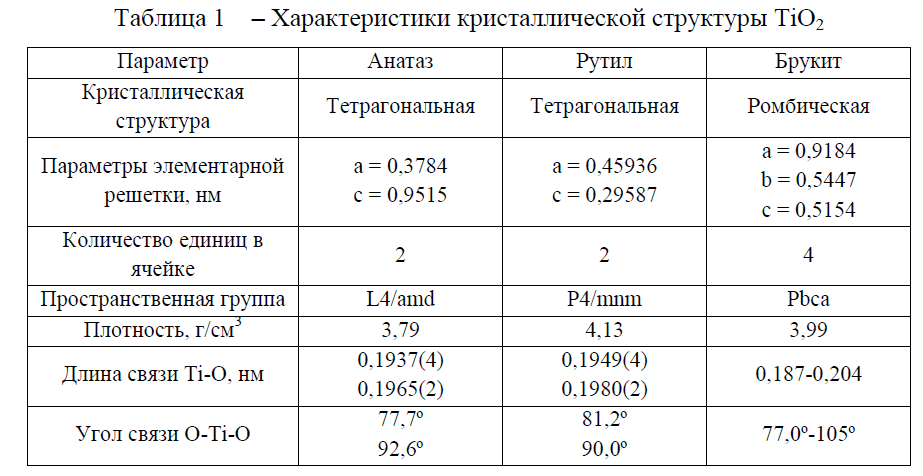
Основой кристаллической структуры этих полиморфных модификаций являются октаэдры TiO6 (см. рисунок 1). Октаэдры расположены таким образом, что могут иметь общие вершины или ребра. В анатазе на один октаэдр приходятся 4 общих ребра, в рутиле – 2 . Это и является причиной различия их характеристик.
Диоксид титана со структурой брукита принадлежит к ромбической кристаллической системе. В бруките каждый октаэдр имеет общие ребра с двумя соседними, при этом они имеют меньшую длину по сравнению с остальными. Элементарная ячейка[8] состоит из 8 единиц TiO2 и формируется из октаэдров TiO6 (см. рисунок 1 (в)). Брукит имеет более сложное строение элементарной ячейки, больший объем, а также является наименее плотным из 3 рассмотренных форм и не часто используется для экспериментальных исследований .

Рисунок 1 – Кристаллическая структура TiO2: рутил (а), анатаз (б) и брукит (в)
При термической обработке анатаз и брукит переходят в рутил при температурах 400-1000 °С и 750 °С, соответственно.
Кристаллическая структура оксида цинка
Большинство бинарных полупроводниковых соединений A2 B6 кристаллизуются в двух близких между собой алмазоподобных структурах: сфалерита и вюрцита. В этих структурных типах каждый атом окружен четырьмя атомами другого вида, т. е. они проявляют одинаковую валентность, равную четырем. Подобная тетраэдрическая координация характерна для sp3 ковалентной связи, однако такие материалы имеют также существенный ионный характер связи [8]. ZnO по характеру ионности находится на границе между ковалентным и ионным полупроводником [9]. Различают три основных кристаллических структуры ZnO: вюрцит, сфалерит и каменная соль (рис 2).
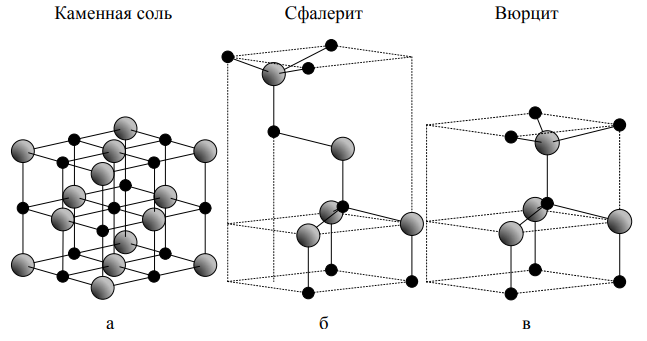
Рисунок 2. – Кристаллическая структура ZnO: а – каменная соль, б – сфалерит, в – вюрцит
Структура вюрцита при нормальных условиях является термодинамически стабильной фазой и имеет гексагональную ячейку с параметрами a и c (рис.3), соотношение которых 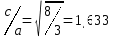 . Она состоит из двух взаимопроникающих плотноупакованных гексагональных подрешеток, каждая из которых содержит атомы одного вида, которые смещены друг относительно друга вдоль оси c на расстояние u=3/8=0,375. Каждая подрешетка включает в себя четыре атома в элементарной ячейке, а каждый атом Zn окружен четырьмя атомами O и наоборот, при этом окружающие атомы координируются в углах тетраэдра. В реальном кристалле ZnO структура вюрцита отличается от идеального расположения соотношением c a/ или значением u . Следует отметить, что наблюдается строгая корреляция между c a/ или значением u. Когда c a/ уменьшается, параметр u увеличивается таким образом, что эти расстояния остаются 1 Каменная соль Сфалерит Вюрцит а б в почти постоянными в результате искажения тетраэдрических углов из-за дальнего полярного взаимодействия [8]. . Она состоит из двух взаимопроникающих плотноупакованных гексагональных подрешеток, каждая из которых содержит атомы одного вида, которые смещены друг относительно друга вдоль оси c на расстояние u=3/8=0,375. Каждая подрешетка включает в себя четыре атома в элементарной ячейке, а каждый атом Zn окружен четырьмя атомами O и наоборот, при этом окружающие атомы координируются в углах тетраэдра. В реальном кристалле ZnO структура вюрцита отличается от идеального расположения соотношением c a/ или значением u . Следует отметить, что наблюдается строгая корреляция между c a/ или значением u. Когда c a/ уменьшается, параметр u увеличивается таким образом, что эти расстояния остаются 1 Каменная соль Сфалерит Вюрцит а б в почти постоянными в результате искажения тетраэдрических углов из-за дальнего полярного взаимодействия [8].
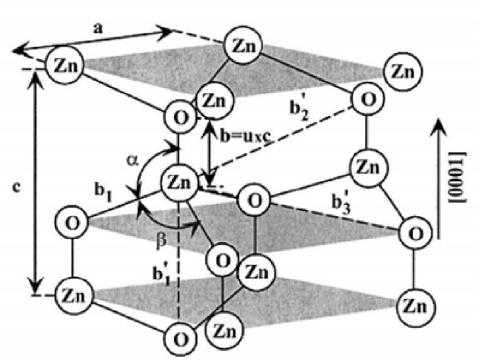
Рисунок 3. – Схематическое изображение ZnO со структурой вюрцита, где а и с – постоянные решетки, а параметр u определяется как отношение с к минимальному расстоянию между соседними атомами b [8]
ZnO со структурой сфалерита является метастабильным и может быть стабилизирован только путем гетероэпитаксиального наращивания на кубические подложки, например, ZnS [10], GaAs/ZnS [11], и Pt/Ti/SiO2/Si [12]. При сильном несоответствии подложки, как правило, образуется небольшое количество фазы сфалерита, отделенное от фазы вюрцита кристаллографическими дефектами. Структура цинковой обманки состоит из двух взаимопроникающих гранецентрированных кубических подрешеток, сдвинутых по диагонали на одну четверть.
Как и в других полупроводниках A2 B6 , структура вюрцита в ZnO преобразуется в структуру каменной соли под действием относительно высокого гидростатического давления. Причиной трансформации является то, что при уменьшении размеров решетки возникает межионное кулоновское взаимодействие, которое усиливает ковалентную природу связи. В работе [13] было показано, что такой фазовый переход осуществляется под давлением около 10 ГПа и сопровождается уменьшением объема до 17 %. Было обнаружено, что данная фаза является метастабильной в течение длительного времени даже при атмосферном давлении и температуре выше 100 °C. |
|
|
 Скачать 1.89 Mb.
Скачать 1.89 Mb.