Нпп. Документ 40. Взаимное влияние атомов и способы его передачи в органических молекулах. Сопряжение
 Скачать 0.77 Mb. Скачать 0.77 Mb.
|
|
1 Вопрос Взаимное влияние атомов и способы его передачи в органических молекулах. СопряжениеВ органических молекулах двойная связь, являющаяся сочетанием σ- и π-связей, может располагаться локализовано; например, в углеводородных цепях алкенов – между двумя углеродными атомами. В органических соединениях других классов – в улеводородном радикале, а также между атомом углерода и гетероатомом (O, N, S). При этом, поскольку электронная плотность π-связи охватывает только два ядра связываемых атомов, связь называется локализованной, двухцентровой. Такие связи часто встречаются в природных соединениях (ненасыщенных высших карбоновых кислотах). Однако, особо большое значение в биологических процессах имеют сопряженные системы – соединения с чередующимися двойными и одинарными связями. Образование сопряженной многоцентровой системы сопровождается: - частичным выравниванием длин связей (нет «чистых» одинарных и «чистых» двойных); - обобществлением p-электронов и делокализацией электронного облака. При этом происходит выделение энергии; система переходит на более низкий энергетический уровень, становясь более устойчивой и стабильной. 2 Вопрос Мерой термодинамической устойчивости такой системы является энергия сопряжения, которая выражается разностью полной π-электронной энергии несопряженной системы (с локализованными связями) и π-электронной энергии всей сопряженной системы. Чем длиннее цепь сопряжения, тем больше выигрыш энергии при ее образовании. Различают сопряженные системы: -с открытой и замкнутой цепью; - с π,π или p,π сопряжением, - с углеродной цепью или цепью, содержащей гетероатом. 3 Вопрос Системы с открытой цепью сопряженияСопряжение в открытых системах, т.е. в незамкнутых цепях возникает при следующих условиях: в молекуле имеется чередование одинарных и двойных связей; атомы углерода, участвующие в образовании сопряженной системы, находятся в состоянии sp2-гибридизации. Вместе со всеми σ-связями они лежат в одной плоскости, образуя плоский σ-скелет молекулы; pz-орбитали всех атомов перпендикулярны плоскости σ-скелета и параллельны друг другу, что обуславливает их перекрывание и делокализацию электронной плоскости. Простейшей π,π-сопряженной системой с открытой углеродной цепью является бутадиен-1,3. В его молекуле все атомы углерода находятся в состоянии sp2-гибридизации. Вместе с атомами водорода и σ-связями они лежат в одной плоскости и образуют σ-скелет молекулы. Негибридизованные pz-орбитали каждого атома углерода, имеющие по одному электрону, перпендикулярны плоскости σ-скелета и параллельны друг другу, что способствует их взаимному перекрыванию. Перекрывание происходит как между атомами С1 и С2, С3 и С4, так и частично между атомами С2 и С3, что приводит к усреднению длин связей и обобществлению электронов. Четыре p-электрона одновременно находятся в поле ядер четырех атомов углерода, образуя единое делокализованное π-электронное облако. Выигрыш энергии, т.е. энергия сопряжения, - 15 кДж/моль. Такой тип является π,π-сопряжением, т.к. перекрываются p-орбитали π-связей 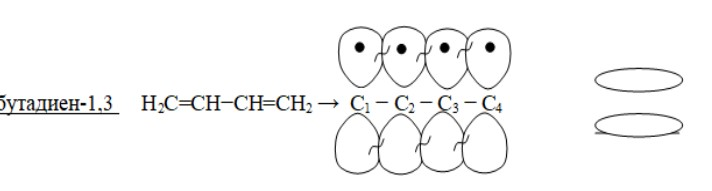 Сопряжение возможно не только в углеводородной цепи с чередующимися двойными и одинарными связями между атомами углерода, но и в гетероуглеродных молекулах, когда двойные и одинарные связи чередуются как между атомами углерода, так и между атомом углерода и гетероатомом (О, N, S). При этом возникает как π,π, так и р,π-сопряжение. К открытым π ,π-сопряженым системам с гетероатомом в цепи относятся α,β-ненасыщенные карбонильные соединения, содержащие структурный фрагмент 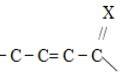 в котором гетероатом Х (кислород), связанный с углеродным атомом двойной связью, поставляет в цепь сопряжения р-орбиталь с одним электроном. Примером может служить пропеновый альдегид (акролеин), у которого в сопряжение вступают четыре р-орбитали (от трех атомов углерода и атома кислорода), имеющие по одному электрону. В результате единое четырехэлектронное π-облако делокализуется на четырех атомах цепи: 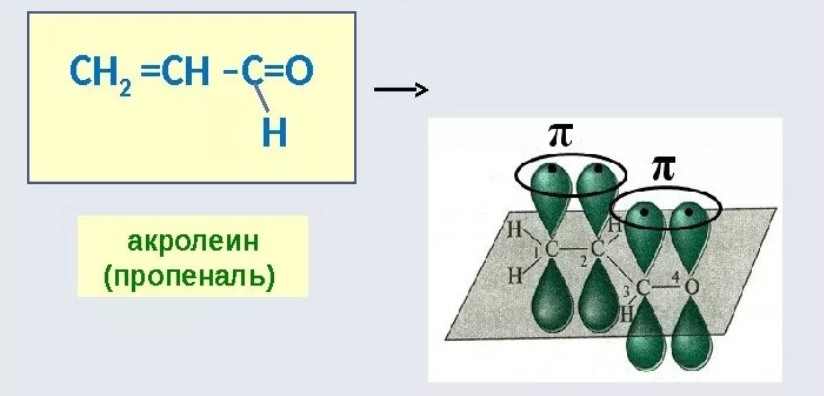 Открытые р,π-сопряженые системы с гетероатомом в цепи.К открытым р,π-сопряженым системам с гетероатомом в цепи относятся соединения, содержащие структурный фрагмент где гетероатом Х (О, N, S, галоген), отделенный от двойной связи одинарной σ-связью, поставляет в систему сопряжения р-орбиталь с неподеленной электронной парой. Примером может служить молекула дивинилового эфира, в котором в сопряжение вступают четыре четыре р-орбитали четырех атомов углерода, имеющие по одному электрону, и р-орбиталь атома кислорода, содержащая неподеленную электронную пару. При этом образуется единое шестиэлектронное облако, делокализующееся на пяти атомах цепи: 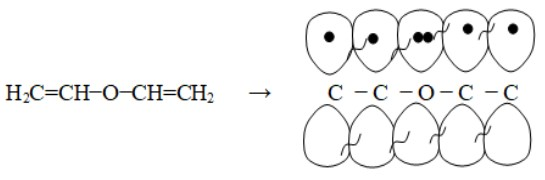 Сопряжение в открытых системах широко распространено в биологически важных соединениях – каротиноидах (растительные пигменты), витаминах (ретинол, ретиналь), которые в общем случае можно назвать полиенами. Сопряжение системы с замкнутой цепью. АроматичностьСреди сопряженных систем с замкнутой цепью наибольший интерес представляют соединения, обладающие ароматичностью, т.е. совокупностью признаков, обуславливающих их повышенную термодинамическую устойчивость по сравнению с открытыми сопряженными системами. 4 Вопрос В 1931 году Хюккель сформулировал критерии ароматичности, согласно которым, система обладает ароматичностью, если: Молекула имеет циклическое строение и содержит чередующиеся двойные и одинарные связи; Все атомы углерода находятся в состоянии sp2-гибридизации. Вместе со всеми σ-связями они лежат в одной плоскости, образуя плоский σ-скелет молекулы; Все pz-орбитали перпендикулярны σ-скелету и параллельны друг другу, что обуславливает их взаимное перекрывание; Образуется делокализованная π-электронная система, охватывающая все атомы цикла и содержащая (4n+2) π-электронов; n=1,2… 3 Вопрос Замкнутой сопряженной системой с углеводородным циклом, которая соответствует всем критериям ароматичности Хюккеля, является бензол. В котором соблюдаются все критерии ароматичности: В его молекуле шесть атомов углерода находятся в состоянии sp2-гибридизации и образуют цикл. Система С−С и С−Н σ-связей составляют плоский σ-скелет молекулы. Перпендикулярно σ-скелет молекулы располагаются шесть негибридизованных р-орбиталей шести углеродных атомов, дающие в сопряжение по одному электрону. Взаимно перекрываясь р-орбитали образуют замкнутую сопряженную систему. В ней все связи имеют одинаковую длину, среднюю между длинами одинарных и двойных связей, а единое π-электронное облако делокализуется, охватывая все шесть атомов углерода. При этом оно располагается симметрично над и под плоскостью σ-скелета. При n=1 такая сопряженная система содержит (4n+2), т.е. шесть π-электронов. Выигрыш энергии при ее образовании, т.е. энергия сопряжения, 150 кДж/моль. Поэтому бензол термодинамически очень устойчив – выдерживает нагревание до 900˚С. Конденсированные бензоидные системы, в которых нет атомов, общих более чем для двух циклов, также соответствуют критериям Хюккеля и являются ароматическими. Например нафталин при n=2 его сопряженная система содержит 10 π-электронов: 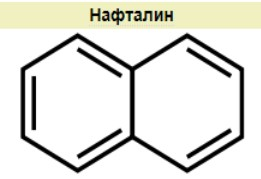 Гетероциклические ароматические соединения.Пяти- и шестичленные ненасыщенные гетероциклические соединения содержащие О, N, S, соответствуют критериям Хюккеля. Однако, наличие гетероатома приводит к неравномерному распределению электронной плотности в молекуле. Для пятичленных гетероциклов характерно p,π-сопряжение. Ароматическая система у них образуется при взаимодействии четырех негибридизированных p-орбиталей атомов углерода, содержащих по одному электрону, и одной p-орбитали гетероатома с неподеленной электронной парой. При этом шестиэлектронное облако делокализуется на пяти атомах цикла. Такие системы называются электроноизбыточными. К ним относятся пиррол, фуран, тиофен: 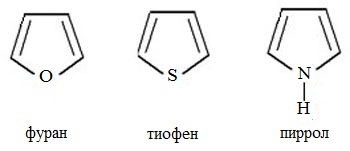 Для шестичленных циклов с одним или несколькими гетероатомами характерно π,π-сопряжение. Простейшим их представителем является пиридин. Его ароматическая система содержит 6 π-электронов. Она образуется при перекрывании пяти негибридизированных p-орбиталей атомов углерода и одной p-орбитали атома азота. При этом все орбитали поставляют в цепь сопряжения по одному электрону: 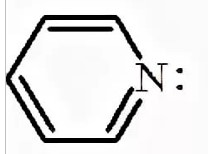 Хотя шестиэлектронное облако в пиридине делокализовано на шести атомах цикла, оно смещено в сторону более электроотрицательного атома азота. Поэтому система обеднена π-электронами и называется электронодифицитной. К ароматическим также относятся пиримидин, пурин – соединения, содержащие два и более атомов азота. 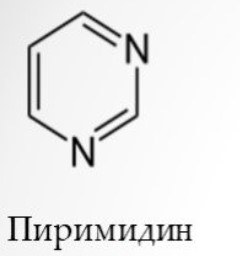 Перечисленные гетероциклические ароматические соединения обладают высокой термодинамической устойчивостью и поэтому служат структурными единицами важнейших биологически активных соединений. Так, пиридин, пиримидин, пурин – структурные компоненты нуклеиновых кислот. Четыре пиррольных ядра образуют порфин, который является основой гемоглобина и хлорофилла. 5 Вопрос Электронные эффекты. Индуктивный эффект. Все атомы, составляющие органическую молекулу, находятся во взаимосвязи и испытывают взаимное влияние. Это влияние передается в основном через систему ковалентных связей с помощью электронных эффектов. Электронный эффект – смещение электронной плотности в молекуле под влиянием отдельных атомов или групп атомов. Реакционная способность органических соединений в значительной степени зависит от распределения электронной плотности в молекулах до начала химического взаимодействия. При этом характер распределения электронной плотности определяется действием электронных эффектов заместителей. Различают индуктивный / I -/ и мезомерный / M -/ эффекты. 6 Вопрос Индуктивный эффект – это передача электронного влияния заместителя по цепи δ-связи. При этом заместитель вызывает поляризациюне только своей δ- связи с атомом углерода, но передаёт влияние /оказывает эффект/ по цепи, что ведёт к появлению и на других углеродных атомах частичных зарядов /δ/. Вследствие слабой поляризуемости δ-связи индуктивный эффект максимально проявляется на двух ближайших к заместителю атомах углерода и затухает в цепи через 3-4 часа δ-связи. Заместители, смещающие электронную плотность по цепи δ – связей на себя, т.е. уменьшают ее в системе, проявляют отрицательный индуктивный /-I/-эффект и называются электроноакцепторными /ЭА/. Это галогены и группы атомов более отрицательные, чем атом водорода, индуктивный эффект которого принят за ноль. Заместители, смещающие электронную плотность на себя, т.е. увеличивающие ее в цепи δ-связей, проявляют положительный индуктивный /+I /-эффект и называются электронодонорными /ЭД/. К ним относятся атомы металлов и алкильные группы. Графически индуктивный эффект изображается стрелкой, совпадающей с δ–связью и направленной к более электроотрицательному атому:  7 Вопрос Мезомерный эффект.Мезомерный М-эффект или эффект сопряжения – это передача электронного влияния заместителя по системе π–связей. Т.е. перераспределение электронной плотности в сопряженной системе под влиянием заместителя, являющегося ее участником. Чтобы заместитель входил в сопряженную систему, он должен иметь либо двойную связь /ππ- сопряжение /, либо гетероатом с неподеленной парой электронов / pπ- сопряжение /. В отличии от индуктивного мезомерный эффект передается по цепи сопряженных связей без затухания и на значительно большие расстояния. Графически он изображается изогнутыми стрелками, начало которых показывает какие – π или p-электроны смещаются, а конец – связь или атом, к которым смещаются эти электроны. При этом на концевых атомах сопряженной цепи указывают образующиеся частичные заряды / δ /. Заместители, смещающие электронную плотность на себя и уменьшающие ее в сопряженной системе, проявляются отрицательный мезомерный –(-)М-эффект. Это положительно заряженные частицы или группы атомов, содержащие кратные связи: 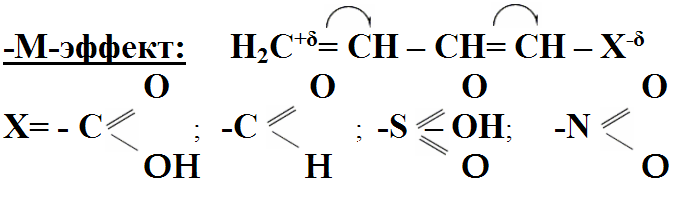 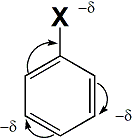 Заместители, смещающие электронную плотность от себя и повышающие ее в сопряженной системе, проявляют положительный мезомерный (+) М-эффект. К ним относятся гетероатомы или группы, включающие гетероатом, с неподеленной электронной парой или целым отрицательным зарядом: 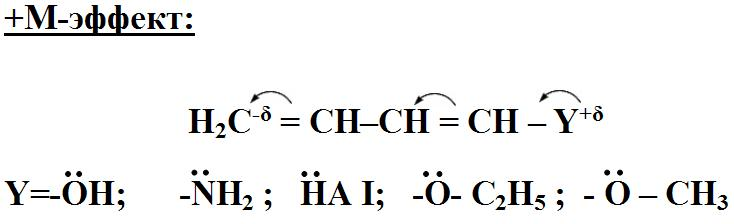 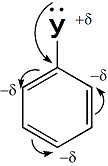 8 Вопрос Анализ суммарного действия индуктивного и мезомерного эффектов.Поскольку двойные связи содержат как π-, так и δ-связи, то при оценке влияния заместителя на распределение электронной плотности в сопряженной системе, необходимо учитывать суммарное действие индуктивного и мезомерного эффектов. Правило: Положительный мезомерный +М-эффект преобладает над отрицательным индуктивным –I-эффектом для всех заместителей кроме галогенов. Для них –I > +М. Алкильные группы / радикалы R / не проявляют мезомерного эффекта, для них характерен только + I-эффект. С учетом этого заместители в сопряженных системах также подразделяются на электронодонорные /ЭД/, повышающие электронную плотность, и электроноакцепторные /ЭА/,понижающие электронную плотность в молекуле:  Таким образом, поляризация связей и электронные эффекты заместителей обуславливают неравномерность распределения электронной плотности и возникновение в органических молекулах реакционных центров – мест с частичным положительным и отрицательным зарядом, которые могут подвергаться атаке противоположно заряженных частиц. |
