РГР кванты. Задача расчета выбрать наименьший возможный оптимальный базис для неэмпирического расчета длин связей и валентных углов молекулы ch
 Скачать 158.5 Kb. Скачать 158.5 Kb.
|
|
М  инистерство образования и науки Российской федерации инистерство образования и науки Российской федерацииФедеральное агентство по образованию РХТУ им. Д.И Менделеева Кафедра квантовой химии Расчетная работа № 1 «Неэмпирический расчет молекулы CH3F ограниченным методом Хартри-Фока» Студенты 2 курса Группы A-22 Александров Руслан, Зуденков Михаил, Кузьмин Арсений, Соколов Андрей, Ковалёв Николай, Нерозин Вячеслав, Дёмин Иван. Проверил: М.Ф. Бобров Москва 2021 г. 1. ЦЕЛИ И ЗАДАЧИ РАСЧЕТА. Цель расчета: Определение критериев выбора и изучение принципов построения стандартного базисного набора для расчета молекулярных систем. Изучение методов интерпретации результатов расчета и представления молекулы в виде вектора свойств на их основе. Знакомство с программным комплексом GAMESS. Задача расчета: выбрать наименьший возможный оптимальный базис для неэмпирического расчета длин связей и валентных углов молекулы CH3F с по программному комплексу GAMESS с точностью порядка 0.01 Å для длин связей и 1 градус для валентных углов, сравнимой с экспериментальной. На основании результатов расчета оценить стабильность и факторы, определяющие реакционную способность этой молекулы. 2. ХАРАКТЕРИСТИКА И ОБОСНОВАНИЕ МЕТОДА РАСЧЕТА Расчет молекулы CH3F осуществлен по программному комплексу GAMESS в стандартном базисном наборе Попла 6-31G*. Этот базис является валентно-расщепленным, это значит, что валентные МО представлены линейными комбинациями 2 сжатых комбинаций гауссовых орбиталей, остовные МО – 1-й. На каждом неводородном атоме также центрировано по 6 компонент поляризационных d-функций. Таким образом, базис для расчёта молекулы CH3F состоит из 36 функций: 3. ИНТЕРПРЕТАЦИЯ РЕЗУЛЬТАТОВ РАСЧЕТА 1. Оценка стабильности молекулы Энтальпия образования молекулы CH3F из простых веществ равна: fH0 (CH3F) = E(CH3F) – 1/2E(C2) – 1/2E(F2) – 3/2E(H2) = - 139.0346 +1/2·75.37903 + 1/2·198.67776 + 3/2·1.12683 = - 0.32736 а.е. = - 205.42 ккал/моль = -859.48 кДж/моль Вывод: молекула CH3F стабильна при стандартных условиях. Свойства связей молекулы CH3F
Валентность атомов по Коулсону в молекуле CH3F
Сопоставляя длину связей в молекуле CH3F с их порядком и валентностью атомов, можно сделать следующий вывод: в данной молекуле ковалентные связи. Энергетическая диаграмма (а.е.) 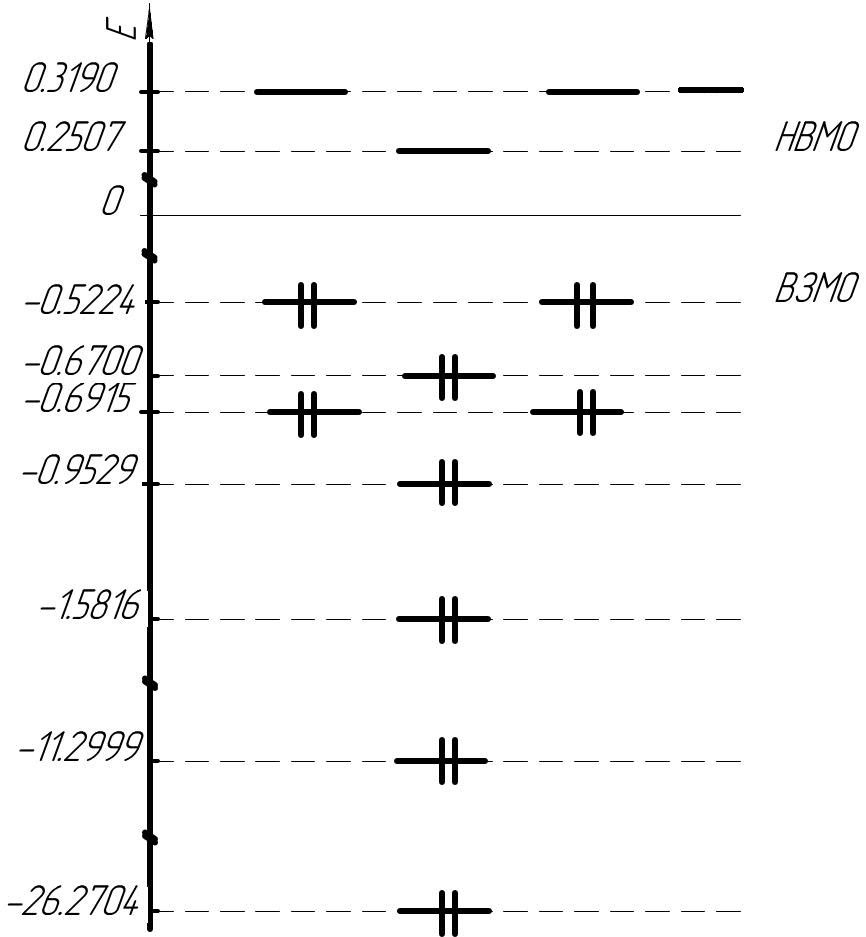 Определение нуклеофильных и электрофильных свойств молекулы CH3F Энергия НВМО молекулы CH3F положительна (0.2507 а.е.) Вывод: Молекула CH3F ─ нуклеофил. Определение жесткости и мягкости молекулы ВЗМО молекулы CH3F дважды вырождена. Разница энергий НВМО и ВЗМО составляет 0.7731 а.е.= 21,0371 эВ> 1 эВ Жесткость молекулы CH3F: η = ½ (ЕНВМО – ЕВЗМО) = ½(0,2507 + 0,5224) = 0,3866 а.е. = 10,5199 эВ Мягкость молекулы CH3F: S=½η=½0,3866=1,293 а.е.-1 = 3,5184 эВ Вывод: Молекула CH3F является жестким реагентом. Определение положения реакционных центров
Максимальный отрицательный заряд (граничная плотность электронов) на атоме F. Вывод: Атом F – наиболее вероятный центр электрофильной атаки. Оценка растворимости Электрический дипольный момент молекулы CH3F составляет 1,99 D. Вывод: Молекула CH3F растворима в сильно полярных растворителях (вода, спирты). Полная энергия молекулы. Потенциальная и кинетическая энергия. Вириал. TOTAL ENERGY =139.034615 а.е. TOTAL POTENTIAL ENERGY =-277.8939 а.е. TOTAL KINETIC ENERGY =138.8592 а.е. VIRIAL RATIO (V/T) =2.0013 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
