контрольная работа по химии. КР. Задание 28
 Скачать 1.46 Mb. Скачать 1.46 Mb.
|
|
Вариант 45   Задание 28. http://buzani.ru/zadachi/khimiya-shimanovich/902-stroenie-atoma-izotopy-zadanie-26-28-29-31-328 Что такое изотопы? Чем можно объяснить, что у большинства элементов периодической системы атомные массы выражаются дробным числом? Могут ли атомы разных элементов иметь одинаковую массу? Как называются подобные атомы? Решение: Атомы, обладающие одинаковым зарядом ядра (и, следовательно, тождественными химическими свойствами), но разным числом нейтронов (а значит, и разным массовым числом), называют изотопами (от греч. слов «изос» - одинаковый и «топос» - место). Установлено, что, как правило, каждый элемент представляет собой совокупность нескольких изотопов. Именно этим объясняются значительные отклонения атомных масс многих элементов от целочисленных величин. Так, природный хлор на 75,53% состоит из изотопа 35Cl и на 24,47% из изотопа 37Cl; в результате средняя атомная масса хлора равна 35,453. В природе встречается и другое явление, заключающееся в том, что атомы разных элементов обладают одинаковой атомной массой, но разным зарядом ядер. Такие атомы называют изобарами. Например, изотоп калия 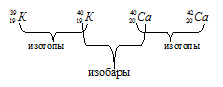 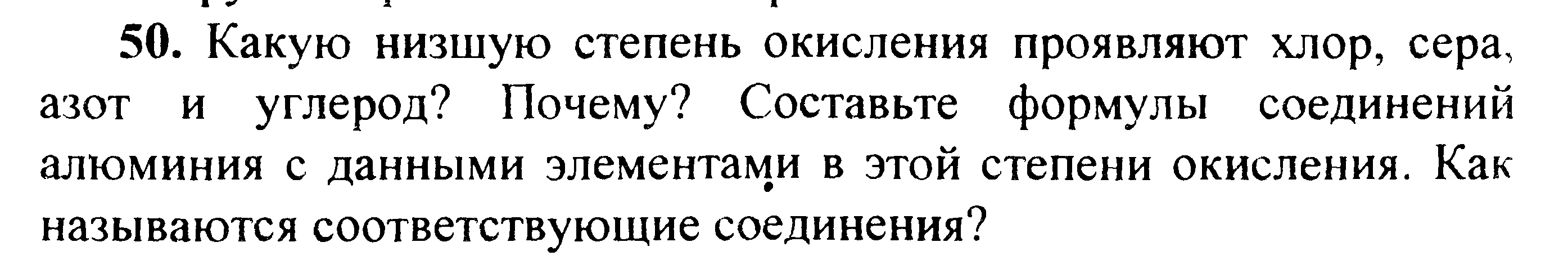    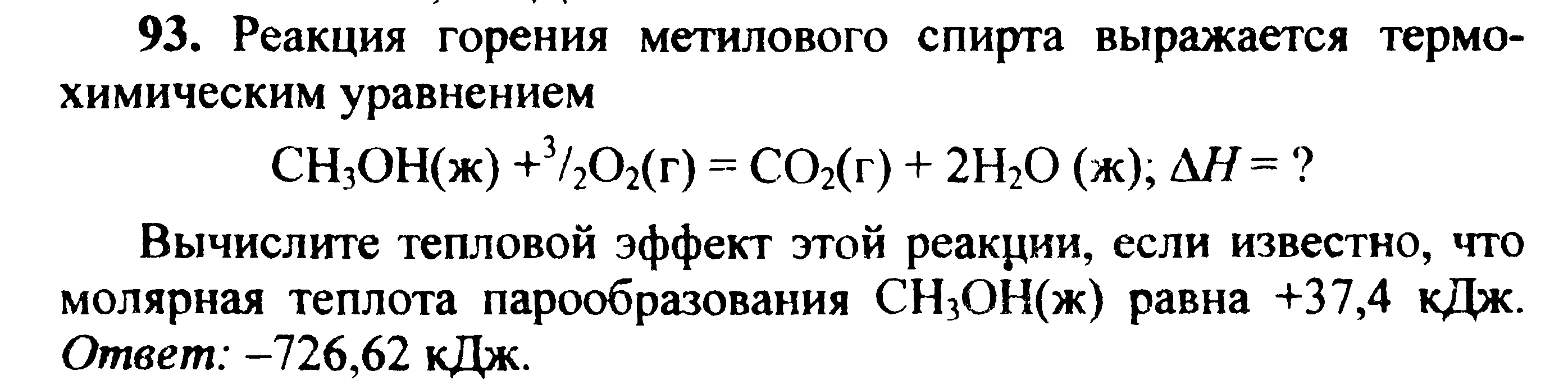 Задание 93. http://buzani.ru/zadachi/khimiya-shimanovich/913-termokhimicheskie-uravneniya-teplota-obrazovaniya-zadanie-88-94 Реакция горения метилового спирта выражается термохимическим уравнением: СН3ОН (ж) +3/2О2 (г) = СО2 (г) + 2Н2О (ж); Вычислите тепловой эффект этой реакции, если известно, что молярная теплота парообразования СН3ОН (ж) равна +37,4 кДж. Ответ: -726,62 кДж. Решение: (СН3ОН (ж)) = (СН3ОН (г)); +37,4 кДж = -201,17 - Значения стандартных теплот образования веществ приведены в специальных таблицах. Учитывая, что теплоты образования простых веществ условно приняты равными нулю. Тепловой эффект реакции можно вычислить, используя следствие из закона Гесса: Ответ: -726,62 кДж.  Задание 114. http://buzani.ru/zadachi/khimiya-shimanovich/916-ravnovesie-sistemy-energiya-gibbsa-entropiya-zadacha-108-114 Какие из карбонатов СаСО3 или ВаСО3 - можно получить при взаимодействии соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив Решение: Значения а) ВеО (к) + СО2 (г) = ВеСО3 (к) Находим: То, что а) ВаО (к) + СО2 (г) = ВаСО3 (к) Находим: То, что в) СаО (к) + СО2 (г) = СаСО3 (к) Находим: То, что Ответ: +31,24 кДж; -130,17 кДж; -216,02 кДж. 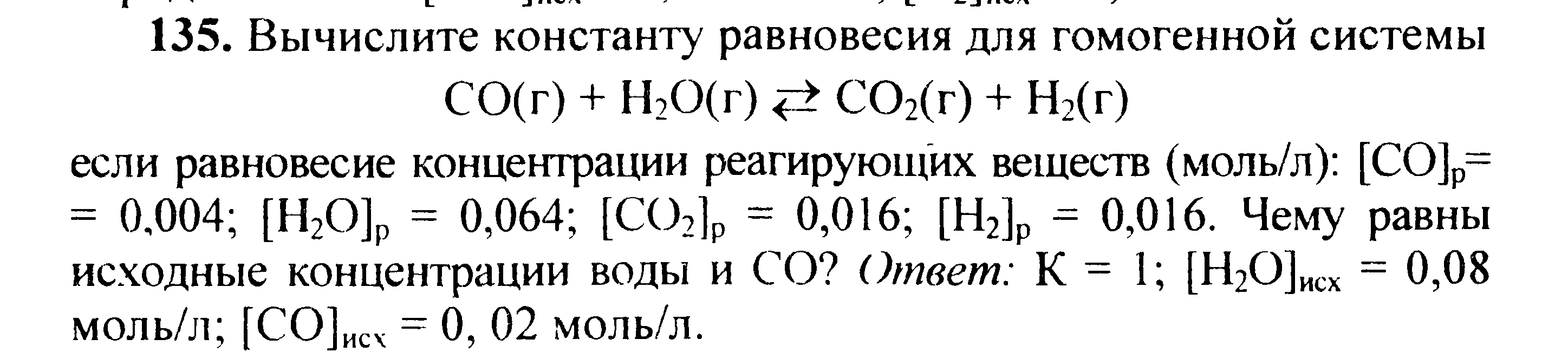  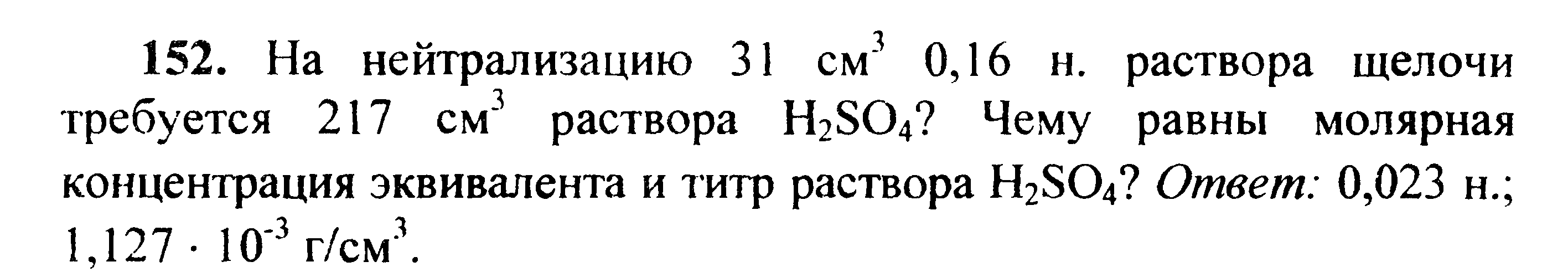 задание 152. http://buzani.ru/zadachi/khimiya-shimanovich/922-kontsentratsiya-rastvora-zadanie-149-154 На нейтрализацию 31 см3 0,16Н. раствора щелочи требуется 217 см3 раствора Н2SO4? Чему равны молярная концентрация эквивалента и титр раствора Н2SO4? Ответ: 0,023Н.; 1,128 . 10-3 г/см3. Решение: Согласно закону эквивалентов: СН (1)V(1) = СН (2)V(2) Значит, объёмы реагирующих растворов обратно пропорциональны эк этих растворов. Исходя из этого, находим нормальность раствора AgNO3: а) Молярная концентрация эквивалента (или нормальность) показывает число эквивалентов растворенного вещества, содержащихся в 1 л раствора. СН(Н2SO4) =0,023Н. б) Титром раствора называют число граммов растворенного вещества в 1 см3 (мл) раствора. Находим массу Н2SO4 в 1л раствора по формуле: m(B) = CН(В) . МЭ(В) = 0,023 .49,04 = 1,128 г. Так как в 1 л раствора содержится 1,128 г кислоты, то Т (H2SO4) = 1,128/1000 = 1,128 . 10-3 г/см3. Ответ: 0,023 н.; 1,128 .10-3 г/см3.  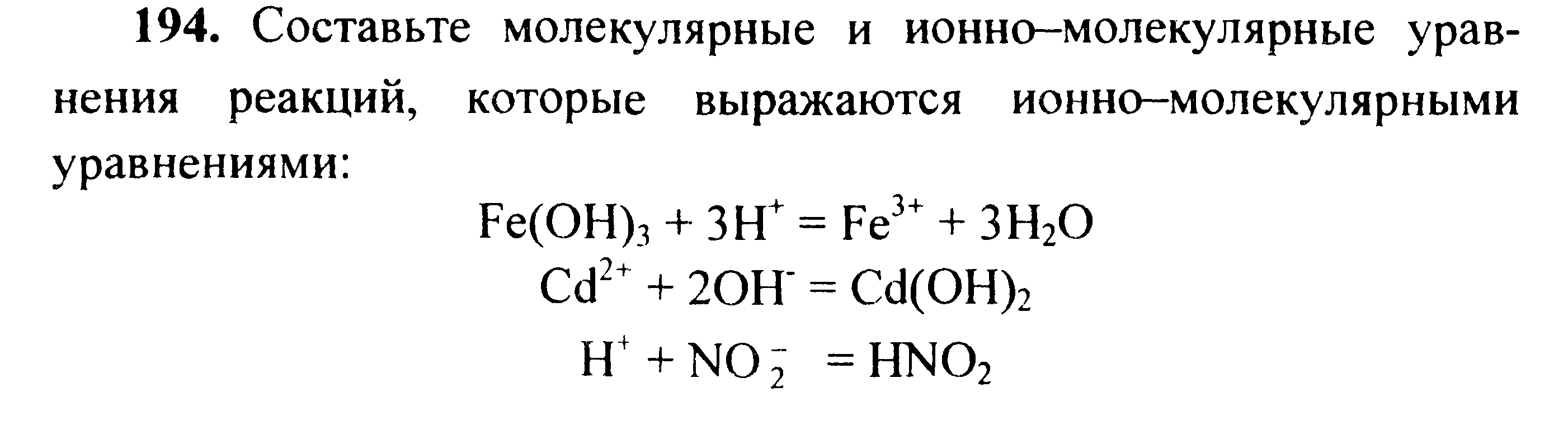   Задание 205. http://buzani.ru/zadachi/khimiya-shimanovich/931-gidroliz-solej-zadaniya-201-210 К раствору Nа2СО3 добавили следующие вещества: a)HCl; б)NaOH; в) Cu(NО3)2; г)K2S. В каких случаях гидролиз карбоната натрия усилится? Почему? Составьте ионно-молекулярные уравнения гидролиза соответствующих солей. Решение: а) Соль Na2CO3 гидролизуется по аниону, а HCl диссоциирует в водном растворе: Na2CO3 ⇔ 2Na+ + CO32-; CO32- + H2O ⇔ HCO3- + ОH-; HCl ⇔ H+ + Cl- Если растворы этих веществ находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- ⇔ Н2О). При этом гидролитическое равновесие соли Na2CO3 и диссоциация HCl сдвигаются вправо и гидролиз соли и диссоциация кислоты идут до конца с образованием газообразного углекислого газа. Ионно-молекулярное уравнение процесса: CO32- + 2Н+ ⇔ СО2↑ + Н2О Молекулярное уравнение процесса: Na2CO3 + 2HCl ⇔ 2NaCl + СО2↑ + Н2О б) Соль Na2CO3 гидролизуется по аниону, а NaOH диссоциирует в водном растворе: CO32- + H2O ⇔ HCO3- + ОH-; NaOH ⇔ Na+ + OH-. Если растворы этих веществ смешать, то образуется избыток ионов ОН-, что сдвигает равновесие гидролиза Na2CO3 влево и гидролиз соли будет угнетаться. в) Соль Na2CO3 гидролизуется по аниону, а соль Cu(NO3)2 – по катиону: CO32- + H2O ⇔ HCO3- + ОH-; Сu2++ H2O ⇔ CuOH+ + H+. Если растворы этих солей находятся в одном сосуде, то идёт взаимное усиление гидролиза каждой из них, ибо ионы Н+ и ОН-, связываясь друг с другом, образуют молекулы слабого электролита Н2О (Н+ + ОН- ⇔ Н2О). При образовании дополнительного количества воды гидролитическое равновесие обеих солей сдвигается вправо, и гидролиз каждой соли идёт до конца с образованием осадка и газа: Cu2+ + CO32- + H2O ⇔ Cu(OH)2↓ + CO2↑ (ионно-молекулярная форма); Cu(NO3)2 + Na2CO3 + Н2О ⇔ Cu(OH)2↓ + CO2↑ + 2NaNO3 (молекулярная форма). г) Na2CO3 и К2S - соли сильного основания и слабой кислоты, поэтому обе гидролизуются по аниону: CO32- + H2O ⇔ HCO3- + ОH-; S2- + H2O ⇔ HS- + OH-. Если растворы этих солей находятся в одном сосуде, то идёт взаимное угнетение гидролиза каждой из них, ибо избыток ионов ОН-, согласно принципу Ле Шателье, смещает равновесие гидролиза обеих солей влево, в сторону уменьшения концентрации ионов ОН-, т. е. гидролиз обеих солей будет угнетаться. КР № 2 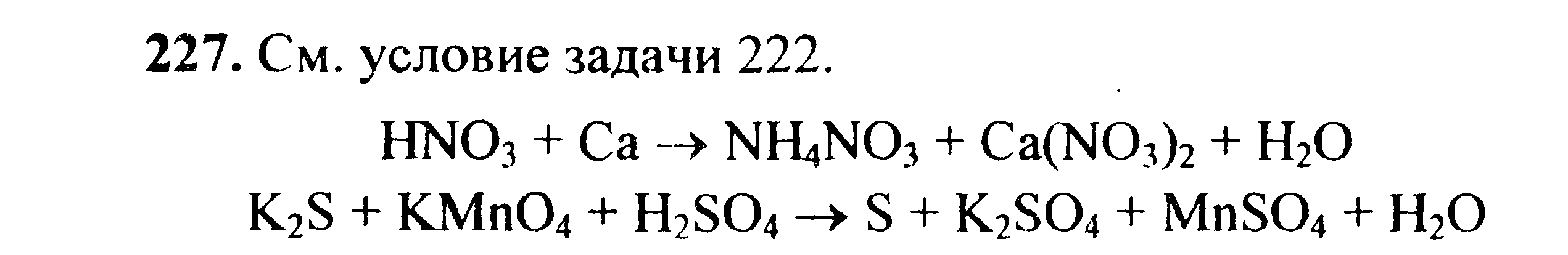  Задание 227. http://buzani.ru/zadachi/khimiya-shimanovich/935-okislitelno-vosstanovitelnye-reaktsii-zadaniya-226-230 Реакции выражаются схемами: HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O; K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O Составьте электронные уравнения. Расставьте коэффициенты в уравнениях реакций. Для каждой реакции укажите, какое вещество является окислителем, какое - восстановителем; какое вещество окисляется, какое - восстанавливается. Решение: Если в условии задачи даны как исходные вещества, так и продукты их взаимодействия, то написание уравнения реакции сводится, как правило, к нахождению и расстановке коэффициентов. Коэффициенты определяют методом электронного баланса с помощью электронных уравнений. Вычисляем, как изменяют степень окисления восстановитель и окислитель, и отражаем это в электронных уравнениях. Коэффициенты для восстановителя и окислителя идентичны для продуктов окисления и восстановления. . Коэффициент перед веществами, атомы которых не меняют свою степень окисления, находят подбором. а) HNO3 + Ca ⇔ NH4NO3 + Ca(NO3)2 + H2O Уравнения электронного баланса: Ионно-молекулярное уравнение: 4Са0 + N5+ = 4Са2+ + N3- Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов восемь. Разделив это число на 8, получаем коэффициент 1 для окислителя и продукта его восстановления, а при делении 8 на 2 получаем коэффициент 4 для восстановителя и продукта его окисления. Молекулярное уравнение реакции: 10HNO3 + 4Ca ⇔ NH4NO3 +4Ca(NO3)2 + 3H2O В данной реакции: Са – восстановитель, HNO3 – окислитель; Са окисляется до Ca(NO3)2, HNO3 – восстанавливается до NH4NO3. б) K2S + KMnO4 +Н2SO4 ⇔ S + K2SO4 + MnSO4 + H2O Уравнения электронного баланса: 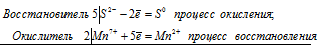 Ионно-молекулярное уравнение: 5S2- + 2Mn7+ = 5S0 + 2Mn2+ Общее число электронов, отданных восстановителем, должно быть равно числу электронов, которые присоединяет окислитель. Общее наименьшее кратное для отданных и принятых электронов десять. Разделив это число на 5, получаем коэффициент 2 для окислителя и продукта его восстановления, а при делении 10 на 2 получаем коэффициент 5 для восстановителя и продукта его окисления. Молекулярное уравнение реакции: 5K2S + 2KMnO4 + 8Н2SO4 ⇔ 5S + 6K2SO4 + 2MnSO4 + 8H2O В данной реакции: К2S – восстановитель, KMnO4 – окислитель; К2S окисляется до К2SO4, KMnO4 – восстанавливается до MnSO4.  Задание 245. http://buzani.ru/zadachi/khimiya-shimanovich/938-elektrodnye-potentsialy-metallov-zadaniya-241-245 Марганцевый электрод в растворе его соли имеет потенциал -1,23 В. Вычислите концентрацию ионов Мn2+ (моль/л). Ответ. 1,89 . 10-2 моль/л. Решение: Электродный потенциал металла (Е) зависит от концентрации его ионов в растворе. Эта зависимость выражается уравнением Нернста: Е0 – стандартный электродный потенциал металла; n – число электронов, принимающих участие в процессе; с – концентрация ионов металла в растворе его соли (при точных вычислениях – активность). Так как уменьшение потенциала цинка равно 0,015 В, то используя уравнение Нернста, получим выражение для расчета концентрации ионов Mn2+ в растворе: 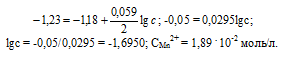 Ответ. 1,89 . 10-2 моль/л.  Задание 269. http://buzani.ru/zadachi/khimiya-shimanovich/944-elektroliz-electrolysis-uravnenie-faradeya-zadaniya-268-270 Электролиз раствора СuSO4 проводили с медным анодом в течение 4 ч при силе тока 50 А. При этом выделилось 224 г меди. Вычислите выход по току (отношение массы выделившегося вещества к теоретически возможной). Составьте электронные уравнения процессов, происходящих на электродах в случае медного и угольного анодов. Ответ: 94,48%. Решение: Массу теоретического выхода меди вычислим из уравнения Фарадея, имея в виду, что 4 ч = 14400 с и МЭ(Cu) = 31,77 г/моль, получим: m(Cu) = МЭ(В) . I . t/F = 31,77 .50 .14400/96500 = 237,04 г. Здесь m(B) – масса выделившегося вещества, г; МЭ(В) – масса эквивалента вещества, г/моль; I – сила тока, А; t – время, с; F – число Фарадея, 96500 Кл/моль. Выход по току (отношение массы выделившегося вещества к теоретически возможной) равен: Стандартный электродный потенциал системы Cu2+ + 2 Cu2+ + 2 На аноде будет происходить электрохимическое окисление воды, приводящее к выделению кислорода: 2Н2О - 4 поскольку, отвечающий этой системе стандартный электродный потенциал (+1,23 В) значительно ниже, чем стандартный электродный потенциал (+2,01 В), характеризующий систему: 2SO42- - 2 При электролизе медного купороса на медном аноде на катоде будет электрохимическое восстановление меди Cu2+. На аноде будет происходить электрохимическое окисление меди, приводящее к выделению в анодное пространство ионов Cu2+, поскольку отвечающий этой системе стандартный электродный потенциал (+0,34 В) значительно ниже, чем стандартный потенциал (+1,23 В), характеризующий систему 2Н2О - 4 т. е. в данном случае при электролизе будет происходить растворение медного анода и отложение меди на катоде. Электрохимические процессы при данном типе электролиза: Катод: Cu2+ + 2 Анод: Cu0 - 2 Ответ: m% = 94,49%.  Задание 285. http://buzani.ru/zadachi/khimiya-shimanovich/951-zashchita-metallov-ot-korrozii-zadachi-284-286 В чем сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. Решение: Для предотвращения коррозии стальных конструкций применяется протекторная защита: создаётся электрический контакт защищаемой конструкции с протектором – более активным металлом (обычно Zn, Mg, Al или их сплавы). При таком контакте возникает гальваническая пара типа Zn — Fe и коррозии подвергается протектор, а не сама стальная конструкция (трубопровод, корпус корабля и т.п.). Например, корпус корабля защищают протектором – цинковые брусья, которые крепят в нескольких местах днища корабля. Под действием морской воды и кислорода цинк разрушается, а корпус корабля защищается, таким образом, от коррозии. При этом протекают следующие электрохимические процессы: Анодный процесс:Zn0 - 2 Катодный процесс: а) в нейтральной или щелочной среде: 1/2O2 + H2O + 2 б) в кислой среде: 1/2O2 + 2H+ + 2 Таким образом, цинк разрушается, окисляясь до ионов Zn2+, которые с гидроксильными ионами образуют нерастворимый гидроксид Zn(OH)2 или в виде ионов Zn2+ уходит в раствор, если реакция среды кислая. Основной металл остаётся неповреждённым. 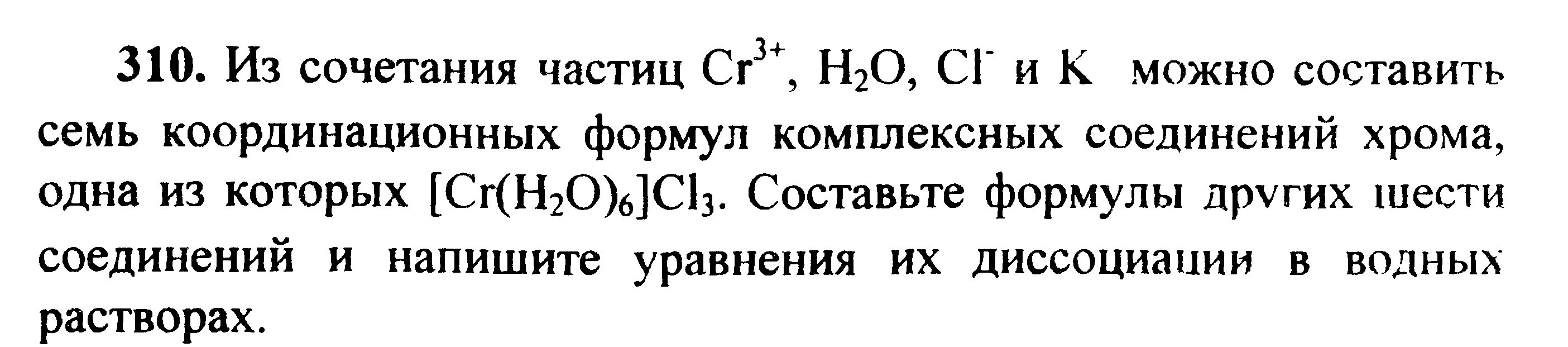 Задание 310 http://buzani.ru/zadachi/khimiya-shimanovich/961-formuly-kompleksnykh-soedinenij-zadachi-310-311-317 Из сочетания частиц Сг3+, Н2О, Сl- и K+ можно составить семь координационных формул комплексных соединений хрома, одна из которых [Сг(Н2O)6]Сl3. Составьте формулы других шести соединений и напишите уравнения их диссоциации в водных растворах. Решение: Формулы комплексных соединений: 1. [Сr(H2O)6]Cl3 – хлорид гексааквахрома(III); 2. [Сr(H2O)5Cl]Cl2 – хлорид лоропентааквахрома(III); 3. [Сr(H2O)4Cl2]Cl – хлорид дихлоротетрааквахрома(III); 4. [Сr(H2O)3Cl3] – трихлоротриаквахром; 5. К[Сr(H2O)2Cl4] – тетрахлородиаквахромат(III) калия; 6. К2[Сr(H2O)Cl5] – пентахромоаквахромат(III) калия; 7. К3[СrCl6]- гексахлорохромат(III) калия. Уравнения диссоциации комплексных соединений: 1. [Сr(H2O)6]Cl3 ⇔ [Сr(H2O)6]3+ + 3Сl-; 2. [Сr(H2O)5Cl]Cl2 ⇔ [Сr(H2O)5Cl]2+ + 2Cl-; 3. [Сr(H2O)4Cl2]Cl ⇔ [Сr(H2O)4Cl2]- +Cl- 4. [Сr(H2O)3Cl3] – неэлектролит, поэтому не диссоциирует; 5. К[Сr(H2O)2Cl4] ⇔ К+ + [Сr(H2O)2Cl4]-; 6. К2[Сr(H2O)Cl5] ⇔ 2К+ + [Сr(H2O)Cl5]2-; 7. К3[СrCl6] ⇔ 3К+ + [СrCl6]3-.   Задание 345 http://buzani.ru/zadachi/khimiya-shimanovich/966-zhestkost-vody-i-metody-ee-ustraneniya-zadachi-344-346 Какую массу карбоната натрия надо прибавить к 400 л воды, чтобы устранить жесткость, равную 3 ммоль/л. .Ответ: 63,6 г. Решение: Молярная масса эквивалента Na2CO3 = M/2 = 106/2 = 53 г/моль. Массу карбоната натрия, необходимую для устранения жёсткости находим из формулы: Ж = m(В)/[MЭ(В).V], где m – масса вещества В, обуславливающая жёсткость воды, мг; MЭ(В) – молярная масса эквивалента вещества В, мг/моль; V – объём воды, л. Отсюда m(В) = Ж . MЭ(В) . V; m(Na2CO3) = 3 . 53.400 = 63600 мг или 63,6 г. Ответ: 63,6 г. 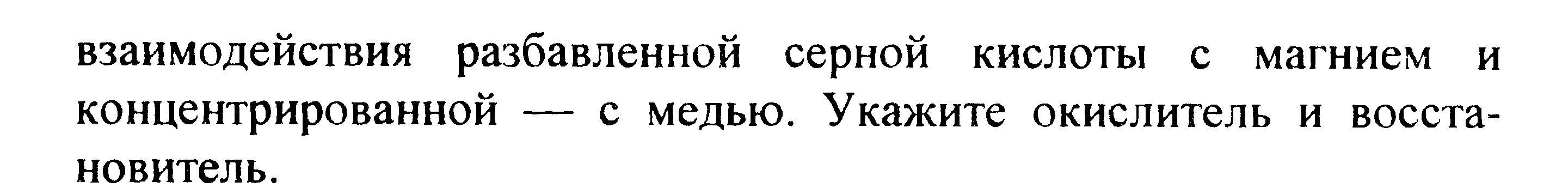 Задание 375 http://buzani.ru/zadachi/khimiya-shimanovich/983-svojstva-mineralnykh-kislot-zadaniya-372-375-384 Какие свойства в окислительно-восстановительных реакциях проявляет серная кислота? Напишите уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью. Укажите окислитель и восстановитель. Решение: Серная кислота обладает окислительными свойствами, если её концентрация превышает 70%. Только при концентрации больше 70% принято говорить о специфических свойствах H2SO4 как окислителя. Серная кислота проявляет окислительные свойства, потому что атом серы в ней находится в своей высшей степени окисления +6 и может только присоединять электроны, т.е. уменьшать свою степень окисления. Разбавленная серная кислота в реакциях с металлами, стоящими в ряду напряжений металлов левее водорода, взаимодействует с ними с выделением водорода. При этом происходит изменение степени окисления атомов водорода, образующих ион Н+, а не атомов серы. С металлами, стоящими в ряду напряжений правее водорода разбавленная серная кислота не взаимодействует. Уравнения реакций взаимодействия разбавленной серной кислоты с магнием и концентрированной - с медью: а) взаимодействие разбавленной серной кислоты с магнием: Уравнения электронного баланса: 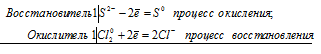 Ионно-молекулярное уравнение: Mg0 + 2H+ = Mg2+ + H20 Молекулярное уравнение реакции: Mg0 + H2SO4 = MgSO4+ H2↑ Магний увеличивает свою степень окисления от 0 до +2, т. е. является восстановителем, а водород окислитель, потому что уменьшает свою степень окисления от +1 до 0. б) взаимодействие концентрированной серной кислоты с медью: Уравнения электронного баланса: 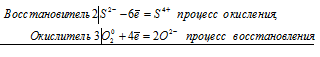 Ионно-молекулярное уравнение: Cu0 + S6+ = Cu2+ + S4+ Молекулярное уравнение реакции: Cu + 2H2SO4 = CuSO4+ SO2↑ + 2H2O  Задание 395 http://buzani.ru/zadachi/khimiya-shimanovich/995-kompleksnye-iony-rtuti-i-serebra-zadaniya-395-397-730-g При постепенном прибавлении раствора КI к раствору Нg(NO3)2 образующийся вначале осадок растворяется. Какое комплексное соединение при этом получается? Составьте молекулярные и ионно-молекулярные уравнения соответствующих реакций. Решение: При постепенном прибавлении раствора KI к раствору Нg(NO3)2 образуется осадок йодида ртути: 2KI + Hg(NO3)2 = HgI2↓ + 2KNO3 (молекулярная форма); 2I- + Hg2+ = HgI2↓ (ионно-молекулярная форма) Образовавшийся осадок HgI2 растворяется в избытке КI, потому что образуется комплексный ион [HgI4]2-: HgI2 + 2KI = K2[HgI4] (молекулярная форма); HgI2 +2I- = [HgI4]2- (ионно-молекулярная форма)   Задание 435(ш) http://buzani.ru/zadachi/organicheskaya-khimiya/1002-dienovye-uglevodorody-diolefiny-ili-alkadieny-zadaniya-435-sh-438-sh-444-sh Полимером какого непредельного углеводорода является натуральный каучук? Напишите структурную формулу этого углеводорода. Как называют процесс превращения каучука в резину? Чем по строению и свойствам различаются каучук и резина? Решение: Натуральный каучук является полимером изопрена (2-метилбутадиен-1,3). Структурная формула изопрена имеет вид: 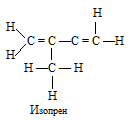 Каучук представляет собой полимер, макромолекула которого построена из периодически повторяющихся углеводородных групп (изопреновых для натурального каучука). При большой длине молекулы энергетически наиболее выгодна скрученная форма молекулы. При наложении внешней силы молекулы частично распрямляются, но при снятии напряжения снова стараются прийти в исходное состояние, этим объясняется эластичность полимерной цепи каучука. Молекулярная масса каучука около 1 500 000, однако, цифра эта является усреднённой молекулярной массой, поскольку каучук представляет собой смесь однотипно построенных молекул с различной длиной цепи. Процесс превращения каучука в резину называют вулканизацией. В результате обработки серой, хлоридом серы (I) S2Cl2 или другими серосодержащими веществами каучук вулканизируется – превращается в эластичную массу, называемую вулканизованным каучуком или резиной (0,5-5% серы). Вулканизация обусловлена образованием мостикоподобных связей (—S— и —S—S—) между отдельными линейными цепями каучука, что приводит к утрате им пластичности, но увеличению прочности, эластичности и т.д. При большом числе таких мостиков образуется твёрдый вулканизат – эбонит (30-50% серы). http://reshchem.ucoz.ru/load/obshchaya_i_neorganicheskaya_himiya/shimanovich_i_l_himiya_metodicheskie_ukazaniya_programma_reshenie_tipovyh_zadach_2003_g/4-44 |
