Химия. Контрольная работа вар. №23. Задание Для элемента с порядковым номером 27
 Скачать 56.55 Kb. Скачать 56.55 Kb.
|
|
КОНТРОЛЬНАЯ РАБОТА ДЛЯ СТУДЕНТОВ ЗАОЧНОЙ ФОРМЫ ОБУЧЕНИЯ Вариант 23 СТРОЕНИЕ АТОМА Задание 1. Для элемента с порядковым номером 27 укажите месторасположение в Периодической системе (номер периода, номер группы, обозначение подгруппы); элемент с порядковым номером 27 находится в 4 периоде, 8 побочной группе напишите полную электронную формулу; электроны располагаются на 4 энергетических уровнях 1s2 2s2 2p6 3s2 3p6 3d7 4s2 распределите валентные электроны по квантовым ячейкам. 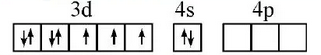 Задание 2. По распределению валентных электронов 5s25p3 определите элемент и напишите электронную формулу атома. Элемент находится в 5 периоде и 5 главной группе. Валентные электроны, количество 5, располагаются на внешнем 5 энергетическом уровне. Это элемент сурьма. 1s22s22p63s23p64s23d104p65s24d105p3. КЛАССЫ НЕОРГАНИЧЕСКИХ СОЕДИНЕНИЙ РАСТВОРЫ ЭЛЕКТРОЛИТОВ Задание 3 а) Рассчитайте объем исходного раствора H2SO4 С= 60 %, = 1,5 г/мл, необходимый для приготовления 5000 мл заданного С= 12 %, = 1,08 г/мл Решение. Вычислим молярную концентрацию растворов 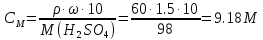 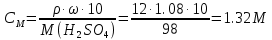 Используя закон разбавления C1∙V1 = C2V2 V1 = 5000 ∙ 10−3 ∙ 1.32 / 9.18 = 0.72 л или 720 мл Ответ. V = 720 мл б) Рассчитайте молярную концентрацию раствора Na2CO3 процентной концентрации 10%, = 1,10 г/мл Вычислим молярную концентрацию растворов 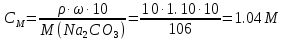 Ответ. СМ = 1,04 М Задание 4. Для предложенных соединений
напишите уравнения их диссоциации NaHCO3 ↔ Na+ + HCO3− как сильный электролит HCO3− ↔ H+ + CO32− диссоциация слабого электролита Гидроксид марганца слабый электролит, диссоциирует ступенчато Mn(OH)2 ↔ MnOH+ + OH− MnOH+ ↔ Mn2+ + OH− Cd(NO3)2 ↔ Cd2+ + 2NO3− напишите молекулярные и ионные уравнения возможных реакций взаимодействия с H2SO4 и NaOH. 2NaHCO3 + H2SO4 = Na2SO4 + 2CO2↑ + 2H2O 2Na+ + 2HCO3− + 2H+ + SO42− = 2Na+ + SO42− + 2CO2↑ + 2H2O HCO3− + H+ = CO2↑ + H2O NaOH + NaHCO3 = Na2CO3 + H2O Na+ + OH− + Na+ + HCO3− = 2Na+ + CO32− + H2O OH− + HCO3− = CO32− + H2O Mn(OH)2↓ + H2SO4 = MnSO4 + 2H2O Mn(OH)2↓ + 2H+ + SO42− = Mn2+ + SO42− + 2H2O Mn(OH)2↓ + 2H+ = Mn2+ + 2H2O SnO2 + 2NaOH = Na2SnO3 + H2O SnO2 + 2Na+ + 2OH− = 2Na+ + SnO32− + H2O SnO2 + 2OH− = SnO32− + H2O SnO2 + 2NaOH + 2H2O = Na2[Sn(OH)6] SnO2 + 2Na+ + 2OH− + 2H2O = 2Na+ + [Sn(OH)6]2− SnO2 + 2OH− + 2H2O = [Sn(OH)6]2− SO3 + 2NaOH = Na2SO4 + H2O SO3 + 2Na+ + 2OH− = 2Na+ + SO42− + H2O SO3 + 2OH− = SO42− + H2O Cd(NO3)2 + 2NaOH = Cd(OH)2↓ + 2NaNO3 Cd2+ + 2NO3− + 2Na+ + 2OH− = Cd(OH)↓ + 2Na+ + 2NO3− Cd2+ + 2OH− = Cd(OH)2↓ Задание 5. Выберите пары веществ, для которых возможны взаимодействия напишите молекулярные и ионные уравнения возможных реакций Ca(OH)2 + N2O5 = Ca(NO3)2 + H2O Ca2+ + 2OH− + N2O5 = Ca2+ + 2NO3− + H2O 2OH− + N2O5 = 2NO3− + H2O 3CaCl2 + 2Na3PO4 = Ca3(PO4)2↓ + 6NaCl 3Ca2+ + 6Cl− + 6Na+ + 2PO43− = Ca3(PO4)2↓ + 6Na+ + 6Cl− 3Ca2+ + 2PO43− = Ca3(PO4)2↓ MnO + Ca(OH)2 основные оксиды с растворами щелочей не реагируют SnO2 + H2O реакция не происходит, образуется нерастворимый гидроксид Задание 6. Напишите молекулярные и ионные уравнения реакций для превращений: Na2S →H2S→NaHS→Na2S Na2S + 2HCl = 2NaCl + H2S 2Na+ + S2− + 2H+ + 2Cl− = 2Na+ + 2Cl− + H2S 2H+ + S2− = H2S NaOH + H2S = NaHS + H2O Na+ + OH− + H2S = Na+ + HS− + H2O H2S + OH− = HS− + H2O NaHS + NaOH = Na2S + H2O Na+ + HS− + Na+ + OH− = 2Na+ + S2− + H2O HS− + OH− = S2− + H2O FeCl3→FeOHCl2→ FeCl3 FeCl3 + H2O = FeOHCl2 + HCl Fe3+ + 3Cl− + H2O = FeOH2+ + 2Cl− + H+ + Cl− Fe3+ + H2O = FeOH2+ + H+ FeOHCl2 + HCl = FeCl3 + H2O FeOH2+ + H+ + Cl− = Fe3+ + 3Cl− + H2O FeOH2+ + H+ = Fe3+ + H2O Задание 7. Для указанного взаимодействия: Допишите правую часть краткого ионного уравнения; Составьте соответствующее молекулярное и ионное уравнения реакции. HPO42− + H+ = H2PO4− 2Na+ + HPO42− + H+ + Cl− = Na+ + H2PO4− + Na+ + Cl− Na2HPO4 + HCl = NaH2PO4 + NaCl Задание8. Рассчитайте молярную концентрацию ионов H+, OH– и рН в заданном растворе электролита (α =100%). KOH 10–2 моль/л KOH ↔ K+ + OH− [ОH-] = CM ∙ α = 10−2 ∙ 1 = 10−2 моль/л pOH = -lg [OH-] = -lg 10-2 = 2 pH = 14 – pOH = 14 – 2 = 12 [H+] = 10-pH = 10-12 моль/л Задание9. а) Рассмотрите возможность протекания гидролиза в каждом из предложенных растворов солей. Укажите область значений рН растворов (>, ≈, < 7), ответ подтвердите молекулярными и ионными уравнениями гидролиза. NiSO4 соль получена слабым основанием и сильной кислотой, гидролиз по катиону 2NiSO4 + 2H2O = (NiOH)2SO4 + H2SO4 2Ni2+ + 2SO42− + 2H2O = 2NiOH+ + SO42− + 2H+ + SO42− Ni2+ + H2O = NiOH+ + H+ pH < 7, кислая среда K3PO4 – соль получена сильным основанием и слабой кислотой, гидролиз по аниону K3PO4 + H2O = K2HPO4 + KOH 3K+ + PO43− + H2O = 2K+ + HPO42− + K+ + OH− PO43− + H2O = HPO42− + OH− pH > 7, кислая щелочная Sr(NO3)2 соль получена слабым основанием и сильной кислотой, гидролиз по катиону Sr(NO3)2 + H2O = SrOHNO3 + HNO3 Sr2+ + 2NO3− + H2O = SrOH+ + NO3− + H+ + NO3− Sr2+ + H2O = SrOH+ + H+ pH < 7, кислая среда б) Определите, в какой из систем возможен необратимый гидролиз. Запишите уравнения совместного гидролиза солей в молекулярной и ионной форме Cr2(SO4)3 и CdCl2 обе соли поддаются гидролизу по катиону, поэтому совместный гидролиз не возможен. 2NH4Cl + Na2S + 2H2O = 2NH4OH + H2S + 2NaCl 2NH4+ + 2Cl− + 2Na+ + S2− + 2H2O = 2NH4OH + H2S + 2Na+ + 2Cl− 2NH4+ + S2− + 2H2O = 2NH4OH + H2S Na2SiO3 и K3PO4 обе соли поддаются гидролизу по аниону, поэтому совместный гидролиз не возможен. CaCl2 + Na2CO3 + H2O = Ca(OH)2 + CO2 + 2NaCl Ca2+ + 2Cl− + 2Na+ + CO32− + H2O = Ca(OH)2 + CO2 + 2Na+ + 2Cl− Ca2+ + CO32− + H2O = Ca(OH)2 + CO2 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Задание 10. Определите степени окисления указанных элементов и их роли в окислительно-восстановительных реакциях (только окислитель, только восстановитель, и окислитель и восстановитель): Cl2 данная частица имеет промежуточную степень окисления 0, поэтому обладает окислительно-восстановительными свойствами. SO42– Cr2O72– сера и хром имеют максимальную степень окисления +6, поэтому данная частица имеет только окислительные свойства. Задание 11. Напишите уравнения полуреакций, ионные и молекулярные уравнения реакций, соответствующих превращениям: MnSO4+ Cl2 + KOH MnO42–+ Cl– Укажите окислитель, восстановитель и полуреакции окисления и восстановления. K2MnO4 + H2O MnO2 + MnO4– MnO42− – e = MnO4− | 2 | восстановитель, процесс окисление MnO42− + 2H2O + 2e = MnO2 + 4OH− |1| окислитель, процесс восстановление 2MnO42− + MnO42− + 2H2O = 2MnO4− + MnO2 + 4OH− 3K2MnO4 + 2H2O = MnO2 + 2KMnO4 + 4KOH MnSO4+ Cl2 + KOH MnO42–+ Cl– Mn2+ + 8OH- - 4e = MnO42− + 4H2O | 1 | восстановитель, процесс окисление Cl2 + 2e = 2Cl− |2| окислитель, процесс восстановление Mn2+ + 8OH− + 2Cl2 = MnO42− + 4H2O + 4Cl− MnSO4 + 2Cl2 + 8KOH = K2MnO4 + 4H2O + 4KCl + K2SO4 Задание12. Напишите уравнения полуреакций, ионные и молекулярные уравнения реакций в заданной системе: Be + HNO3(РАЗБ) Be0 – 2e = Be2+ | 5 | восстановитель, процесс окисление 2NO3− + 12H+ + 10e = N2 + 6H2O |1| окислитель, процесс восстановление 5Be + 2NO3− + 12H+ = 5Be2+ + N2 + 6H2O 5Be + 12HNO3 = 5Be(NO3)2 + N2 + 6H2O Задание13. Рассмотрите коррозию гальванопары Zn | Cu в щелочной среде с добавлением кислорода (NaOH + H2O + O2). Используя значения электродных потенциалов, определите анод, катод и деполяризатор. Напишите уравнения анодной и катодной полуреакций, ионные и молекулярные уравнения коррозии. Сравниваем потенциалы металлов. Разрушаться (окисляться) будет металл с более отрицательным потенциалом (более сильный восстановитель). Сравниваем стандартные потенциалы: ЕоZn2+/Zn< ЕоCu2+/Cu (A): Zn → Zn2+ + 2 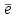 - 0,76 < + 0,34 Вывод: При электрохимической коррозии будет в первую очередь окисляться цинк. Определяем равновесные потенциалы окислителей в заданной среде: рН = 12 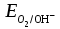 ≈ 1,23 – 0,059рН ≈ 0,522 В ≈ 1,23 – 0,059рН ≈ 0,522 В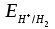 ≈ – 0,059рН ≈ -0,708В ≈ – 0,059рН ≈ -0,708ВСравниваем значения потенциалов окислителей и металла, делаем вывод о возможности данного процесса коррозии - 0,76 < 0,522 возможна коррозия Zn с поглощением кислорода - 0,76 < -0,708 возможна коррозия Zn с выделением водорода Уравнения возможных коррозионных процессов на анодных и катодных участках: (A): Zn → Zn2+ + 2 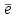 (К): 2H+ + 2 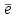 → H2 → H2 O2 + 4H+ + 4 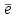 → 2H2O → 2H2O Задание 14. Напишите уравнения катодного и анодного процессов, протекающих при электролизе водного раствора FeSO4 (электроды инертные). Электролиз раствора сульфата железа: FeSO4 ↔ Fe2+ + SO42− На катоде могут разряжаться вода и катионы железа, Fe+2 + 2e = Fe0 E0 = -0.44 B 2H2O + 2e = H2 + 2OH− E0 = -0.828 B Конкурирующими анодными реакциями являются окисление воды, и окисление сульфат – иона. Идёт окисление воды 2H2O – 4e = 4H+ + O2 E0 = +1.228 B Fe2+ + 2H2O + 2H2O = Fe + H2 + 2OH− + 4H+ + O2 FeSO4 + 2H2O = Fe + H2 + O2 + H2SO4 |
