Молекулярная физика основы зачет. Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода
 Скачать 307 Kb. Скачать 307 Kb.
|
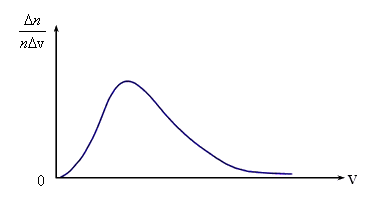
Законы поведения огромного числа молекул, являясь статистическими закономерностями, изучаются с помощью статистического метода Вероятностью события А на- зывается отношение числа благоприятных событию А исходов испытания к общему числу испытаний при стремлении послед- него к бесконечности, т. е.  Случайной называют величину, которая в результате испытания примет одно и только одно числовое значение, зависящее от случайных факторов и заранее непредсказуемое.    Молекулы газа при своем движении постоянно сталкиваются. Скорость каждой молекулы при столкновении изменяется. Она может возрастать и убывать. Однако среднеквадратичная скорость остается неизменной. Это объясняется тем, что в газе, находящемся при определенной температуре, устанавливается некоторое стационарное, не меняющееся со временем распределение молекул по скоростям, которое подчиняется определенному статистическому закону. Скорость отдельной молекулы с течением времени может меняться, однако доля молекул со скоростями в некотором интервале скоростей остается неизменной. Нельзя ставить вопрос: сколько молекул обладает определенной скоростью. Дело в том, что, хоть число молекул очень велико в любом даже малом объеме, но количество значений скорости сколь угодно велико (как чисел в последовательном ряде), и может случиться, что ни одна молекула не обладает заданной скоростью.
Задачу о распределении молекул по скоростям следует сформулировать следующим образом. Пусть в единице объема nмолекул. Какая доля молекул Основываясь на опыте Штерна, можно ожидать, что наибольшее число молекул будут иметь какую-то среднюю скорость, а доля быстрых и медленных молекул не очень велика. Необходимые измерения показали, что доля молекул Аналитически она выражается формулой 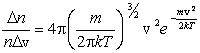
где m – масса молекулы, k – постоянная Больцмана. Наиболее вероятная скорость – это скорость, вблизи которой на единичный интервал скоростей приходится наибольшее число молекул. Она рассчитывается по формуле: 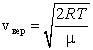
Сопоставляя все три скорости: 1) наиболее вероятную 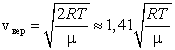 , ,2) среднюю 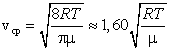 , ,3) среднюю квадратичную 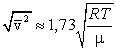 , – видим, что наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная. Относительное число быстрых и медленных молекул мало , – видим, что наименьшей из них является наиболее вероятная, а наибольшей – средняя квадратичная. Относительное число быстрых и медленных молекул мало
 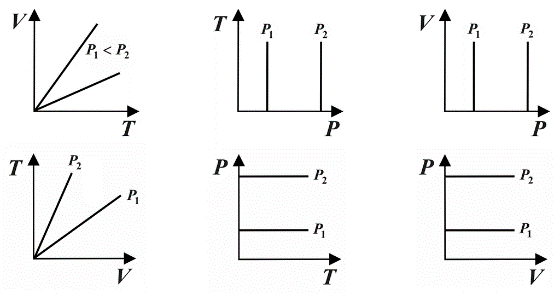  |



 Статистический метод рассматривает параметры движения частиц (например, координата, направление и модуль скорости частицы) как случайные величины, оперирует с усредненными характеристиками системы частиц, с
Статистический метод рассматривает параметры движения частиц (например, координата, направление и модуль скорости частицы) как случайные величины, оперирует с усредненными характеристиками системы частиц, с