КР по белкам. Знать формулы всех ак, уметь писать пептиды Роль белков в организме
 Скачать 400.07 Kb. Скачать 400.07 Kb.
|
|
Теоретические вопросы: Знать формулы всех АК, уметь писать пептиды 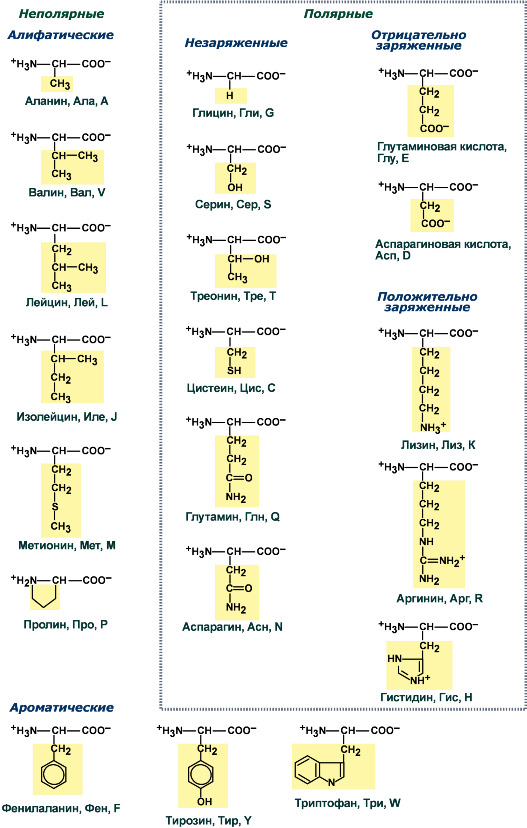 Роль белков в организме: Каталитическая (ферменты) Структурная - вещество соединительной ткани и межклеточный матрикс формируют белки коллаген, эластин, кератин, протеогликаны. - непосредственно участвуют в построении мембран и цитоскелета – спектрин (поверхностный, основной белок цитоскелета эритроцитов), гликофорин. Транспортная - только белки осуществляют перенос веществ в крови, например, липопротеины (перенос жира), гемоглобин (связывание кислорода), гаптоглобин (транспорт гема), трансферрин (транспорт железа). Белки транспортируют в крови катионы кальция, магния, железа, меди и другие ионы. - транспорт веществ через мембраны осуществляют белки - Na+,К+-АТФаза (антинаправленный трансмембранный перенос ионов натрия и калия), Са2+-АТФаза (выкачивание ионов кальция из клетки), глюкозные транспортеры. Рецепторная - функция заключается в избирательном связывании гормонов, биологически активных веществ и медиаторов на поверхности мембран или внутри клеток. Защитная (IG, факторы системы комплемента, белки свертывающей системы, белковая буферная система (поддержание к-щ состояния) Резервная Сократительная (актин, тубулин, миозин) Гормональная - регуляцию и согласование обмена веществ в разных клетках организма осуществляют гормоны. Такие гормоны как инсулин и глюкагон являются белками, все гормоны гипофиза являются пептидами или небольшими белками. Значение процесса переваривания белков - биологический смысл переваривания белков заключается в потере видовой специфичности. Под действием HCL в желудке происходит денатурация белков не подвергшихся терм.обработке, что увеличивает доступность пептидных связей для пептидаз, которые расщепляют их до АК. После этого АК всасываются вторично-активным транспортом при участии 5 транспортных систем в лимфу (часть), кровь (ост.), а оттуда уже в клетки. Для использования в следующих процессах: А) синтезе белков тканей, Е, антител, гормонов и т.д.; Б) = пептидов (глутатион-SH, ансерин, карнозин и др.); В) = небелковых азотсодержащих в-в (Гем, пурины, пиримидины, креатин, холин, NAD+ и др.); Г) биогенных аминов (ГАМК, гистамин и др.); Д) гормонов – производных АК (Т3, Т4, мелатонина, катехоламинов); Е) синтез других АК; Ж) получение энергии через дезаминирование АК. Понятие об азотистом балансе, его виды и значение. Азотистый баланс - это соотношение количества азота, поступившего в организм с пищей и выделенного из него. Так как основным источником азота в организме является белок, то по азотистому балансу можно судить о соотношении количества поступившего и разрушенного в организме белка. Количество азота, поступившего с пищей, всегда больше количества усвоенного азота, так как часть его теряется с калом. Если скорость синтеза белков равна скорости их распада, наступает азотистое равновесие. Если синтез белков превышает скорость их распада, то количество выводимого азота снижается и разность между поступающим азотом и выводимым (Vпоступ – Vвывод) становится положительной. В этом случае говорят о положительном азотистом балансе. Положительный азотистый баланс наблюдается у здоровых детей, при нормальной беременности, выздоравливающих больных, спортсменов при наборе формы, т.е. в тех случаях, когда усиливается синтез структурных и функциональных белков в клетках. При возрастании доли выводимого азота наблюдается отрицательный азотистый баланс. Отрицательный баланс отмечается у больных и голодающих. Значение: для оценки общего состояния обмена белков. Среднее значение дневной потребности азота, рассчитанное на основании вышеуказанных исследований, равняется 105 мг/кг массы тела, что соответствует потреблению примерно 0,66 г/кг высококачественного протеина, независимо от пола и возраста. Нормы белка в питании. Коэффициент изнашивания. Физиологический минимум белка. - в России нормы суточного поступления пищевого белка установлены: для взрослых на уровне 100-120 г, для детей 1 года жизни – 2-3 г на кг веса тела, у старших детей – около 1,5-2 г/кг веса. Коэффициент изнашивания - минимальное количество белка, постоянно распадающегося в организме. В сутки в условиях покоя, когда отсутствует белок в пище, потеря белка составляет 0,028 – 0, 065 г азота на 1 кг массы взрослого человека. Таким образом, потеря белка у взрослого человека массой 70 кг = 23 г/сутки. Физиологический минимум белка составляет не менее 42 г полноценного белка в сутки. При таком потреблении белков наблюдается азотистое равновесие. Полноценный белок – белок, содержащий все 8 незаменимых аминокислот, необходимых организму. Биологическая ценность белка. Заменимые и незаменимые АК. Полноценные и неполноценные белки. - биологическая ценность (БЦ) белков характеризует их качество, способность обеспечить пластические процессы и синтез метаболически-активных субстанций, и обусловлена наличием в них незаменимых аминокислот, их соотношением с заменимыми, и усвояемостью в желудочно-кишечном тракте. По необходимости для организма выделяют такие, которые не синтезируются в организме и должны поступать с пищей – незаменимые аминокислоты (лейцин, изолейцин, валин, фенилаланин, триптофан, треонин, лизин, метионин). К заменимым относят такие аминокислоты, углеродный скелет которых образуется в реакциях метаболизма и способен каким-либо образом получить аминогруппу с образованием соответствующей аминокислоты. Две аминокислоты являются условно незаменимыми (аргинин, гистидин), т.е. их синтез происходит в недостаточном количестве, особенно это касается детей. Белки, содержащие в своем составе все незаменимые аминокислоты, называются полноценными, а белки, не содержащие хотя бы одной незаменимой аминокислоты,— неполноценными. Белковые резервы - было установлено, что чем больше с пищей поступает белка, тем больше выделяется из организма конечных продуктов белкового обмена, так как белки не откладываются про запас в отличие от углеводов и жиров. Однако при голодании или длительной белковой недостаточности в течение определенного времени в организме поддерживается состояние белкового равновесия. Потеря 1 г белков плазмы сопровождается потерей 30 г белков организма. По данным при голодании количество белка в печени может снизиться до 53%, а в сердце - до 48% по сравнению с нормальным уровнем. Это позволяет говорить о наличии в организме определенных белковых резервов, которые используются при неблагоприятных условиях для поддержания деятельности жизненно важных процессов. При полноценном питании происходит восстановление уровня белка в организме до нормы. Переваривание белков в желудке. Роль HCL. Общая кислотность. Ахлоргидрия, гиперхлоргидрия, гипохлоргидрия, ахилия. Пепсин и его роль в переваривании белков. Анализ желудочного сока. Переваривание белков: Во-первых, в желудочном соке содержится активный фермент пепсин. Во-вторых, благодаря наличию в желудочном соке свободной соляной кислоты для действия пепсина создается оптимальная среда (рН 1,5–2,5). Следует особо указать на существенную роль соляной кислоты в переваривании белков: она переводит неактивный пепсиноген в активный пепсин, создает оптимальную среду для действия пепсина; в присутствии соляной кислоты происходят набухание белков, частичная денатурация и, возможно, гидролиз сложных белков. Кроме того, соляная кислота стимулирует выработку секретина в двенадцатиперстной кишке, ускоряет всасывание железа и оказывает бактерицидное действие. Функции соляной кислоты Денатурация белков пищи. Бактерицидное действие. Высвобождение железа из комплекса с белками, что необходимо для его всасывания. Аналогично высвобождаются и другие металлы. Высвобождение различных органических молекул, прочно связанных с белковой частью (гем, коферменты - тиаминдифосфат, ФАД, ФМН, пиридоксальфосфат, кобаламин, биотин), что позволяет витаминам впоследствии всасываться. Превращение неактивного пепсиногена в активный пепсин. Снижение рН желудочного содержимого до 1,5-2,5 и создание оптимума рН для работы пепсина. После перехода в 12-перстную кишку – стимуляция секреции кишечных гормонов и, следовательно, выделения панкреатического сока и желчи. Общая кислотность желудочного сока определяется суммарной кислотностью: свободной соляной кислоты (находящаяся в желудочном соке в виде отдельных ионов H+ и Cl—) связанной соляной кислоты (соляной кислоты, находящаяся в желудочном соке в химически связанном с белками и в недиссоциированном виде) и органических кислот, в небольшом количестве (в норме) присутствующих в желудочном соке: молочной, уксусной, масляной и другими. Изменение кислотности в желудке Гипоацидное состояние развивается при снижении активности и/или количества обкладочных клеток, синтезирующих HCl. В результате могут развиваться самые разнообразные последствия, прямо или косвенно связанные с невыполнением соляной кислотой ее функций: снижение переваривания белков как в желудке, так и в кишечнике, активация процессов брожения в желудке, запах изо рта, активация процесса гниения белков в толстой кишке, бурление в кишечнике и метеоризм, проникновение недопереваренных продуктов в кровь и, как следствие, аллергические реакции, уменьшение высвобождения от белков и возникновение дефицита минеральных веществ (железо, медь, магний, цинк, йод и др), снижение высвобождения от белков и всасывания ряда водорастворимых витаминов – развитие гиповитаминозов (B1, B2, B6, B12, H), снижение синтеза обкладочными клетками внутреннего фактора Касла и снижение всасывания витамина B12, снижение секреции кишечных гормонов и, как следствие, уменьшение выделения желчи и панкреатического сока, нарушение переваривания и всасывания липидов и, как следствие, развитие гиповитаминозов по жирорастворимым витаминам. Гиперацидное состояние развивается при повышенной активности обкладочных клеток. Может приводить к клиническим проявлениям в виде воспаления стенки желудка, эрозии и язвенной болезни желудка и двенадцатипеперстной кишки. Ахилия желудка – это патологическое состояние, при котором в желудочном соке по каким-либо причинам отсутствуют соляная кислота и ферменты. ПепсинОптимум рН для работы пепсина 1,5-2,0. Пепсин является эндопептидазой, то есть он расщепляет внутренние пептидные связи в молекулах белков и пептидов. Синтезируется в главных клетках желудка в виде неактивного профермента пепсиногена, в котором активный центр "прикрыт" N-концевым фрагментом. Пепсин обладает невысокой специфичностью, в основном он гидролизует пептидные связи, образованные аминогруппами ароматических аминокислот (тирозина, фенилаланина, триптофана), меньше и медленнее – аминогруппами и карбоксигруппами лейцина, глутаминовой кислоты и т.д. Сок поджелудочной железы. Ферменты: трипсин, химотрипсин, карбоксипептидазы, эластаза. Их роль в переваривании белков, их активаторы и механизмы активации. Субстраты и продукты переваривания. Роль бикарбонатов сока pancreas. Выделяемый поджелудочной железой сок представляет бесцветную прозрачную жидкость щелочной реакции. Показатель рН сока поджелудочной железы человека равен 7,8—8,4. Щелочная реакция обусловлена наличием в соке бикарбонатов, которые нейтрализуют желудочную соляную кислоту и ингибируют пепсин, повышая тем самым pH примерно до 7,0 Поджелудочный сок богат ферментами. В нем находятся: Трипсин – гидролизует пептидные связи, образованные карбоксильными группами аргинина и лизина. (А: энтерокиназа) Химотрипсин - наиболее активен в отношении гидролиза пептидных связей, образованных карбоксильной и аминогруппами ароматических АК (фен, тир, три) Карбоксипептидаза А/В – отщепляет С-концевые остатки АК с ароматическими или гидрофобными радикалами/ остатки аргинина и лизина. Аминопептидазы последовательно отщепляют N-концевые участки АК (н-р: лейцинаминопептидаза) Эластаза - фермент, вырабатываемый ацинарными клетками поджелудочной железы. Синтезируются в виде неактивных предшественников, называемых проэластазами, которые накапливаются в ацинарных клетках поджелудочной железы. Высвобождается из поджелудочной железы в тонкий кишечник вместе с другими пищеварительными ферментами, такими как альфа-амилаза, липаза, трипсин и фосфолипазы. Активируется в двенадцатиперстной кишке трипсином. Cпособствует деградации и перевариванию эластина и других белков путем гидролиза. В отличие от других протеин-расщепляющих ферментов трипсина и химотрипсина, эластаза остается активной даже после прохождения кишечника. В результате изучение содержания эластазы в фекалиях может показать, функционирует ли поджелудочная железа правильно. Пониженный уровень может быть следствием вторичного сахарного диабета, желчнокаменной болезни, остеопороза, панкреатита, муковисцидоза, нарушений работы поджелудочной железы и кишечника. Поджелудочный сок, собранный из протока железы, не действует на белки. Он содержит ферменты трипсин и химотрипсин в неактивном состоянии, в виде так называемых трипсиногена и химотрипсиногена. Но прибавление небольших количеств кишечного сока переводит трипсиноген в активный фермент — трипсин. Активация трипсиногена и переход его в активный, активный фермент, объясняются действием содержащегося в кишечном соке особого фермента — энтерокиназы. Па А М М М Возможные пути синтеза заменимых АК в организме (глутамат, аспартат, аланин, глутамин, аспарагин, цистеин, тирозин). Прямое окислительное дезаминирование АК, фермент, кофермент, витамин, учав. в реакции. Продукты реакции и пути их использования. Отщепление аммиака происходит в одну реакцию; При физиологическом pH активна лишь глутаматдегидрогеназа и проявляют низкую активность оксидазы L,D-аминокислот; Данному типу окислительного дезаминирования (анаэробному прямому дезамин-ию) подвергается лишь глутамат (глу-ДГ); Субстрат: глутамат Фермент: глутамат-ДГ Кофермент: НАД+ (производное витамина В3); Участие альфа-КГ в глюкозоаланиновом цикле, в процессах глюконеогенеза, непрямом дезаминировании. 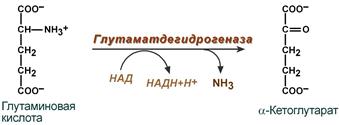 Аэробное прямое окислительное дезаминирование катализируется оксидазами D-аминокислот (D-оксидазы) в качестве кофермента использующими ФАД, и оксидазами L-аминокислот (L-оксидазы) с коферментом ФМН. Вклад оксидазы L-аминокислот в дезаминирование незначителен, так как её активность при физиологическом pH очень низка; 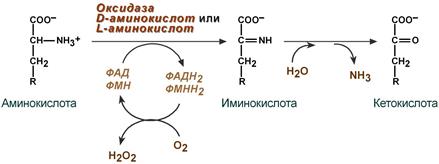 Оксидаза D-аминокислот способствует превращению D-аминокислот в L-изомеры, её роль в дезаминировании также невелика, поскольку количество D-изомеров в организме крайне мало. Оксидаза D-аминокислот способствует превращению D-аминокислот в L-изомеры, её роль в дезаминировании также невелика, поскольку количество D-изомеров в организме крайне мало.Участие в непрямом дезаминировании; Глутамат-ДГ является регуляторным ферментом, на активность которого влияют следующие факторы: А) приводят к её диссоциации и снижению активности: АТФ, ГТФ, НАДН Б) повышает активность: АДФ (то есть низкий уровень энергии стимулирует распад АК и использование их в качестве энергетического источника) Непрямое окислительное дезаминирование. Его этапы, значение. Ферменты, коферменты, витамины Отщепление аммиака происходит в 2 этапа; 1 этап – трансаминирование, 2 этап – дезаминирование; Субстрат: аминоксилота1, глутамат Ферменты: аминотрансферазы, глутамат-ДГ Коферменты: ПФ (производное витамина В6), НАД+ (производное витамина В3) Биологическая роль: основной способ дезаминирования большинства АК; Первый этап заключается в обратимом переносе NH2-группы с аминокислоты на кетокислоту с образованием новой аминокислоты и новой кетокислоты при участии ферментов аминотрансфераз. Второй этап состоит в отщеплении аминогруппы от аминокислоты2. 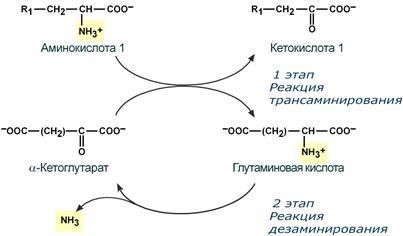 В мышечной ткани активность Глу-ДГ низка => при интенсивной мышечной нагрузке функционирует ещё один путь непрямого дезаминирования с участием цикла ИМФ-АМФ 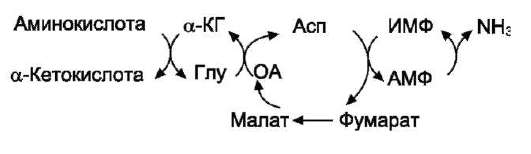 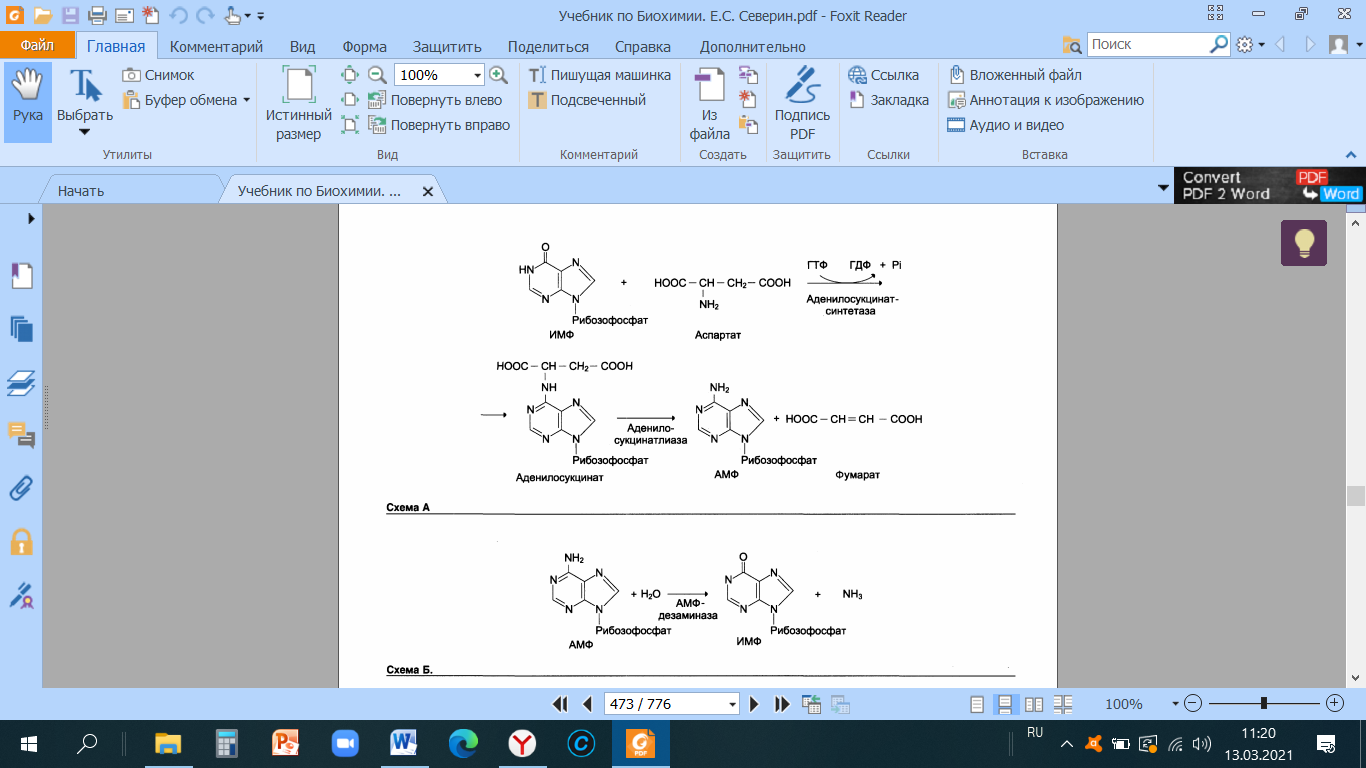 . |
