микробиология. Зоонозы от
 Скачать 0.66 Mb. Скачать 0.66 Mb.
|
|
Антропоно́зы, антропоно́зные инфе́кции — группа инфекционных и паразитарных заболеваний, возбудители которых способны паразитировать в естественных условиях только в организме больного. Сохранение возбудителей антропоноза как биологического вида обусловлено непрерывностью процесса их перехода от зараженного человека к восприимчивому лицу. Это обеспечивается эволюционно сформировавшимся механизмом передачи, являющимся основой эпидемического процесса. Зооно́зы (от др.-греч. ζῷον — животное, живое существо + греч. νόσος — болезнь) — это группа инфекционных и паразитарных заболеваний, вызванных патогеном (инфекционным агентом, таким как бактерия, вирус, паразит или прион), перешедшим от определённого вида животного (обычно позвоночного) к человеку. Обычно первый инфицированный человек передает инфекционный агент по крайней мере одному другому человеку, который, в свою очередь, заражает других. Сапронозы (сапронозные инфекции) (др.-греч. σαπρός — гнилой, νόσος — болезнь) — группа инфекционных заболеваний, для возбудителей которых главным естественным местом обитания являются абиотические (неживые) объекты окружающей среды. Этим данная группа отличается от прочих заразных болезней, для возбудителей которых главным естественным местом обитания служит заражённый организм человека (антропонозы) или животного (зоонозы). Механизм передачи инфекции – принципиальная идея, лежащая в основе способности конкретного возбудителя передаваться от источника инфекции к восприимчивому индивидууму. Конкретный способ практической реализации указанной идеи носит название «путь передачи». Каждому механизму передачи может соответствовать один или несколько путей передачи. Всего известно 4 основных механизма передачи инфекционных болезней: 1. Фекально-оральный (фекалии больных, содержащие возбудителей заболевания, должны каким-либо образом попасть в пищеварительный тракт здорового индивидуума); 2. Респираторный (также аэрогенный) – когда инфекция из дыхательных путей источника инфекции при посредстве аэрозоля каким-либо способом попадает в респираторный тракт восприимчивого индивидуума; 3 . Парентеральный (возбудитель заболевания из крови либо биологических жидкостей источника инфекции каким-либо способом попадает в кровь либо биологические жидкости восприимчивого лица, преодолевая кожные покровы либо слизистые последнего); 4. Контактный (передача инфекции осуществляется при прямом контакте пораженных кожных покровов и/или слизистых источника инфекции с неповрежденными кожными покровами и/или слизистыми восприимчивого лица Так, в рамках фекально-орального механизма выделяют три пути передачи: пищевой (алиментарный), водный и контактно-бытовой. Алиментарный путь передачи реализуется при условии контаминации пищевых продуктов фекалиями источника инфекции; при последующем употреблении в пищу контаминированных продуктов возбудитель заболевания попадает в ЖКТ восприимчивого индивидуума. Водный путь передачи реализуется, соответственно, при контаминации питьевой воды фекалиями источника инфекции; в дальнейшем возбудители заболевания попадают в ЖКТ при питье инфицированной воды. Контактно-бытовой путь передачи осуществляется при контаминации фекалиями источника инфекции каких-либо предметов общего пользования (дверных ручек, гигиенических принадлежностей, посуды, полотенец, игрушек и т.п.). В дальнейшем возбудитель заболевания попадает на руки восприимчивых лиц при использовании ими указанных предметов, после чего (при обязательном пренебрежении реципиентов инфекции правилами личной гигиены) – в рот последних, а в дальнейшем – в ЖКТ. Контактно-бытовой путь передачи наиболее распространен среди членов закрытых либо полузакрытых коллективов, которые в силу различных причин вынуждены подолгу оставаться в помещениях ограниченного размера, не будучи в состоянии покинуть их либо сменить круг общения (дети, проживающие в детских домах – интернатах; заключенные в местах лишения свободы; солдаты в казармах; пациенты отделений для психохроников; клиенты домов престарелых; пациенты хосписов и т.п.). В рамках респираторного (аэрогенного) механизма передачи инфекции выделяют два пути: воздушно-капельный и воздушно-пылевой. Воздушно-капельный путь реализуется при вдыхании восприимчивым лицом т.н. первичного аэрозоля, состоящего из взвешенных в воздухе мелких и мельчайших капелек слюны и/или мокроты, выделяемых пациентами с респираторными заболеваниями при разговоре, кашле и чихании. Возбудитель инфекционного заболевания, переносимый капельками, составляющими первичный аэрозоль, попадает при этом в дыхательные пути восприимчивых лиц. Воздушно-пылевой путь реализуется при вдыхании восприимчивым индивидуумом т.н. вторичного аэрозоля, состоящего из частиц пыли, на которых сорбированы жизнеспособные возбудители заболевания. Вторичный аэрозоль образуется при любых манипуляциях, приводящих к подъёму пыли в воздух (наиболее часто – при сухой уборке, но также и при ремонте, сельскохозяйственных работах и т.п.). Частицы пыли, переносящие возбудителей инфекции и составляющие вторичный аэрозоль, образуются при высыхании капелек первичного аэрозоля на различных поверхностях, при условии, что возбудитель заболевания способен длительно переносить высушивание, сохраняя жизнеспособность. К таковым агентам относятся микобактерии туберкулеза, вирусы хантаан и пуумалу, споры бацилл сибирской язвы и т.п. В рамках парентерального механизма передачи инфекции выделяют больше всего разнообразных путей передачи: инъекционный, инфузионный, трансплантационный, трансмиссивный, гемоконтактный (в том числе – микрогемоконтактный), вертикальный (трансплацентарный). Инъекционный путь передачи реализуется при выполнении инъекций (либо других инвазивных медицинских манипуляций) восприимчивому лицу с использованием инструментария, контаминированного кровью либо другими биологическими жидкостями источника инфекции, содержащими возбудителей инфекционных заболеваний. Данный путь передачи обычно имеет место у потребителей внутривенных наркотических средств, и передаются таким образом вирусные гепатиты В и С, ВИЧ-инфекция и т.п. Инфузионный путь передачи имеет место при переливании восприимчивому лицу цельной крови (либо ее компонентов), отобранной у источника инфекции и содержащей возбудителей инфекционных заболеваний. Помимо вышеупомянутых ВГВ, ВГС и ВИЧ-инфекции, так, например, могут передаваться малярия (т.н. «шизонтная» малярия) и сыпной тиф (если кровь для переливания была взята у инфицированного риккетсией Провачека донора в последние 3-4 дня инкубационного периода). Трансплантационный путь передачи реализуется при пересадке восприимчивому лицу внутренних органов, удаленных у донора – источника соответствующих инфекционных заболеваний. Помимо парентеральных гепатитов (В, С, D, F, G) и ВИЧ-инфекции, так могут быть переданы и более редкие заболевания, как, например, бешенство. Трансмиссивный (или вектор-опосредованный) путь передачи реализуется кровососущими насекомыми (комарами, вшами, блохами, москитами, клещами, мокрецами и т.п.) в процессе кровососания на восприимчивом индивидууме после предшествющего кровососания на источнике инфекции. Таким образом могут передаваться сыпной тиф (вши), малярия (комары), желтая лихорадка (комары), филяриатозы (москиты), чума (блохи), трипаносомозы (муха це-це и поцелуйные клопы), лихорадка Западного Нила (комары) и т.п. Гемоконтактный путь передачи имеет место при контакте крови либо биологических жидкостей источника инфекции, содержащих возбудитель инфекционного заболевания, с поврежденными (реже – неповрежденными) кожными покровами либо слизистыми оболочками восприимчивого индивидуума. В последнем случае возбудитель должен обладать способностью проникать в кровь через неповрежденные кожные покровы либо слизистые. Повреждения (равно как и капли крови) могут быть микроскопическими, невидимыми глазом, в этом случае говорят о микрогемоконтактном пути передачи; последний подразумевает очень низкую инфицирующую дозу возбудителя, что характерно, например, для гепатита В. Гемоконтактный путь передачи реализуется при передаче ВИЧ-инфекции и ХГВ, С в процессе родов через естественные родовые пути (т.н. интранатальная передача). Истинный вертикальный путь передачи – т.н. трансовариальный, т.е. через половые клетки, у человека невозможен; таким путем инфекция передается у членистоногих из поколения в поколение. Данное понятие у человека обычно соотносится с трансплацентарной передачей инфекции, когда возбудитель заболевания проникает из крови матери в кровь плода, преодолевая трансплацентарный барьер. Указанным способом могут передаваться вирусы краснухи, ЦМВ, ВЭБ, токсоплазмы, возбудители ВИЧ-инфекции, гепатитов В и С и т.д. Обычно трансплацентарная передача происходит в последние 2-3 недели беременности (с 37-й недели и далее), поскольку именно в этот период в плаценте почти у всех беременных развиваются более или менее выраженные дистрофические изменения, вследствие чего проницаемость гемато-плацентарного барьера для парентеральных агентов повышается. В рамках контактного механизма передачи выделяют, помимо собственно контактного, также половой (гомо- и гетеросексуальный) путь передачи, при котором в процессе гомо- либо гетеросексуальной половой связи происходит контакт пораженных слизистых половых органов источника инфекции с непораженными слизистыми половых органов восприимчивого лица. Помимо ЗППП, половым путем могут передаваться ВИЧ-инфекция, вирусный гепатит В и (с низкой вероятностью) вирусный гепатит С. С понятием механизмов и путей передачи инфекционных заболеваний тесно связана эпидемиологическая классификация инфекционных болезней Л.В. Громашевского (1941 г.), согласно которой, все инфекционные болезни подразделяются на: 1. Кишечные инфекции (с преимущественно фекально-оральным механизмом передачи); Инфекционный и эпидемический процесс Бактериемия (от др.-греч. βακτηρία — бактерия и αἷμα — кровь) — наличие бактерий в крови. Обычно считается, что в норме кровь стерильна, и обнаружение бактерий в крови (обычно при помощи посева крови) может свидетельствовать о патологии. Существуют, однако, исследования, подтверждающие наличие бактерий в крови здорового человека. Септицемия – клинико–патологоанатомическая форма сепсиса, при которой отсутствуют метастатические септические очаги. Септицемия – это сепсис без гнойных метастазов. По поводу правомочности применения этого понятия в качестве диагноза одной из форм сепсиса до сих пор продолжается дискуссия. Токсемия Токсеми́я (от др.-греч. τοξικός — ядовитый и αἷμα — кровь), токсинемия — отравление организма, вызванное наличием в крови токсинов, поступающих извне или образующихся в самом организме Вирусемия, виремия — состояние организма, при котором вирусы попадают в кровоток и могут распространяться по всему телу. Аналогично бактериемии, при которой в кровоток попадают бактерии. Вирусемия делает возможной передачу вирусов трансмиссивным путём. Первичная вирусемия относится к первоначальному распространению вируса в крови от места возникновения инфекции. Вторичная инфекция — ИП, развивающийся на фоне уже имеющейся (первичной) ИБ, вызванной другим микроорганизмом. Смешанные инфекции инфекционные процессы, развивающиеся в организме при одновременном сочетанном воздействии двух и более возбудителей. Инкубационный период — [от лат. incubatio «высиживание птенцов»]. Обычно между проникновением инфекционного агента в организм и проявлением клинических признаков существует определённый для каждой болезни промежуток времени — инкубационный период, характерный только для экзогенных инфекций. В этот период возбудитель размножается, происходит накопление как возбудителя, так и выделяемых им токсинов до определённой пороговой величины, за которой организм начинает отвечать клинически выраженными реакциями. Продолжительность инкубационного периода может варьироваться от нескольких часов и суток до нескольких лет. Продромальный период — [от др.-греч. πρόδρομος «бегущий впереди, предшествующий»]. Как правило, первоначальные клинические проявления не несут каких-либо патогномоничных [от др.-греч. πάθος «болезнь» + γνώμων «истолкователь, смотритель, норма, правило»] для конкретной инфекции признаков. Обычны слабость, головная боль, чувство разбитости. Этот этап инфекционной болезни называется продромальным периодом, или «стадией предвестников». Его продолжительность не превышает 24-48 ч. Период развития болезни — в течение этой фазы проявляются черты индивидуальности болезни либо общие для многих инфекционных процессов признаки (лихорадка, воспалительные изменения и др.). В клинически выраженной фазе можно выделить стадии нарастания симптомов (stadium incrementum), расцвета болезни (stadium acme) и угасания проявлений (stadium decrementum). Реконвалесценция — [от лат. re-, повторность действия, + convalescentia, выздоровление]. Период выздоровления, или реконвалесценции, как конечный период инфекционной болезни может быть быстрым (кризис) или медленным (лизис), а также характеризоваться переходом в хроническое состояние. В благоприятных случаях клинические проявления обычно исчезают быстрее, чем наступает нормализация морфологических нарушений органов и тканей и полное удаление возбудителя из организма. Выздоровление может быть полным либо сопровождаться развитием осложнений (например, со стороны ЦНС, костно-мышечного аппарата или сердечно-сосудистой системы). Период окончательного удаления инфекционного агента может затягиваться и для некоторых инфекций (например, сыпного тифа) может исчисляться десятилетиями. Агония — терминальное состояние организма, предшествующее летальному исходу. Реинфекция повторное заражение переболевшего какой-либо инфекционной болезнью возбудителями той же болезни, приведшее к развитию инфекционного процесса. Суперинфекция (англ. superinfection) — процесс, в результате которого клетка, изначально зараженная одним вирусом, коинфицируется через какое-то время другим штаммом вируса или другим вирусом[1]. Вирусные суперинфекции могут привести к появлению резистентных штаммов вирусов, для лечения которых потребуются иные препараты. Например, коинфекция человека двумя разными штаммами вируса ВИЧ может привести к образованию штамма, резистентного к антиретровирусной терапии. Также показано, что комбинированная инфекция уменьшает общую эффективность иммунного ответа[2]. В медицинской практике суперинфекцией называют инфекцию, следующую за иной инфекцией, особенно в случае заражения резистентными микроорганизмами. Согласно иллюстрированному медицинскому словарю Дорленда, суперинфекция — состояние, вызванное резким ростом бактерий другого типа, чем первичных бактерий Рецидив (от лат. recidere) в медицине — возобновление болезни после кажущегося полного выздоровления (ремиссии). Рецидив объясняется тем обстоятельством, что патоген в ходе лечения не полностью исчезает из организма и, в определённых условиях, вновь вызывает появление симптомов заболевания. Бактерионосительство и вирусоносительство Бактерионосительство и вирусоносительство — пребывание возбудителей инфекционных болезней в организме человека при отсутствии признаков заболевания. Часто развивается у людей, переболевших дифтерией, холерой, дизентерией. Бактерионосительство опасно тем, что возможно выделение возбудителя во внешнюю среду, что способствует распространению заболевания. Антигены - это любые вещества, содержащиеся в микроорганизмах и других клетках (или выделяемые ими), которые несут в себе признаки генетически чужеродной информации и которые потенциально могут быть распознаны иммунной системой организма. При введении во внутреннюю среду организма эти генетически чужеродные вещества способны вызывать иммунный ответ различных типов. Антигенная мимикрия – это состояние, когда АГ бактерий или вирусов проявляют схожие антигенные свойства с компонентами клеток человека и животных. Если структуры организма хозяина напоминают АГ возбудителей, реакции иммунитета могут оказаться слабыми и малоэффективными. В частности, бактерионосительство или невосприимчивость к вакцинации могут быть связаны с антигенной мимикрией антигенов бактерий и человеческого тела Гаптены – это низкомолекулярные вещества, которые в обычных условиях не вызывают иммунную реакцию. Однако при связывании с высокомолекулярными молекулами-«носителями» они становятся иммуногенными. К гаптенам относятся многие аллергены, лекарственные препараты и большинство химических веществ. Они способны запускать иммунный ответ после связывания с белками организма, например с альбумином, а также с белками и другими молекулами на поверхности клеток (эритроцитов, лейкоцитов). При повторном введении гаптены уже могут вызывать иммунные реакции самостоятельно. Антитела – белки сыворотки крови, которые вырабатываются плазматическими клетками в ответ на проникновение антигена в организм. Антитела вырабатываются клетками лимфоидных органов, и циркулируют в плазме крови, лимфе и других жидкостях организма. Иммуноглобулин G Каждая молекула IgG состоит из двух L-цепей и двух Н-цепей, соединенных дисульфидными мостиками. Молекулярная масса IgG составляет около 150 кДа. Его концентрация в сыворотке составляет 8-12 г/л (в среднем около 10 г/л). Из-за двух идентичных антигенсвязывающих сайтов IgG является двухвалентным. Существует четыре подкласса (IgG1-IgG4), различающихся по строению Н-цепей. Подкласс IgG1 составляет около 65% от общего IgG; он выполняет основную защитную функцию в иммунном ответе. IgG2 направлен против полисахаридных антигенов и является важной частью иммунной защиты против капсульных бактерий. ИГ подкласса IgG4 могут принимать участие в аллергических реакциях. Антитела класса IgG доминируют при вторичного иммунном ответе. Они обладают максимальной аффинностью. Кроме того, IgG активирует систему комплемента по классическому пути, а также является эффективным опсонином, активируя фагоцитоз. IgG – единственный класс иммуноглобулинов, который проходит через плаценту; тем самым антитела класса IgG играют важную роль в защите плода и новорожденных от инфекций. Иммуноглобулин M IgM является основным иммуноглобулином первичного иммунного ответа. Антительный рецептор класса IgM находится на мембранах В-лимфоцитов. IgM состоит из пяти идентичных субъединиц, каждая из которых сходна по строению с молекулой IgG. Они связаны дисульфидными связями через соединительную (от англ. – joining) J-цепь. Конечная пентамерная молекула IgM (мол. массой около 900 кДа) содержит десять идентичных антигенсвязывающие участков. Поэтому IgM обладает максимальной авидностью, несмотря на сравнительно невысокую аффинность. Сывороточная концентрация IgM составляет от 0,8 до 1,5 г/л. IgM создает первичную линию защиты против бактерий и вирусов. Он принимает участие в агглютинации микроорганизмов, активирует комплемент по классическому пути. Также IgM стимулирует фагоцитоз (функция опсонина) Иммуноглобулин А IgA является ведущим секреторным иммуноглобулином, присутствующим в биологических жидкостях и выделениях из слизистых (кровь, молоко, слюна, слезная жидкость, содержимое желудочно-кишечного тракта, отделяемое дыхательных, мочевыводящих и половых путей). Он защищает слизистые оболочки от проникновения патогенов извне, обеспечивая местный иммунитет. Каждая молекула секреторного IgA (мол. масса ≈ 350 кДа) представляет собой димер или тример L- и H-цепей, связанных воедино J-цепью, с присоединенным к ним секреторным компонентом. Секреторный компонент обеспечивает транспорт молекулы IgA через эпителиальные клетки слизистых в биологические жидкости. Часть IgA находится в крови, обычно в мономерной форме (мол. масса около 170 кДа). Диапазон сывороточных концентраций IgA составляет около 1,0-4,0 г/л. Существует два подкласса иммуноглобулина А – IgA1 и IgA2. Секреторные IgA (sIgA), будучи антителами, препятствуют адгезии микроорганизмов к эпителию слизистых оболочек, опсонизируют микробные клетки, усиливают фагоцитоз, активируют комплемент по альтернативному пути. Иммуноглобулин E Молекулярная масса IgE равна ≈ 190 кДа. Его концентрация в сыворотке минимальна и выражается в международных единицах (МЕ). Одна МЕ эквивалентна 2,4 нг IgE. Диапазон концентраций сывороточного IgE варьирует в пределах 0-100 МЕ в 1 мл сыворотки. Антитела класса IgE играют ведущую роль в аллергии немедленного типа. Они являются основными участниками анафилактических аллергических реакций. При этом Fab-фрагмент IgE связывается с аллергеном, а его Fc-фрагмент – с рецептором на поверхности тучных клеток и базофилов, что стимулирует их дегрануляцию с выделением медиаторов аллергии. Также IgE принимает участие в иммунитете против гельминтов и простейших. Иммуноглобулин D IgD выступает в качестве одного из рецепторов к антигену на мембранах созревающих В-лимфоцитов. Его молекулярная масса составляет около 160 кДа. В сыворотке IgD присутствует только в следовых количествах (0,04 г/л). Эффекторные функции иммуноглобулинов D до конца не ясны. Не исключается их участие в противовирусном иммунитете. ФАГОЦИТОЗ Фагоцитоз – это процесс активного поглощения клетками организма, попадающих в него патогенных живых или убитых микробов и других чужеродных частиц с последующим перевариванием при помощи внутриклеточных ферментов ФАГОЦИТЫ Микрофаги - нейтрофилы, базофилы, эозинофилы Макрофаги-Моноциты, фиксированные макрофаги: альвеолярные, перитонеальные, купферовские клетки, дендритные клетки селезенки и лимфатических узлов, клетки Лангерганса и др. Подвижные макрофаги – моноциты периферической крови Неподвижные макрофаги – макрофаги печени, селезенки, лимфатических узлов, органов и тканей ФУНКЦИИ МАКРОФАГОВ Защитная – очистка организма от инфекционных агентов, продуктов распада тканей Представляющая – фиксация на наружной мембране антигенных эпитопов микроорганизма для специфического распознавания клетками иммунной системы (Т-хелперами) Секреторная – секреция ферментов и биологически активных веществ СИСТЕМА КОМПЛЕМЕНТА Комплемент – многокомпонентная система белков сыворотки крови и других жидкостей организма, которые играют важную роль в поддержании иммунного гомеостаза. Complement – C1, C2, C3………C9. Белки комплемента вырабатывают макрофаги, лейкоциты, гепатоциты и составляют 5-10% всех белков крови. АКТИВАЦИЯ БЕЛКОВ СИСТЕМЫ КОМПЛЕМЕНТА – сложная цепная реакция, при которой каждый компонент активирует по типу каскада несколько последующих в процессе многоступенчатых превращений ПУТИ АКТИВАЦИИ КЛАССИЧЕСКИЙ – запускается и протекает с участием комплекса антиген-антитело АЛЬТЕРНАТИВНЫЙ – активация происходит при участии бактерий, эндотоксинов и других антигенов без участия АТ ЛЕКТИНОВЫЙ – активируется лектинами бактерий (маннансвязывающим белком, фибронектином и др.) При любом пути активации комплемента конечным продуктом является образование мембраноатакующего комплекса (МАК) на поверхности клетки-мишени, перфорацией ее мембраны и лизисом ФУНКЦИИ СИСТЕМЫ КОМПЛЕМЕНТА Лизис чужеродных клеток Опсонизация чужеродных клеток, благодаря феномену иммунного прилипания Стимуляция хемотаксиса Повышение сосудистой проницаемости (С3а и С5а) Стимуляция внутриклеточных процессов, в результате которых из клеток выбрасываются биологически активные вещества (гистамин, серотонин), которые обуславливают развитие воспаления ДИАГНОСТИЧЕСКИЕ РЕАКЦИИ С ИСПОЛЬЗОВАНИЕМ КОМПЛЕМЕНТА реакция бактериолиза реакция гемолиза реакция связывания комплемента (РСК) В КАЧЕСТВЕ КОМПЛЕМЕНТА В РЕАКЦИЯХ ИСПОЛЬЗУЮТ СЫВОРОТКУ МОРСКОЙ СВИНКИ РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА (РСК) ЦЕЛИ ОБНАРУЖЕНИЕ АНТИТЕЛ В СЫВОРОТКЕ КРОВИ ВЫЯВЛЕНИЕ АНТИГЕНА В МАТЕРИАЛЕ ОТ БОЛЬНОГО КОМПОНЕНТЫ ДЛЯ ПОСТАНОВКИ РСК ДИАГНОСТИЧЕСКАЯ (ОСНОВНАЯ) СИСТЕМА Инактивированная сыворотка больного (исследуемый материал) Антиген известный (целые бактериальные клетки или растворимые антигены) Комплемент (сыворотка крови морской свинки нативная или лиофилизированная) в рабочей дозе. Определяют в реакции титрования комплемента ИНДИКАТОРНАЯ (ГЕМОЛИТИЧЕСКАЯ) СИСТЕМА Эритроциты барана (3% взвесь в физиологическом растворе) Гемолитическая сыворотка ( инактивированная) 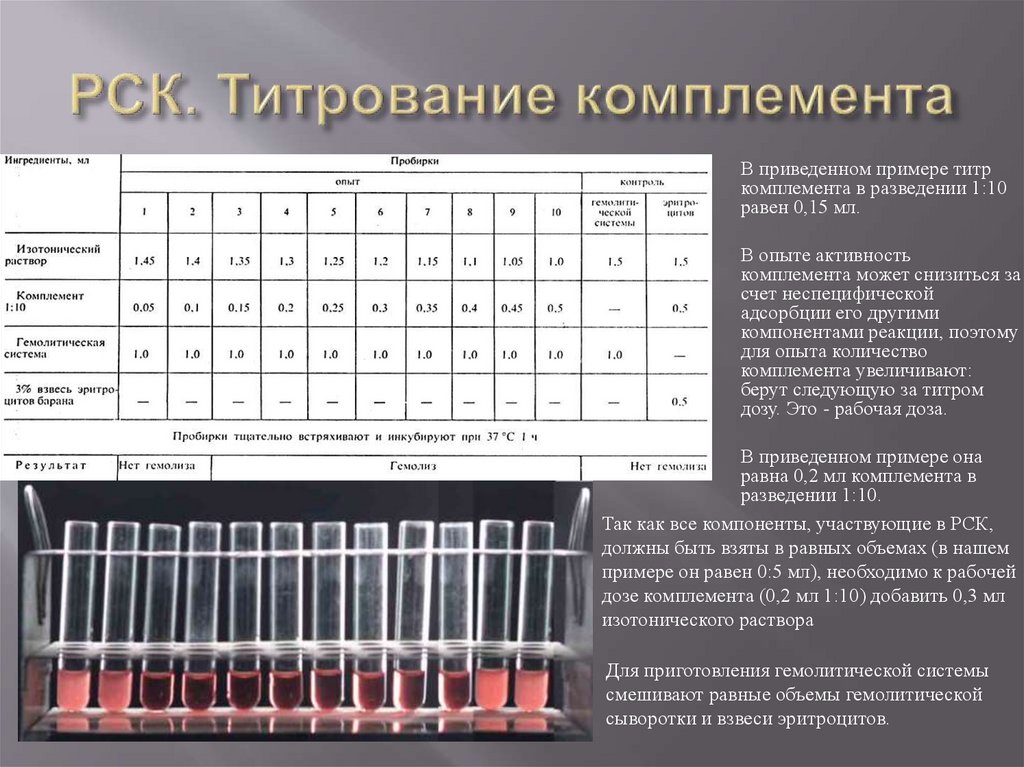   РЕАКЦИЯ КОЛЬЦЕПРЕЦИПИТАЦИИ (РЕАКЦИЯ АСКОЛИ; ТЕРМОПРЕЦИПИТАЦИИ) Принцип постановки: реакцию проводят в узких преципитационных пробирках; на иммунную сыворотку наслаивают растворимый антиген. При оптимальном соотношении АГ и АТ на границе этих двух растворов образуется непрозрачное кольцо преципитата. Р.П. используют:▪ при типизации и изучении АГ- структуры некоторых групп бактерий; ▪ в судебной медицине – определяют видовую принадлежность кровяных пятен, спермы; ▪ в санитарной экспертизе выявляют примеси молока одного вида животного к молоку другого вида; добавлении искусственного меда к натуральному, фальсификацию мясных, рыбных, мучных изделий. Реакцию Асколи используют в диагностике сибирской язвы для обнаружения АГ сиби-реязвенных бацилл в экстрактах из органов животных, кожи, шерсти, волос, а также для контроля выпускаемой продукции: полушубков, меховых воротников, кисточек для бритья , сумок, перчаток. Эту реакцию еще называют термо-преципитацией, так как экстракт, подлежащий исследованию, предварительно кипятят, затем фильтруют, и только потом наслаивают на преципитирующую сибиреязвенную сыворотку. МЕТОД ДВОЙНОЙ ИММУНОДИФФУЗИИ В ГЕЛЕ ПО ОУХТЕРЛОНИ  Метод двойной иммунодиффузии для определения токсигенности штаммов (Элек-тест) ● Штаммы возбудителя дифтерии С. diphtheriaeмогут быть токсигенными (продуцирующими экзотоксин) и нетоксигенными. ● Образование экзотоксина зависит от присутствия в бактериях профага (днк β – умеренного бактериофага), несущего tox-ген и кодирующего синтез экзотоксина. ● При заболевании все изоляты тестируются на токсигенность – продукцию дифтерийного экзотоксина с помощью реакции преципитации в геле. ИММУНОЭЛЕКТРОФОРЕЗ  РЕАКЦИЯ ИММУНОФЛЮОРЕСЦЕНЦИИ (Метод Кунса) Прямой метод РИФ Микробные антигены связываются со специфическими антителами, меченными флюорохромами (акридиновый оранжевый, изотиоцианат флюоресцеина (ФИТЦ) и др.), в результате чего образуются светящиеся комплексы, наблюдаемые при люминесцентной микроскопии. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Люминесцентная микроскопия Люминесцентная микроскопия — это оптическое выявление микрообъектов, окрашенных специальными красителями (флюорохромами), испускающими свечение при воздействии ультрафиолетовыми лучами. Для люминесцентной микроскопии применяются специальные оптические устройства и микроскопы, основной частью которых является источник ультрафиолетовых лучей и система фильтров к нему. Реакция непрямой иммунофлюоресценции (РНИФ) Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси бактерий обрабатывают антителами кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами, отмывают, а оставшиеся на бактериях антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс антиген + антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе. Прямой метод РИФ - непосредственное соединение антигена с меченым флуоресцентным красителем антителом. Непрямой метод (РНИФ) – 1) образование комплекса антиген-антитело, 2) выявлении этого комплекса путем обработки его меченым флуоресцентным красителем антигаммаглобулином (АТ к АТ). ИММУНОФЕРМЕНТНЫЙ АНАЛИЗ (сокращённо ИФА, англ. enzyme-linked immunosorbent assay, ELISA) — лабораторный иммунологический метод качественного определения и количественного измерения антигенов и антител. Практическое применение ИФА ИФА нашел широкое применение в различных областях медицины и биологии благодаря относительной простоте и высокой чувствительности метода. ИФА успешно применяется для: • выявления и определения уровня гормонов и лекарственных препаратов в биологических образцах; • определения изотипов (IgG, IgM и другие) антител против конкретного антигена; • выявления иммунных комплексов; • выявления онкомаркеров; • определения белков сыворотки крови (ферритин, фибронектин и др.); • определения общего IgE и специфических IgE антител; • скрининга моиоклональных антител; • определения цитокинов в биологических жидкостях. Чувствительность метода ИФА пришел на смену широко используемым ранее в клинической практике методам агглютинации, преципитации и РИА. По сравнению с вышеназванными методами ИФА менее трудоемок и менее продолжителен по времени, удобен для выполнения большого числа однотипных анализов. В ИФА сочетается уникальная специфичность иммунохимического анализа с высокой чувствительностью определения ферментной метки. Чувствительность метода (под чувствительностью подразумевают минимальное выявляемое количество антител или антигена) определяется следующими факторами: аффинностью антител, предпочтительнее использование моноклональных антител; специфической активностью фермента; интенсивностью сигнала; чувствительностью учета сигнала. Различные варианты ИФА различаются по своей чувствительности. Отдельные варианты ИФА позволяют выявлять в образце единичные молекулы. Средняя чувствительность ИФА – 10-9 – 10-12 моль. В основе метода иммуноферментного анализа (ИФА) лежит: принцип специфического взаимодействия между антигеном и соответствующим ему антителом. Выявление образовавшегося комплекса проводят с использованием конъюгата, который представляет собой анти-антитело, соединённое с ферментной меткой (обычно используют пероксидазу хрена либо другие пероксидазы). С помощью специального спектрального прибора результаты ферментативной реакции в полистироловых планшетах можно измерить за одну минуту в 96 лунках. Однако в целом ИФА продолжительнее гомогенного. Его проведение требует до 3—4 часов, поскольку на каждом этапе операции должно установиться равновесие, и лишь после этого можно провести отмывку иммуносорбента, которая тоже занимает время. Иммуноферментный анализ (ИФА) для обнаружения антител Адсорбция специфических антигенов на твердой фазе. Добавление исследуемого материала (сыворотки больного), в котором предполагается наличие антител. Промывание лунок планшета Добавление специфической сыворотки, содержащей антитела против Ig человека, меченные ферментом. Добавление субстрат - индикаторного раствора, по изменению цвета которого оценивают результат. ИФА для обнаружения антигенов Адсорбция специфических антител на твердой фазе. Добавление исследуемого материала, в котором предполагается наличие антигена (например, ликвор). Промывание лунок планшета. Добавление специфической сыворотки, содержащей антитела против данного антигена. Добавление вторичных антител (против диагностической сыворотки), меченных ферментом. Добавление субстрат - индикаторного раствора, по изменению цвета которого оценивают результат. Характеристика компонентов, используемых в ИФА. Ферменты. Ферментные метки обладают чрезвычайно мощным каталитическим действием, одна молекула фермента может реагировать с большим количеством молекул субстрата. Таким образом, фермент, присутствующий в ничтожных количествах, можно выявить и количественно определить по образованию продуктов, катализируемой им реакции. Другое преимущество применения ферментов в качестве меток обусловлено наличием в молекуле многочисленных функциональных групп (сульфгидрильных, карбоксильных, остатков тиразина и др.), через которые можно ковалентно присоединить молекулы лиганда. Ферментные маркеры, используемые в ИФА, должны обладать следующими свойствами: – высокая активность и стабильность фермента в условиях анализа, при модификации и в конъюгате с антителами или другими белками; – наличие чувствительных субстратов и простота метода определения продуктов или субстратов ферментативной реакции; – возможность адаптации субстратных систем к дальнейшему усилению; – отсутствие фермента и его ингибиторов в исследуемой биологической жидкости. В ИФА может использоваться не менее 15 различных ферментов. Наибольшее применение, в соответствии с вышеназванными требованиями, нашли пероксидаза хрена (ПХ), щелочная фосфотаза (ЩФ) и β-D-галактозидаза. Субстраты Выбор субстрата в первую очередь определяется используемым в качестве метки ферментом, так как реакция фермент-субстрат высоко специфична. Основные требования к субстрату: – обеспечение высокой чувствительности метода при выявлении фермента в конъюгате; – образование хорошо учитываемых (окрашенных) продуктов реакции фермент-субстрат; – субстрат должен быть безопасным, дешевым, доступным и удобным для применения. Чаще используют хромогенные субстраты, которые, разрушаясь, образуют окрашенное вещество. Перспективным является использование высокоэнергетических субстратов – флуоресцентных, хемоипюминесцентных. Применение таких субстратов позволяет теоретически повысить чувствительность ИФА на два порядка. Образование конъюгата Конъюгат – это антиген или антитело, меченные ферментной меткой. Образование коньюгата – один из важных этапов проведения ИФА. При формировании конъюгата подбирают такой оптимальный метод введения ферментной метки, чтобы оба компонента конъюгата сохраняли свою биологическую активность: фермент - способность взаимодействовать с субстратом, а антиген или антитело - антигенность и антигенсвязывающую активность, соответственно. Наличие меченого, высокоочищенного антигена позволяет использовать конкурентные методы. В этом случае на конечном этапе можно измерять активность конъюгата, не связанного с иммобилизованными антителами, что позволяет избежать процедуры отмывки и делает анализ более удобным. Однако антигены разнообразны по своим физико-химическим свойствам и строению, а значит невозможно разработать универсальные методики для получения конъюгата с антигеном. В этом случае получение конъюгата антигена с ферментом представляет собой отдельную сложную задачу. Приготовление меченых антител для ИФА методически более доступно. Твердая фаза В качестве твердой фазы для проведения ИФА можно применять различные материалы: полистирол, поливинилхлорид, полипропилен и другие вещества. Твердой фазой могут служить стенки пробирки, 96-луночные и др. планшеты, шарики, бусины, а также нитроцеллюлозные и другие мембраны, активно сорбирующие белки. Иммобилизация антигена или антител на твердой фазе возможна тремя путями: – пассивная адсорбция, основанная на сильных гидрофобных взаимодействиях между белками и синтетической поверхностью; – ковалентное прикрепление к твердой фазе; – иммунохимическое и др. (нековалентное и неадсорбционное присоединение). Вакцины Живые: Аттенуированные Ассоциированные Рекомбинантные Инактивированные Субъединичные Корпускулярные Рекомбинантные Анатоксины Живые вакцины В живых вакцинах используются: аттенуированные, ослабленные (потерявшие свою патогенность) штаммы природных возбудителей (туляремийная, сибиреязвенная, чумная, бруцеллезная, гриппозная, коревая, полиомиелитная, паротитная); «генетическая рулетка» дивергентные штаммы непатогенных бактерий и вирусов, имеющие родственные АГ с АГ возбудителей (оспенная вакцина); рекомбинантные штаммы возбудителей, полученные генно- инженерным способом (векторные вакцины). Вакцинальный процесс – формирование специфического иммунитета к возбудителю инфекционной болезни. Получение живых вакцин: культивирование вакцинного штамма в производственных условиях (бактерийные штаммы – на питательных средах, вирусные – на куриных эмбрионах или в культурах клеток); полученную чистую культуру вакцинного штамма стандартизуют и подвергают лиофильной сушке вместе со стабилизатором (альбумин, сахароза с желатиной); вакцину контролируют по: концентрации живых бактерий или вирусов вакцинного штамма, остаточной влажности, безвредности, аллергенности, иммуногенности и др. Убитые вакцины В результате инактивации возбудители полностью теряют жизнеспособность, но сохраняют антигенные и иммуногенные свойства. Для инактивации возбудителя используют: физические (нагревание, ультрафиолетовое облучение, ионизирующая радиация); химические (формалин, спирт, фенол) методы. Убитые вакцины: корпускулярные вакцины содержат целые возбудители (цельноклеточные, цельновирионные вакцины), или структурные элементы микробов, несущие специфические протективные антигены (субклеточные, субвирионные вакцины). молекулярные вакцинысодержатАГ в молекулярной форме (анатоксины). Получение убитых вакцин: культивирование вакцинного штамма; инактивация (0,4 % формальдегидом при 37—40 ОС в течение 4 нед); очистка от балластных компонентов; стандартизация; лиофильная сушка. Вакцину контролируют по основным показателям: остаточной вирулентности, содержанию бактерий или вирусов вакцинного штамма, остаточной влажности, стерильности, безвредности, аллергенности, иммуногенности и др. Химические вакцины Создаются из антигенных компонентов микробной клетки химическим путем (субъединичные). Полисахаридные вакцины (Менинго А+С, Акт-ХИБ, Пневмо 23, Тифим Ви), ацеллюлярные коклюшные вакцины. Анатоксины Анатоксины – обезвреженные токсины. Получение анатоксина: культивирование токсигенного штамма; фильтрование через бактериальные фильтры; обезвреживание формалином (0,4 % при 37-40 ОС 4 нед.); очистка и стандартизация; добавление адъюванта. Анатоксины контролируют: остаточной токсичности, концентрации, стерильности, безвредности, аллергенности, иммуногенности и др. Применяются анатоксины против столбняка, дифтерии, ботулизма, газовой гангрены, стафилококковой инфекции. Адъюванты Адъюванты (adjuvant — помощник) – вещества, повышающие иммуногенность при добавлении их к вакцинам. Иммуногенность сорбированных препаратов повышается в сотни раз. минеральные соединения (гидроокись алюминия); микробные структуры (белки, нуклеиновые кислоты, липополисахариды); синтетические вещества (полинуклеотиды, гликопептиды, полиоксидоний); цитокины и пептиды; Механизмы действия адъювантов: создание «депо» АГ в месте введения вакцин; воспалительная реакция, активирующая иммунокомпетентные клетки; активация процесса захвата АГ и его переработки фагоцитами. Рекомбинантные вакцины Рекомбинантные вакцины – препараты, полученные биосинтезом при культивировании рекомбинантных штаммов бактерий и вирусов. Преимущество: использование только тех АГ, которые необходимы для формирования иммунитета; дешевизна, безопасность. Принцип создания: ген, кодирующий протективный АГ возбудителя «встраиваются» в геном вирусов, бактерий или эукариотов. При этом, наряду с АГ хозяина нарабатывается и необходимый для получения вакцины протективный АГ. Вакцина против гепатита В, состоящая из чистого HBs-АГ, полученного генно-инженерным путем (в геном дрожжевой клетки был встроен ген HBs-АГ и клетка получила способность его продуцировать). Ассоциированные вакцины Ассоциированные вакцины состоят из нескольких составляющих и предназначены для одновременной иммунизации против нескольких инфекций. АКДС, вакцина против полиомиелита, живая ассоциированная вакцина против кори, паротита и краснухи. Комбинированная иммунизация – одновременное раздельное введение в организм нескольких несовместимых в одном препарате моновакцин, например чумной и оспенной вакцины. • Под инфекционным процессом понимается совокупность патологических изменений в организме, возникающих под действием патогенных микроорганизмов в определённых условиях внешней среды и при наличии защитных реакций организма на это воздействие. • Эпидемический процесс – процесс распространения инфекционного заболевания среди населения. Он включает 3 звена: -Источник инфекции -Механизмы и пути передачи -Восприимчивый организм Диагностические сыворотки Диагностические сыворотки применяются для выявления АГ возбудителей в клиническом материале и для определения вида или типа возбудителя (серологическая идентификация микроорганизмов). Получение: иммунизация животных (кроликов) соответствующими АГ. Из крови получают сыворотку, добавляют консервант, контролируют стерильность, специфичность, высоту титра и при необходимости лиофилизируют. Люминесцентные сыворотки готовят из специфических иммунных сывороток, из них извлекают глобулиновую фракцию и обрабатывают флюорохромами. Антигенсодержащие препараты Для определения в сыворотке больных специфических АТ. Диагностикумы – взвесь убитых возбудителей или их отдельных компонентов в физиологическом растворе. Эритроцитарные диагностикумы – взвесь эритроцитов с адсорбированными на них антигенами. Аллергены – антигенсодержащие препараты, используемые для кожноаллергических проб. Туберкулин, бруцеллин, тулярин, антраксин, токсоплазмин. Антигены – препараты, содержащие отдельные АГ возбудителей. Бактериофаги Бактериофаги – это иммунобиологические препараты, состоящие из фагов (вирусов бактерий). Получение: инфицирование фагом культуры бактерий, чувствительной к данному фагу. Затем их фильтруют, концентрируют, очищают. Бактериофаги выпускают в виде таблеток, в сухом и жидком виде. Бактериофаги применяют для профилактики и лечения ряда бактериальных, чаще всего кишечных инфекций (холера, брюшной тиф, дизентерия). Препарат назначают перорально или местно. |
